Természetes szteroid-glikozidok és 3-arilidén-1-tioflavan-4-on oxidációs termékek NMR szerkezetvizsgálata
|
|
|
- Krisztián Csonka
- 7 évvel ezelőtt
- Látták:
Átírás
1 Természetes szteroid-glikozidok és 3-arilidén-1-tioflavan-4-on oxidációs termékek NMR szerkezetvizsgálata Készítette: Kovács József Témavezetõ: Dr. Tóth Gábor c. egyetemi tanár Budapest 2002 Készült a BUDAPESTI MÛSZAKI és GAZDASÁGTUDMÁNYI EGYETEM 1. Bevezetés ÁLTALÁNS ÉS ANALITIKAI KÉMIA TANSZÉKÉN 1
2 Doktori értekezésemet a BME Vegyészmérnöki Kar, Általános és Analitikai Kémia Tanszék NMR Kutatócsoportjában készítettem Dr. Tóth Gábor c. egyetemi tanár témavezetésével, a Kar Bruker DRX-500 típusú NMR berendezésén. Munkám során egyrészt új, ismeretlen szerkezetû természetes vegyületeket, melyek erõs, szívre gyakorolt hatásuk miatt potenciális szívgyógyszerek, másrészt biológiailag aktív vegyületeket és azok származékait vizsgáltam. A vizsgált természetes vegyületek sztereokémiai és NMR vizsgálatai az NMR Kutatócsoport és a annoveri Egyetem Szerves Kémia Intézete között egy DFG projekt keretében folynak. Ezeket a mintákat szívglikozidokat Egyiptomban honos gyógynövényekbõl izolálták. A tioflavanon epoxidok és származékainak (szulfoxidok, szulfonok) elõállítására a debreceni Kossuth Lajos Tudományegyetemen került sor Dr. Lévai Albert irányítása alatt. Az értekezésben eltekintek a kísérleti körülmények részletes megadásától, mivel a témákat feldolgozó közleményekben ezeket ismertettem. Ez alól kivételt képeznek a csatolási állandó meghatározásához szükséges mérési módszerek, mely a témával részletesebben foglalkozó 4. Fejezetben kaptak helyet. A könnyebb kezelhetõség végett a vegyületek számozását és az irodalomjegyzéket az egyes fejezetekben külön-külön adom meg. Az adott tématerülettel kapcsolatosan megjelent tudományos közlemények, elõadások és poszterelõadások felsorolása az egyes fejezetek végén található rövid összefoglaló részeként jelenik meg. 2
3 2. Szerves vegyületek szerkezet-felderítésének stratégiája 1,2,3 A molekulák kémiai és biológia sajátságainak, továbbá esetleges hatás-szerkezet összefüggések megértéséhez elengedhetetlenül szükséges a dinamikus háromdimenziós molekulaszerkezet ismerete, valamint ennek különbözõ kölcsönhatásokban (pl. gazda-vendég) történõ speciális változásainak a feltérképezése is. Napjainkra a speciális két- és háromdimenziós módszerek rutinszerû használatának következtében az NMR spektrumban kapott jelek hozzárendelésének biztonsága rendkívül megnövekedett. Ennek hatására lehetõség adódik az egyes molekulák konformációs és dinamikus sajátságainak feltárására is. Az elsõdlegesen detektált idõfüggõ jelet, a FID-et Fourier-transzformációval alakítják át frekvenciafüggõ jellé. A többdimenziós mérések esetében azonban ez a frekvenciafüggõ jel modulálva van a pulzusprogramban meghatározottak szerint. Ez lehet valamilyen mag kémiai eltolódása, de megtalálhatjuk az egy és több kötésen keresztüli csatolási állandókat is. A teljes információ kinyeréséhez ezért összesen n-szer kell Fourier-transzformálnunk, ahol n a mérés dimenzióját jelenti. Alapvetõ mérési típusként a CSY, TCSY, MQC, SQC, MBC, NESY, RESY mérési módszereket említhetjük meg, melyek egy olyan mérési arzenált jelentenek, aminek segítségével viszonylag rövid idõ alatt eljuthatunk a különbözõ szerves molekulák szerkezetmeghatározásáig. Az 1. Ábrán a szerkezet-felderítés vázlatos stratégiáját mutatom be. Teljesen ismeretlen vegyület esetében szükségünk van egy biztos összegképletre, melyet vagy a klasszikus módszerekkel végzett elemanalízis, vagy pedig a nagyfelbontású MS spektroszkópia szolgáltat. Ezek után felvesszük a vegyület 1 és 13 C spektrumát (vagy egyéb, a mintában jelentõs számban elõforduló mag NMR spektrumát, amennyiben ez lehetséges). Ezek alapján már következtethetünk a jellegzetes csoportok (pl. aldehid, észter, aromás jellegû csoportok) meglétére. Teljes bizonyosságot azonban csak a korrelációs mérési módszerek használatával érhetünk el. A 1, 1 -CSY mérés segítségével az egymáshoz kapcsolódó X n egységek (X: C, N, esetenként, stb.) sorrendjét kapjuk, meg míg a spinlock körülmények között felvett TCSY módszer segítségével az egész csatolódó spinrendszert nyomon követhetjük egészen addig, míg vagy kvaterner szénatom, vagy heterotaom nem állja a transzfer útját. Mivel az átvitt mágnesezettség függ az egyes protonok közötti csatolási állandótól, ezért némely esetben a 3
4 Elemanalízis Összegképlet Nagyfelbontású MS 1 kémiai eltolódások Funkciós csoportok 13 C kémiai eltolódások, CSY (TCSY) ( n J, ) Szerkezeti alegységek C, CSY ( n J C, ), NE(SY), RESY Szerkezeti képlet 2 J C,, 3 J C, és 1 J C,C kapcsolata Relatív konfiguráció NESY, RESY (EXSY) Konformáció 3 J, és 3 JC, diéderes szög EXSY T 1 és T 2 relaxáció Dinamika, host/guest kölcsönhatás õmérsékletfüggés áromdimenziós molekulaszerkezet 1. Ábra: Az NMR módszerekkel történõ szerkezet-felderítés stratégiájának vázlata 4
5 nullához közeli csatolási állandó nagymértékben lecsökkentheti a módszer hatékonyságát. Ekkor az éppen ilyen kis csatolásokra optimált távolható (Long-range) CSY-t célszerû alkalmazni. Az egyes C n protonokhoz tartozó szénatomokat a korrelációs spektroszkópia heteronukleáris változataival, leggyakrabban MQC és SQC mérésekkel tudjuk meghatározni: a kapott spektrumban az adott proton (vagy protonok) keresztcsúcsot ad a hozzá kötõdõ 13 C atommal. Amennyiben a mérés nem az egykötésen keresztüli csatolásokra van optimálva, hanem a lényegesen kisebb 2 J C, és 3 J C, csatolásokra, úgy eljutunk a MBC méréshez (direkt detektált változata a CLC). A MBC segítségével, mely a két, illetve három kötésre lévõ 13 C és 1 atomok között teremt kapcsolatot, megvalósíthatjuk az egyes csoportok szerkezeti alegységekké történõ rendezését, ezek kapcsolódási sorrendjének meghatározását. Így eljutunk a szerkezeti képlethez. Ennek alátámasztására és finomítására hasznosíthatjuk a nukleáris verhauser effektust (NE) is, ami abban nyilvánul meg, hogy egy atommag besugárzásának hatására a térközelben elhelyezkedõ egyéb magok jelének intenzitása megnövekszik. Ez az intenzitásnövekedés azonban a protonok közti atomtávolság növekedésével erõteljesen (a távolság hatodik hatványával fordítottan) csökken, így a maximum 50 nm-nél (5Å) közelebbi hidrogénatomok azonosíthatók. A mérés kétdimenziós változata, a NESY (RESY) spektroszkópia, a keresztcsúcsok térfogati integrálja alapján a távolságok kvantitatív meghatározását is lehetõvé teszi, amennyiben megfelelõ viszonyítási térfogat/távolság a rendelkezésre áll. Az eddigi spektrális adatok alapján már megállapíthatjuk a molekula relatív konfigurációját, azaz a háromdimenziós szerkezetét. Azonban a szerkezetvizsgálat itt még koránt sem ér véget, hisz ez csupán egy álló, statikus kép. Egy molekulaszerkezetnek, azonban idõfüggése, dinamikája is van, mely jórészt az egyes konformerek (energiaminimumok) és tautomerek egymásba alakulását jelentik a megfigyelési hõmérsékleten. A konformációs viszonyok leírásához elsõsorban a vicinális csatolási állandók és a csatolást kialakító atomok közötti diéderes szög ún. Karplus-típusú összefüggését, valamint a cserélõdési viszonyokat megadó EXSY módszert használhatjuk fel. Sor kerülhet még a továbbiakban hõmérsékletfüggõ NMR mérésekre, végül a T1 és T2 relaxációs idõk meghatározásával tehetjük teljessé a vizsgálatokat, kapjuk meg az adott molekula térbeni és idõbeni leírását. 5
6 2.1 Irodalomjegyzék [1] Tóth G. Magyar Kémikusok Lapja, 1998, 53: K62. [2] Duddeck, Dietrich W, Tóth G. Structure Elucidation by Modern NMR (workbook), Springer, 3 rd and revised ed., [3] Brown S, Kalinowsky, Berger S. 150 and More Basic NMR experiments, Wiley-WC,
7 1 3. Az NMR módszerek fejlõdésének irányai Idén ötvenhét éve annak, hogy két amerikai egyetem kutatói függetlenül egymástól észlelték a mágneses magrezonancia jelenségét: Bloch, ansen és Packard (Stanford University), valamint Purcell, Torrey és Pound (arward University). Felfedezést követõ évtizedek NMR fejlõdését jól mutatja, hogy 1952-ben a fent nevezett kutatók nem kémiai, hanem fizikai Nobel-díjat kaptak. Azóta eltelet számos évtizednyi fejlesztõi munka, melynek eredményeképpen napjainkban az NMR spektroszkópia a kémiai szerkezetkutatás egyik alapvetõ és mondhatni, leghatékonyabb módszerévé vált. Felhasználása rendkívül széles, megtalálhatjuk mind a szerves- és biokémia, gyógyszerkémia, mind az anyagszerkezet vizsgálat és analitika területén. Újabban rendkívüli jelentõséggel bír az orvosi diagnosztikában is. A fejlõdés azonban koránt sem állt meg, hiszen az újabb és nagyobb térerejû mûszerek, a digitális elektronika kiterjesztése, a rádiófrekvenciás tekercsek fejlesztése, valamint a többcsatornás mérõfejek bevezetése biztosítják a terület töretlen fejlõdését. Ezt nagyon jól tükrözi az NMR egyik legnagyobb úttörõjének, Richard Ernstnek ben kapott kémiai Nobel-díja. Az NMR hatékonysága és teljesítõképessége is rendkívül sokat fejlõdött, még akkor is, ha csak az elmúlt tíz évet nézzük. Áramló oldatos rendszerekben mûködõ készülékek naponta akár ezer spektrumot is képesek rögzíteni, ezzel jelentõsen csökkentve az egy mérésre esõ költségeket. Ennek hatására lehetõség adódott a kombinatorikus kémia területen történõ felhasználásra is, ahol a teljesítmény/ár hányados nagyságágának rendkívül fontos szerep jut. A szilárd fázisú NMR megvalósítása újabb lépést jelentett mind a kémiai, mind a biokémiai vizsgálatokban, melynek hatására még jobban megnõtt az NMR felhasználók tábora. Az NMR módszerek alkalmazása azonban nemcsak sokat nyújt, hanem rendkívül sokat is követel. Ez elsõsorban a meglehetõsen szerény (legalábbis a legtöbb alkalmazott spektroszkópiai módszerhez képest) érzékenységének tudható be, mely abból fakad, hogy a magspin alap és gerjesztett állapota között rendkívül kicsiny, kb J/spin, energiakülönbség van. Ezt jól tükrözi az NMR egyik alapegyenletének is tekinthetõ összefüggés (1. Egyenlet), mely a jel/zaj viszonyt (signal/noise) adja meg. 7
8 S N = n γ γ 32 NS 12 T 1 T2 B / / 1 3/ 2 / gerj det 1. Egyenlet: NMR mérések jel/zaj viszony függése G Q c T Ahol az egyes betûk jelentése a következõ: n: molekulák száma γ: giromágneses tényezõ NS: akkumulálások száma T: abszolút hõmérséklet T 2 : spin-spin relaxációs idõ B: mágneses térerõ G: mérõfejre jellemzõ állandó Q: jósági tényezõ c 2 : elõerõsítõ zajfaktora T c : rádiófrekvenciás adó- és vevõtekercsek aktuális hõmérséklete A zárójelben található paraméterek a mérõfejre vonatkoznak, így tulajdonképpen hardwarefüggõek. A következõkben jórészt a fenti képlet alapján szeretném bemutatni azokat a technikai újításokat, melyek az NMR közelmúltban való fejlõdését mutatják. A képletbõl kitûnik, hogy az NMR mérések érzékenységét jelentõsen növelhetjük, ha az egyes méréseket egymásra rögzítjük, akkumuláljuk. Ezen túlmenõen nagy hatása van az NMR hasznos mérési térfogatában jelenlévõ molekulák számának. Ennek növelésének legegyszerûbb módja, ha nem a szokásos 5 mm átmérõjû csövet alkalmazzuk, hanem szélesebb mintacsövet használunk. Ehhez azonban speciális mérõfej is szükséges, mely szélesebb furattal rendelkezik, valamint a mágneses tér mintán belül elérhetõ homogenitása is fordítottan arányos a mintacsõ szélességével. Amennyiben, és ez pl. természetes vegyületek vizsgálatakor mindennapos, csak korlátozott mennyiségû minta áll rendelkezésünkre, úgy elõnyösebb a nemrégiben elterjedt ún. Shigemi csõ használata, melyek olyan speciális üvegbõl készülnek, amelyek szuszceptibilitása megegyezik a deuterált oldószerével, valamint speciális kiképzésük folytán a megfelelõ homogenitáshoz elegendõ oldatmennyiség is jóval kevesebb. Természetesen minden oldószerhez külön csövet kell használnunk, azonban kb. 16-szoros érzékenységnövekedés rendszerint megéri ezt az áldozatot. Egy másik nagy elõrelépést ezen a területen az ún. átfolyó cellás mérõfej hozott, melyhez szükséges mintatérfogat csupán µl, melyet folyamatos és stop/flow üzemmódban is 2 c 8
9 használhatunk. A módszer megnövekedett érzékenysége abból fakad, hogy megszûnt a mintát és a rádiófrekvenciás tekercseket elválasztó légrés, speciális anyagból készült és speciálisan kialakított adó- és vevõtekercsek közvetlenül a küvetta falán helyezkednek el, ami a G (mérõfejre jellemzõ állandó) és a Q (jósági tényezõ) nagymértékû javulását eredményezi. Az egyes mérõcella kialakításokat az 1. Ábrán követhetjük nyomon. 1. Ábra: NMR mérõcsövek A manapság használatos modern NMR spektroszkópiában rendszerint olyan pulzustechnikákat használnak, melynél mind a gerjesztéshez (γ gerj ), mind a detektáláshoz (γ det )a hidrogén atomot használják, mivel ez a mag rendelkezik a legnagyobb giromágneses tényezõvel. Pl. γ 1 /γ 13 C = 4. Egyéb lehetséges variációkat az 1. Táblázatban mutatok be a relatív érzékenység és idõ feltüntetésével együtt. 2 Amint látható, az érzékenység jelentõs növekedése miatt, a megfelelõ minõségû spektrum felvételéhez szükséges idõ drámaian lecsökken, teret adva az adott minta sokrétû vizsgálatának. Kísérlet gerj./det. mag relatív érzékenység fajlagos idõ 1D 13 C{ 1 } NE nélkül 13 C/ 13 C D 13 C-DEPT 1 / 13 C D C,-CSY 1 / 13 C D,C-CSY 1 / Táblázat: agyományos mérési módszerek relatív érzékenysége 9
10 A nagy mágneses térerõn végzett, protondetektált (inverz) heteronukleáris mérési módszerek megnövelt érzékenysége folytán manapság már olyan módszerekkel rendelkezünk, melyekkel alig néhány mg, néhány esetben ng anyagmennyiségû mintából a teljes szerkezet felderíthetõ még viszonylag bonyolult molekulák esetében is. Azaz rövid idõ alatt képet kapunk a minta konformációs, izoméria és tautomer viszonyairól. A mágnesezettség egyik magról a másikra történõ átvitele és kifejlõdése a kötõ elektronok közvetítésével, téren keresztül, dipól-dipól kölcsönhatások, vagy kémiai kicserélõdés révén történhet meg. Ennek alapján a kétdimenziós NMR mérési módszerek 2. Ábrán látható csoportosítását tehetjük meg. 1.) kötõ elektronok közvetítésével 2.) téren keresztül, dipol-dipol kölcsönhatások révén (skaláris csatolódás, J) (dipoláris csatolódás) 1.a) kémiai eltolódás korreláció NESY (RESY) CSY (TCSY) 1.b) csatolás felbontott spektroszkópia 3.) kicserélõdési spektroszkópia (J resolved) (EXSY) J 2. Ábra: A mágnesezettség átvitelének és kifejlõdésének módjai 10
11 Az 1. Egyenlet további tanulmányozásakor kitûnik, hogy a mérések érzékenysége, és ezzel párhuzamosan a hatékonysága is nagyban függ az alkalmazott mágneses térerõtõl ( B 2/3 ). Ezen a területen a jelentõs áttörést a szupravezetõ mágnesek hozták meg, mellyel a 90-es évek elejére a cseppfolyós hélium hõmérsékletén mûködõ mágnesek már 17.6 Tesla térerõt voltak képesek létrehozni, amely a 750 Mz 1 frekvenciának felel meg. A továbblépést a napjainkban kereskedelmi forgalomban is kapható 21.1 Tesla (900 Mz) térerõt elérõ mûszerek felé az ún. Joule-Thompson hûtõegység bevezetése jelentette, melynek segítségével a hélium folyamatos elpárologtatása révén a szupravezetõ 2 Kelvin fokra történõ hûtése lehetséges. A nagyobb térerõ hasznossága nemcsak az érzékenység növekedésében, hanem a jelek diszperzitásában is megnyilvánul, így egy 500 Mz-en zsúfolt proton spektrum jelei lényegesen jobban elkülönülnek magasabb térerõn, amely nagyban megkönnyíti a jelek biztos hozzárendelését. Az érzékenységet leíró egyenletet tovább szemlélve eljutunk a zárójelben lévõ tényezõkhöz, amik közül a G és Q már említettem a mérõcsövek tárgyalása kapcsán. A kedvezõtlen termikus zaj csökkentésének egyik megoldása, hogy magukat a rádiófrekvenciás tekercsek hõmérsékletét csökkentjük le az ún. kriogén tartományba. Ekkor a tekercsek ellenállása lecsökken, aminek folytán a Q jósági tényezõ jelentõsen nõ. További elõrelépést jelentett a rádiófrekvenciás tekercsek 25 Kelvinen mûködõ, szupravezetõ kerámiából történõ elõállítása, valamint a hûtött elõerõsítõvel egybeépített ún. Cryo-fej használata. Ezek a fejlesztések annyira erõteljesen növelik az érzékenységet, hogy a szükséges anyagmennyiséget a ng tartományba sikerült leszorítani, ugyanis a jel/zaj viszony akár 3-7-szeresére is növelhetõ, ezzel együtt a szükséges mérési idõ jelentõsen lecsökken (2. Egyenlet). mérésidõ cryo = mérésidõ hagyományos ( S / N) ( S / N) hagyományos cryo 2 2. Egyenlet: Mérési idõ számolása Cryo-fej esetén Az NMR mérési módszer másik nagy problémája a kis érzékenység mellett az, hogy a minta szennyezései nagyban nehezíthetik a jelhozzárendelést. Elsõsorban akkor, ha a szennyezése mennyiségileg összemérhetõ a meghatározandó anyagéval. Az egyik lehetséges módszer ebben az 11
12 esetben az egyes komponensek diffúziója szerinti szétválasztás, amivel a DSY (Diffusion rdered SpectroscopY) módszer foglalkozik. Azonban a leghatékonyabb megoldásnak a folyadékkromatográfia (LC) és az NMR összekapcsolása bizonyult. Ehhez az elsõ ábrán látható átfolyó cella használatos. A legnagyobb problémákat ebben az esetben a rendkívül nagy oldószerjelek (eluens), valamint az LC a mágnestõl való viszonylag távoli elhelyezése okozza. Az elõbbi probléma kiküszöbölésére számos olyan speciális pulzusprogram született, amely hatékonyan képes elnyomni az oldószerektõl származó jeleket. Míg az utóbbi probléma esetén igazi áttörést csak a különleges árnyékolású mûszerek megjelenése jelentett. Az UltraShield technológiának nevezett módszer lényege, hogy a belsõ szupravezetõ tekercs mellett, ami a mágnes furatán belüli mágneses térért felel, egy külsõ, ellentétes polaritású mágnes is helyet kap a mûszerben. Ennek hatására a külsõ mágneses tér nagyrészt kioltja a belsõ mágnes szórt terét. Ezenfelül növeli a mintában képzõdõ tér homogenitását is. Ennek az árnyékolási technikának köszönhetõen az LC mûszereket, valamint egyéb elektronikus egységeket is, lényegesen közelebb lehet elhelyezni a mágneshez, mely nagymértékben csökkentette a kromatográfiás holtidõ nagyságát, valamint a szükséges oldószermennyiséget. Végezetül röviden kitérnék a szilárd fázisú NMR spektroszkópia néhány aspektusára. Egyik legfontosabb módszere a R-MAS (igh Resolution Magic Angle Spinning), ami inhomogén minták esetében is alkalmas nagyfelbontású proton felvételek készítésére. A módszer alapja, hogy a mintát kis térfogatú, a mágneses térhez képest 54.7 fokot (ún. mágikus szöget) bezárva helyezik el, és néhány Kz-es frekvenciával forgatják, ezáltal a dipoláris csatolások okozta jelkiszélesedés elmarad. Az érzékenység növelésének új vonalait a dinamikus magpolarizáción alapuló ELDR technika, valamint a SPINE effektuson alapuló módszerek jelentik. Az elõbbi esetben kis mágneses térben gyököket állítanak elõ állófázison kötött molekulákból. A vizsgált mintát ezen az állófázison vezetik keresztül, melynek hatására a mágnesezettség az elektronspinrõl a magspinre tevõdik át. Ennek hatására az elektron giromágneses tényezõjébõl adódóan proton esetében 660-szoros, míg 13 C esetében 2640-szeres érzékenységnövekedés valósítható meg. A SPINE (Spin Polarization Induced Nuclear verhauser Effect) esetében lézerpolarizált xenon és hélium keresztrelaxáció révén képes a lézer által kiváltott magpolarizációt más magra átvinni. Ez egyrészt kb. ötszörös érzékenységnövekedést jelent, másrészt az átvitt polarizáció nagysága függ 12
13 a xenon és a célmag távolságától, így a módszer távolságmérésre is alkalmas. Ezt a sajátságot élõ szövetek vizsgálatánál is alkalmazzák az orvosi diagnosztikában használt MRI módszernél. 3.1 Irodalomjegyzék [1] Tóth G. Magyar Kémikusok Lapja, megjelenés alatt [2] Gemecker G, Kessler. Methodology and Applications of eteronuclear and Multidimensional 13 C NMR to the Elucidation of Molecular Structure and Dynamics in the Liquid State. - in: Carbon-13 NMR Spectroscopy of Biological Systems. Ed: Beckmann N, Academic Press, Inc. 1995, Távolható csatolási állandók meghatározása A vicinális csatolási állandó diéderes szögtõl való függése közismert 1 és rendkívül fontos szerepet játszik a pontos szerkezetvizsgálatban. Protonok közt viszonylag egyszerûen mérhetõ (vagy számolható) ez a csatolási állandó, azonban a kis NMR érzékenységgel rendelkezõ, ámbár a szerves kémiában nagy gyakorisággal elõforduló magok (pl. 13 C, 15 N) esetében meglehetõsen komoly mérési problémákkal találjuk magunkat szemben. Ez egyrészt oda vezet, hogy kevés olyan mérési szekvencia létezik, mellyel gyorsan és hatékonyan tudunk távolható heteronukleáris csatolásokat meghatározni, másrészt még kevesebb olyan módszer található, amit a molekulák széles körében tudunk hasznosítani. Doktori munkám során gyakorta találkoztam a távolható csatolási állandók meghatározásának problémájával, elsõsorban konformációs vizsgálatok során. Ezért úgy éreztem, hogy dolgozatomban létjogosultsága van egy, a csatolási állandók meghatározásával foglalkozó résznek, amely elsõsorban az utóbbi években megjelent, témába vágó publikációkra alapoz, és fõ témája a 3 J(C,) meghatározása. Modellvegyületként a sztrichnint használtam. A dolgozat szerkesztésének megkönnyítése végett néhány spektrum irodalmi eredetû (ezeket külön jelzem a spektrumok magyarázatában), míg a többi esetben a Lipcsei Egyetem 400 Mz-es mûszerén felvett mérések eredményét mutatom be. 13
14 A fejezet a következõ mérési módszerek áttekintését tartalmazza: gs-etlc, SQC- TCSY, SQC-ECADE, GSQMBC, SQMBC, J-MBC-1, J-MBC-2, broadband J-MBC, J-IMPEAC-MBC, J-MQC. 4.1 Érzékenység-növelt gs-etlc A ETLC módszer alapjait 1991-ben Kurtz és munkatársai közölték, mely azonban nem rendelkezett megfelelõ érzékenységgel. 2 A gradiens szelekció elterjedésével megjelent a gs- ETLC is, melynek egyik legutolsó, érzékenység növelt változatát Uhrin és munkatársai (köztük Batta Gyula és Kövér Katalin) 1998-ban közölték. 3 A módszer E.CSY típusú jeleket eredményez, ami azt jelenti, hogy az F2 dimenzióban a távolható heteronukleáris csatolási állandó szerint, míg az F1 dimenzióban az egykötésen keresztüli heteronukleáris csatolási állandó szerint válnak szét a jelek. 14
15 1. Ábra: a gs-etlc pulzusprogram, a fehér és fekete téglalapok 90 és 180 fokos pulzusokat jelentenek, φ 1 : , φ 2 : , φ 3 : , d 2 = [4 ( 1 J C, )] -1, d 3 = [2 ( 1 J C, )] -1, d 20 = 3 δ, δ = effektív gradiens hossz, G x : 1 ms hosszú gradiens pulzus, G 1 : G 2 : G 3 : G 4 : G 5 = -20: -25: 25: 11: ±11. A pulzusprogramot az 1. Ábrán mutatom be. A szekvencia az eredeti BIRD elõkészítés helyett egy z,z-gradiens X-szûrõvel indul, melynek feladata a 12 C atomokhoz kötött protonok jelének szûrése a lehetõ legkisebb hasznos jelveszteséggel, melyet az elsõ gradiensnek ezen magokra történõ defókuszálásával érnek el. A továbbiakban adott kompozit X pulzus elsõ 90 fokos pulzusa váltakozó elõjelû a 12 C-hez kötött protonok hatékony szûréséhez. A kémiai eltolódás kifejlõdéséért felelõs t 1 periódus közepére egy ún. G-BIRD r szekvencia került, mely a távolható homonukleáris csatolásokhoz tartozó mágnesezettséget invertálja, míg a közvetlenül csatolt protonokhoz és az X magokhoz mágnesezettségre 0 fokos forgatás hat. A két egyenlõ nagyságú, de ellentétes irányú gradiens pulzus segítségével így a homonukleáris csatolásokat kiszûri a G-BIRD r. Ez elsõdlegesen egyszerûbbé teszi a spektrumot, másrészt növeli az érzékenységet. Másodlagos funkcióként skálázást alkalmazhatunk az egykötésen keresztüli csatolásokra, mely az F1 dimenzióban fellépõ zsúfoltságot szüntetheti meg hatékonyan. A pulzusprogram végén egy gs-tcsy szekvenciát találunk, mely az érzékenységnövelt DIPSI-2 keverési módot használja, mely mind a P-, mind az N-típusú mágnesezettségi komponenst megtartja. Végül echo/anti-echo gradiens szelekciót alkalmazunk az akvizíció elõtt, mely az érzékenység további növelését hivatott elvégezni. Amint a 2. Ábrán bemutatott spektrumon láthatjuk, a pulzusprogram jelentõsen megújult, a módszer érzékenysége olyan jelentõsen megnõtt, hogy képes a mai elvárásoknak is 15
16 2. Ábra: A sztrichnin érzékenységnövelt gs-etlc spektruma; 4 a csatolási állandók az egyes keresztcsúcsok F1 dimenzióban felhasadt szeleteinek (d e és f - g) eltolódáskülönbségével egyenlõek megfelelni. A kapott spektrum analízise rendkívül egyszerû, hiszen elegendõ az F1-ben dublettként szétvált keresztcsúcs két részének F2-beli különbségét leolvasni, mivel ez a különbség megegyezik a heteronukleáris csatolási állandóval. A módszer nagy elõnye, hogy a meghatározás pontossága csupán az F2 dimenzió felbontásától függ, így olyan esetekben is jól használható, amikor a csatolási állandó kisebb, mint a jelek szélessége az F2 dimenzióban. A kapott csatolási állandók tovább is megkülönböztethetõek, mivel az egy- és háromkötésen keresztüli csatolások ellentétes eltolódást okoznak F2-ben, mint a kétkötésen keresztüliek. 16
17 A módszer hátrányai között elsõsorban a TCSY mágnesezettségi átvitelt kell megemlíteni, mely a folytonos proton-proton spinredszerekre csökkenti le a módszer alkalmazhatóságát. Ugyancsak ezzel függ össze az a tény is, hogy a keresztcsúcs nagysága közvetlenül függ az átvitelben résztvevõ protonok közötti csatolási állandótól. A proton dimenzió spektrális diszperziójából származó hibák kiküszöbölésére született meg a SQC-TCSY és a SQC- ECADE mérési módszer. 4.2 SQC-TCSY Kövér és munkatársai 1997-ben publikálták a SQC-TCSY legújabb, érzékenység-növelt változatát, 5 melyben a Kay és munkatársai által javasolt gradiens szelekciót alkalmazták. 6 A módszer a mágnesezettség átvitelhez az egykötésen keresztüli 1 J(C,) csatolási állandókat, valamint TCSY transzfert használ, ezáltal elkerüli a kis távolható csatolásokon keresztüli átvitel összes problémáját. 3. Ábra: a SQC-TCSY pulzusprogram, a fehér és fekete téglalapok 90 és 180 fokos pulzusokat jelentenek, a szürke téglalap egy 2 ms hosszú trim pulzust jelöl, φ 1 : 0202, φ 2 : 0022, φ 3 : 1133, φ 4 : 0220, d 2 = [4 ( 1 J C, )] -1, δ = effektív gradiens hossz, G x : 1 ms hosszú gradiens pulzus, G 1 : G 2 = 40: ±10 (γ : ±γ X ) A pulzusprogramot a 3. Ábrán láthatjuk, melynek fõ részei közé tartozik a DIPSI-2 keverési módszer, mely mind az N-típusú, mind a P-típusú mágnesezettségi komponenst megtartja, ezáltal 17
18 növelve a mérés érzékenységét (MLEV típusú keverésnél ez nem lehetséges). A program 2 ms-os trim-pulzust használ a nem NMR aktív szénatomokhoz kötött protonok kiszûrésére, valamint gradiens pulzusokat és egy négylépéses fázisciklust a nem 4.a Ábra: A sztrichnin 13 C-lecsatolt SQC-TCSY spektruma 18
19 4.b Ábra: A sztrichnin 13 C-csatolt SQC-TCSY spektruma kívánt mágnesezettség kiszûrésére. A fázisciklus során a 13 C 90 fokos pulzusok fázisa invertálódik. A fázisciklus minden második lépésében az elsõ 90 fokos pulzus invertálódásával összhangban a vevõ fázisa is megváltozik, majd a harmadik és negyedik lépésben a második és harmadik 90 fokos pulzus is invertálódik, aminek megfelelõen a vevõ fázisa is megváltozik a gradiens pulzus koherencia-szelekciójával összhangban. A csatolási állandók mérése két lépésben történik. Az adott mintáról fel kell vennünk egy, a heteroatom által lecsatol spektrumot (4.a Ábra), valamint egy másik spektrumot, amelyben az akvizíció alatt engedjük a heteronukleáris csatolások fejlõdését (4.b Ábra). Ezáltal a második mérésbõl származó keresztcsúcsok tartalmazzák a heteroatom csatolását, míg az elsõ mérés során kapott jelek csupán a homonukleáris csatolások szerint hasadnak fel, így ez utóbbi jelet, mint referenciát használhatjuk fel a heteroatom által csatolt jelek szimulálásához. A kívánt sort kivéve, majd a referenciajelet a távolható csatolás értéknek felével balra és jobbra eltolva, majd összeadva a két eltolt jelet, szimulálhatjuk a távolható csatolásból származó hatást. Természetesen ez egy többlépéses folyamat, amelynek során egyre jobban megközelítjük a mért 19
20 jelet a szimulált jellel. A megfelelõ minõségû egyezés esetén az eltoláskor használt értéket tekinthetjük a meghatározandó csatolási állandónak. Ezt a folyamatot számítógépes segítséggel is elvégezhetjük, amely lényegesen meggyorsítja a folyamatot. Az eddigiekbõl kitûnik, hogy a módszer alkalmazásához nem szükséges teljesen abszorptív jeleket produkálnunk, hiszen a csatolt és lecsatolt spektrum fázisa teljesen megegyezik. Ez rögtön megszûnteti a referenciajel felvételének problémáját is, amely minden fázisérzékeny módszer ilyen típusú felhasználásának sajátja. A módszer legnagyobb hátrányát, csakúgy, mint a ETLC esetében, a TCSY transzfer jelenti, mivel csatolódó protonok nélkül nem tudjuk átvinni a mágnesezettséget, azaz kvaterner szénatomon, illetve heteroatomon keresztül nem tudunk csatolási állandót mérni. Ez a hátrány egyes esetekben (pl. glikozidos kötés körüli konformációs viszonyok vizsgálata) teljesen meggátolja a SQC-TCSY használatát. 4.3 SQC-ECADE A ETLC mérési módszer alapjaira épülõ SQC-ECADE (eteronuclear Couplings from ASSCI-Domain experiment with E.CSY-type cross peaks) pulzusszekvenciát Kozminski és Nanz publikálta. 7 A mérés az egyszeres kvantum koherenciára épül, melyet az érzékenységnövelt SQC szekvenciával érnek el. 8 A módszernek létezik többszörös kvantumú változata is, azonban ennek hosszabb volta miatt ez nem kedvelt. A publikált pulzusprogram az 5.a. Ábrán látható, mely az alap gradiens szelekciót tartalmazó SQC rész mellett egy, az érzékenységet növelõ részt (szaggatott vonallal körbevett rész), valamint egy 20
21 5.a Ábra: a SQC-ECADE pulzusprogram, a fehér és fekete téglalapok 90 és 180 fokos pulzusokat jelentenek, φ 1 : 0202, φ 2 : 0022, φ 3 : 0220, ψ: -π/2 echo-nál és +π/2 anti-echo esetén, R: BIRD X szekvencia, vagy szelektív gerjesztés (lásd alább), d 2 = [4 ( 1 J C, )] -1, δ = effektív gradiens hossz, G x : 1 ms hosszú gradiens pulzus, G 1 : G 2 : G 3 : G 4 = 30: ±40: ±40: b Ábra: Az R két lehetséges jelentése: BIRD x szekvencia (bal), d 3 = [2 ( 1 J C, )] -1 ; szelektív gerjesztés (jobb) ún. pszeudó evolúciós idõt (t * 1 ) is találunk. Ezt követi a DIPSI-2 szekvenciát használó izotróp keverés. Mind az érzékenységet növelõ, mind az I-spin keverési rész opcionális, azonban távolható csatolások meghatározásához ez utóbbi elengedhetetlenül szükséges, különben csak az egykötésen keresztüli csatolásokat tudjuk meghatározni. Mivel a t 1 evolúciós idõ alatt a heteronukleáris csatolások refókuszálódnak (a 180 fokos I- pulzus miatt), ezért bevezették a t * 1 pszeudó evolúciós idõt, melynek közepén elhelyezett BIRD X szekvencia (5.b Ábra, bal) biztosítja a heteronukleáris csatolások fejlõdését, valamint megakadályozza a homonukleáris csatolások és kémiai eltolódások fejlõdését. Ennek eléréséhez nem csak BIRD X szekvenciát használhatunk, hanem akár 180 fokos szelektív I-pulzust is (5.b Ábra, jobb). Ez utóbbi fõleg 1, 15 N méréseknél kedvezõ, hiszen a N tartományt könnyû szelektíven gerjeszteni, és ennek szekvenciának hossza lényegesen rövidebb, mint a BIRD pulzusé. Érdemes megemlíteni még a DIPSI-2 elõtt található kompozit S-pulzust. Eredményül a 6. Ábrán látható spektrumtípust kapjuk. A csatolási állandó A ETLC méréshez hasonlóan - megegyezik az F2 dimenzióban található jeleltolódással, míg az F1 dimenzióban megfigyelhetõ felhasadás nagysága 1 J IS (t * 1 /t 1 ). Ez utóbbiból következik, hogy tetszés szerint (de természetesen a T 2 relaxáció figyelembevételével) tudjuk változtatni a felhasadás mértékét F1-ben, ami erõsen átfedõ jelek esetében rendkívül hasznos. A mérés számos 21
22 elõnye (lásd ETLC) mellett azonban szintén szenved a DIPSI-2 mágnesezettségi átvitel hátrányaitól, nevezetesen nem alkalmas kvaterner szénatomokon és heteroatomokon keresztüli csatolási állandó mérésre. 6. Ábra: A sztrichnin SQC-ECADE spektrumának egy jellemzõ részlete 22
23 4.4 GSQMBC és SQMBC 7. Ábra: A GSQMBC pulzusprogram, a fehér és fekete téglalapok 90 és 180 fokos pulzusokat jelentenek, φ 4 : , d 2 = [4 ( 1 J C, )] -1,G x : 1 ms hosszú gradiens pulzus, G 1 : G 2 : G 3 = 20: 60: ±10 Marek és munkatársai 1997-ben publikálták a viszonylag rövid, ámbár meglehetõsen hatékony módszerüket távolható csatolások méréséhez, melynek a GSQMBC (Gradient-enhanced Single Quantum Multiple Bond Correlation) nevet adták. 9 Amint a névbõl, valamint az 7. Ábrán lévõ pulzusprogramból is kiderül a módszer egyszeres kvantumú koherencia generálásán alapul, melyet a program elején található INEPT transzfer hoz létre. Majd a heteroatomra (pl. 13 C, 15 N) átkerült mágnesezettség a t 1 evolúciós idõ alatt az X mag kémiai eltolódásával modulálva lesz. Ezt követõen egy 180 fokos, X magra adott kompozit pulzus két oldalán található a két defázisoló gradiens. A mágnesezettség protonra történõ visszavitele után az akvizíció alatt (t 2 ) fejlõdnek a heteronukleáris csatolások, valamint itt történik a dekódóló gradiens adása is. A szükséges gradiensnagyságot különbözõ magokra az 1. egyenlet segítségével számolhatjuk. A dekódoló gradienst alternálva adjuk, hogy fázisérzékeny adatokat nyerjünk, melyet a szokásos echo/antiecho protokoll szerint dolgozunk fel. G 2 -G 1 =(γ Η /γ X ) G 3 1. Egyenlet: Gradiens erõsségek összefüggése GSQMBC mérésnel 23
24 8. Ábra: A sztrichnin GSQMBC spektruma; 4 a csatolási állandót az egyes keresztcsúcsok kétféle fázisolásából (lásd a szöveget) származó υ a és υ d értékekbõl számíthatjuk a 2.Egyenlet segítségével A mérés eredményeképpen egy, a MBC-vel analóg spektrumot kapunk (8. Ábra), mely keresztcsúcsainak szerkezete tartalmazza a megfelelõ csatolási állandót. Ennek meghatározása történhet közvetlen leolvasással is abban az esetben, ha proton jelünk multiplicitása kicsi. Ugyanis a keresztcsúcsnak a heteroatom sorában kivágott szeletének jelformáját úgy 24
25 modellezhetjük, hogy a proton jelet eltoljuk a csatolási állandóval, majd invertáljuk és hozzáadjuk az eredeti jelhez. Ennek megfelelõen egy szingulett jelbõl egy antifázisú dublett keletkezik, melynek két ága közt mért távolság megegyezik a csatolási állandóval. A jelforma természetesen annál inkább bonyolódik, minél nagyobb a proton multiplicitása és minél közelebb van a heteronukleáris csatolási állandó értéke a homonukleáris csatolásokéhoz. További problémát jelentenek a kis csatolások meghatározása, ugyanis ha a csatolás nagysága összemérhetõ a jel szélességével, akkor közvetlen leolvasáskor túlbecsüljük a csatolási állandó értékét. asonló probléma kiküszöbölésére Prestegard és Kim 1989-ben egy külön eljárást javasolt. 10 Ehhez szükségünk van két csatolási állandóra, melyek egyikét (υ a ) a jel legabszorptívabb formájából, míg a másikat (υ d ) az ettõl 90 fokkal fáziseltolt jelbõl olvassuk le. Az így kapott értékekbõl a 2. Egyenlet segítségével kapjuk meg a valódi csatolási állandót. J 6 υ J 2 a υa υaυd υd J υa υaυd υaυd υd 16 8 υd υ a = 0 2. Egyenlet: csatolási állandó (J) meghatározása υ a és υ d felhasználásával. Amint láthatjuk a GSQMBC egy nagyon hatékony mérési módszer, melynek egyik legfõbb elõnye, hogy képesek vagyunk vele kvaterner szénatomon és heteroatomon keresztül is csatolási állandókat mérni. Megfelelõen nagy érzékenységgel rendelkezik ahhoz, hogy akár kis érzékenységû magokról (pl. 13 C, 15 N) viszonylag rövid idõ alatt csatolásokat határozzunk meg abban az esetben is, ha a minta ezeket a magokat csupán a természetben elõforduló 25
26 9. Ábra: A SQMBC pulzusprogram, a fehér és fekete téglalapok 90 és 180 fokos pulzusokat jelentenek, a szürke téglalap egy 2 ms hosszú trim pulzust jelöl, φ 1 : 0202, φ 2 : 0022, φ 3 : , φ 4 : , d 2 = [4 ( 1 J C, )] - 1, δ = effektív gradiens hossz, G x : 1 ms hosszú gradiens pulzus, G 1 : G 2 : G 3 = 80: 10: ±20 gyakorisággal tartalmazza. Legfõbb hátrányaként talán a csatolási állandók komplikált meghatározási módszerét kell megemlítenünk, mely a csatolásban résztvevõ proton multiplicitásának növekedésével arányosan növekszik. 26
27 10. Ábra: A sztrichnin SQMBC spektruma; 4 a g és k mért jelformákat a d és h mért referencia jelek segítségé-vel szimuláljuk az invertált és eltolt formáikkal (e és i) történõ öszeadással (f és j); az eltolás értéke a heteronukleáris csatolási állandóval egyenlõ Ehhez a módszerhez szervesen kapcsolódik a SQMBC (eteronucelar Single Quantum Multile Bond Correlation) mérési módszer is, 11 amely tulajdonképpen a GSQMBC egy finomított 27
28 változatának tekinthetõ. A pulzusprogramot megfigyelve (9. Ábra) tapasztalhatjuk, hogy egy G- BIRD R,X szekvencia került az INEPT részbe, mely amellett, hogy eltávolítja az egykötésen keresztüli korrelációkat, növeli a módszer érzékenységét. Ugyanis hatékonyan lecsatolja a távoli protonokat az INEPT preparáció alatt, melynek hatására egyrészt nõ hasznos jel nagysága, másrészt egységesebb fázist biztosít. A továbbiakban egy 2 ms hosszú trim-pulzust is találunk, mely a nem kívánt mágnesezettség defázisolását, valamint a vízjel elnyomását segíti. Mindezek mellett a pulzusszekvencia egy gradiens z,z-szûrõvel egészült ki, amely a mágnesezettség protonokra történõ visszavitele elõtt kapott helyet, mely a jelalak diszperzív hozzájárulását okozó mágnesezettséget szünteti meg. A fentebb ismertetett módosításoknak köszönhetõen az alapelgondolás egy megnövekedett érzékenységgel valósul meg. A feldolgozási módot, valamint magát a spektrumot a 10. Ábrán láthatjuk. 9 Referencia jelnek legjobban az egykötésen keresztüli keresztcsúcs használható, hiszen a keresztcsúcs több mint 100 z-es 1 J(C,) csatolással elválasztott két részének metszete csak a homonukleáris csatolásokat tartalmazza (10. Ábra d és h). Az elõnyök és hátrányok a GSQMBCnél ismertetettekkel azonosak, így itt nem kívánok kitérni ezekre ismét. 4.5 J-MBC-1 és J-MBC-2 Furihata és Seto 1999-ben közölték legújabb módszerüket, a csatolási állandó skálázott MBC-t, 12 amely azon túlmenõen, hogy számos, a csatolási állandók meghatározásakor felmerülõ problémát elkerül, viszonylag egyszerû pulzusszekvenciával rendelkezik. a megfigyelünk egy rutin MBC módszert, tapasztalni fogjuk, hogy a heteronukleáris csatolási állandók csupán a kémiai eltolódás kifejlõdése alatt vannak lecsatolva (a t 1 idõ felénél lévõ 180 fokos proton pulzussal). Az elsõ két 90 fokos szénpulzus között szabadon fejlõdhetnek a csatolási állandók, mely idõ hosszával a MBC mérésünket optimalizálhatjuk különbözõ nagyságú csatolásokra. Ennek eredményeképpen az összes keresztcsúcs tartalmazza a megfelelõ heteronukleáris csatolási állandót az indirekt dimenzióban. Természetesen ezek mérése, a meglehetõsen kicsi digitális felbontás miatt, gyakorlatilag lehetetlen. Furihata és Seto azonban itt alkalmazta az ún. J-scaling módszert, azaz egy megfelelõ szekvenciával olyan nagyságúra növelte a csatolási állandókat, amely már mérhetõ az F1 dimenzió felbon- 28
29 11. Ábra: A J-MBC-1 pulzusprogram, a fehér és fekete téglalapok 90 és 180 fokos pulzusokat jelentenek, φ 1 : 0202, φ 2 : 0022, φ 3 : 0220, 1 = [2 ( 1 J C, )] -1, n: skálafaktor, G x : 1 ms hosszú gradiens pulzus, G 1 : G 2 : G 3 = 50: 30:
30 12. Ábra: A sztrichnin J-MBC-1 spektruma tása mellett is. Természetesen növelte szó nem a tényleges állandók megváltozását jelenti, csupán azoknak a spektrumban megjelenõ nagyságát változtatja. A J-MBC-1 szekvenciát tekinthetjük a módszer alapjának, 12 mivel csak a csatolási állandó növeléséhez szükséges plussz pulzusokat tartalmazza. Ez pedig nem más, mint az 11. Ábrán látható n t 1 idõintervallum, melynek közepén 180 fokos proton és 180 fokos szén (vagy az X magra adott) pulzus található. Az indirekt dimenzió kémiai eltolódása csak t 1 idõ alattfejlõdik, mivel n t 1 alatt lecsatolódik. A proton-proton csatolások fejlõdését nem tudjuk lecsatolni, így ezek fejlõdése (n+1) t 1 idõ alatt történik, míg a heteronukleáris csatolási állandók fejlõdésére n t 1 idõ áll rendelkezésre, mivel ezek t 1 alatt lecsatolódnak. Ennek eredményeképpen a keresztcsúcsok F1 dimenzióban egyrészt tartalmazzák a (n+1)-szeres nagyságúra növelt proton-proton csatolásokat, másrészt az n-szeres nagyságúra növelt heteronukleáris csatolást. Amint a sztrichnin példáján láthatjuk (12. Ábra) ez nagyobb multiplicitású proton jelek korrelációinál meglehetõsen bonyolult keresztcsúcsokat eredményez, mely megnehezíti a heteronukleáris csatolási állandó meghatározását. Ennek kiküszöbölésére a szerzõk rögtön meg is találták a megoldást a J-MBC- 2 formájában (13. Ábra) Ábra: A J-MBC-2 pulzusprogram, a fehér és fekete téglalapok 90 és 180 fokos pulzusokat jelentenek, φ 1 : 0202, φ 2 : 0022, φ 3 : 0220, 1 = [2 ( 1 J C, )] -1, 2 = (n+1) t max 1, n: skálatfaktor, m = n+1, G x : 1 ms hosszú gradiens pulzus, G 1 : G 2 : G 3 = 50: 30:
31 Mivel a proton-proton csatolásokat csak úgy tudjuk az F1 dimenzióban lecsatolni, ha a azok kifejlõdését függetlenné tesszük t 1 -tõl, ezért egy újabb 180 fokos pulzus bevezetésével elérték azt, hogy a teljes pulzusszekvencia mindig ugyanolyan hosszú, függetlenül attól, hogy éppen hányadik sort vesszük fel a MBC-bõl. Amint a 13. Ábrán láthatjuk, az újonnan bekerült 180 fokos proton pulzus egy 2 -m t 1 idõ közepére került, ahol a 2 jelenti az imént említett szekvenciahosszt. Mivel ez egy konstans idõ minden egyes t 1 esetében, ezért a módszert konstans idejû J-MBCnek is szokás nevezni. Mivel t 1 kezdeti értéke nagyon kicsi (rendszerint 3 µs), ezért kezdetben a 2 -m t 1 gyakorlatilag 2 -vel egyenlõ. Majd a t 1 növelésével az n t 1 tag lesz a leghosszabb, míg a 2 -m t 1 lecsökken. Ideális esetben 2 -m t 1 nullára csökken, mivel ekkor lesz a lehetõ legkisebb 2, ami rendkívül fontos egyrészt az érzékenység, másrészt a T 2 relaxáció miatt is. Ennek teljesüléséhez az m = n+1 összefüggés szerint kell beállítanunk a mérést, azaz 2 = (n+1) t max 1, ahol t max 1 az utolsó mérési sorhoz tarozó inkrementum, melyet in0 td1 kifejezéssel adhatunk meg. 31
32 14. Ábra: A sztrichnin J-MBC-2 spektruma A sztrichnin J-MBC-2 módszerrel felvett spektrumát a 14. Ábrán szemléltetem. Jól látható, hogy a proton-proton csatolások lecsatolásával lényegesen egyszerûbb szerkezetû keresztcsúcsokat kapunk. A felskálázott csatolási állandót a keresztcsúcsnak F1 dimenziójú szeletébõl határozhatjuk meg úgy, hogy leolvassuk a dublett két csúcsának távolságát. Ezek után az n ismeretében a valódi csatolási állandó egy egyszerû osztással számolható. A módszer számos elõnnyel bír. Egyrészt a MBC alapszekvenciának köszönhetõen lehetõség van kvaterner szénen, és heteroatomon keresztüli mérésre, másrészt a széles tartományban változó kifejlõdési idõnek köszönhetõen nem kell egyetlen csatolási állandóra optimálnunk a mérést, valamint a csatolási állandó meghatározása rendkívül egyszerû, nem igényeli a spektrum semmiféle utófeldolgozását. Már sok szó esett az n faktorról, ami megadja, hogy hányszorosára növeljük a csatolási állandót a mérés során, azonban ennek nagyságát még nem diszkutáltuk. A J-scaling módszerek esetében vissza kell nyúlnunk egy rendkívül alapvetõ egyenlethez, mely Nyquist nevéhez fûzõdik és azt adja meg, hogy egy frekvencia megfelelõen pontos méréséhez mekkora mintavételezési idõre van szükség. Ezt alkalmazva azt tapasztaljuk, hogy az n t max 1 nak nagyobban kell lennie, mint 1/ n J. Azaz ha a 2 z-es csatolási állandókat is megfelelõ pontossággal akarjuk meghatározni, akkor n t max 1 -nak legalább 500 msec-nak kell lennie. Mivel t max 1 értéke egy rutin MBC mérésnél a msec tartományba esik, ezért n = értékeket adhatunk anélkül, hogy a pulzusszekvencia hossza a T 2 relaxáció tartományába essen. Ez az érték természetesen minden molekulára más és más, de kis és közepes nagyságú vegyületesetében a msec-os tartományt általánosan elfogadottnak tekinthetjük. A J-MBC alapú mérések (lásd a továbbfejlesztett módszereket is) esetében számos dologra kell ügyelnünk a beállítások tekintetében. Alapvetõ érdekünk, hogy az n paraméter, valamint az F1 dimenzió felbontása a lehetõ legnagyobb legyen, mivel ekkor tudunk kis csatolásokat is megfelelõ pontossággal mérni. Mindkét paraméter nagyban függ a t max 1 értékétõl, amit a korábbiakban megadott in0 td1 összefüggés ad meg, ahol in0 az az érték, amivel a t 1 -et inkrementáljuk sorról-sorra, td1 pedig nem más, mint az inkrementált sorok száma (F1-ben). Mivel in0 értéke a spektrális szélességtõl, valamint a módszertõl (nd0) függ, ezért itt csak td1-et tudjuk változtatni. Tehát a következõ egyenletek állnak rendelkezésünkre: 2 = (n+1) t max 1, t max 1 = 32
33 in0 td1, valamint tudjuk, hogy 2 = msec. Ezekbõl azt a következtetést vonhatjuk le, hogy hiába növeljük meg jelentõsen az alkalmazott sorok számát (td1), ezzel nem nyerünk sok mindent, hiszen ekkor kisebb n tényezõt kell alkalmaznunk, hogy elkerüljük 2 túlzott megnövekedését. Úgy is fogalmazhatnánk, hogy amit nyerünk a réven, elvesztjük a vámon. Ebbõl kifolyólag a módszer maga rendelkezik egy bizonyos korláttal, ami a csatolási állandók mérésének alsó határát jelenti, mely a 1-1,5 z-es tartományban realizálódik. Egy másik típusú hátrányt jelent a viszonylag nagyszámú 180 fokos pulzus, melybõl eredõen érzékenységveszteség léphet fel. Ezt egyrészt kompozit pulzusok alkalmazásával, másrész további, J-MBC alapú technikák kifejlesztésével küszöbölték ki. 4.6 Broadband J-MBC A J-MBC sikereire alapozva jelentette meg Meissner és Sørensen elején saját verziójukat, melynek a Broadband (szélessávú) J-MBC nevet adták. 13 A pulzusprogram, amellett, hogy eggyel kevesebb 180 fokos pulzust tartalmaz, mint a J-MBC-2, egy hatékony low-pass J-szûrõvel, valamint echo/anti-echo gradiens szelekcióval is rendelkezik. Ezáltal nagyobb érzékenységre tehetünk szert. 15. Ábra: A brodband J-MBC pulzusprogram, a fehér és fekete téglalapok 90 és 180 fokos pulzusokat jelentenek, φ 1 : 0202, φ 2 : 0022, φ 3 : 0220, 11, 12, 13 : az LPJF-ben használt idõk (lásd a szöveget), δ = effektív gradiens hossz, G x : 1 ms hosszú gradiens pulzus, G 1 : G 2 : G 3 : G 4 : G 5 : G 6 = 28: -16: -8: -4: 50/-30: -30/50, t A = ½ [ -Σ 1i +t max 1 -t 1-2δ], t B = = ½ [ +t max 1 -(1+n) t 1 ], t C = = ½ [n t1+σ 1i +2δ]. 33
34 Amint azt a 15. Ábrán láthatjuk a pulzusprogram egy harmadrendû low-pass szûrõvel rendelkezik, mely az egykötésen keresztüli csatolásokat hivatott hatékonyan kiszûrni, ugyanis ezek ugyanúgy felskálázódnak a mérés folyamán, ezzel zsúfoltabbá téve a spektrumot. Ez a szûrõ egy teljesen különálló részként kezelendõ, hiszen az egykötésen keresztüli csatolások kiszûrésén kívül semmilyen más hatással nem rendelkezik, melyet jól mutat az is, hogy az alkalmazott gradiensek összege zérus. Azt már itt meg szeretném jegyezni, hogy általános esetben nem szükséges a harmadrendû szûrõ alkalmazása, mivel egy másodrendû szûrõ is megfelelõen hatékony. Magasabbrendû szûrõk alkalmazása csak extrém esetekben ajánlott, hiszen ez is növeli a pulzusszekvencia hosszát. Egy n-ed rendû szûrõ esetében 1 darab proton és n darab 90 fokos szénpulzus alkalmazandó, melyek között így n darab várakozási idõt kell optimálnunk. Ezek hossza a kívánt szûrési tartománytól (J max - J min ) függ, pl. elsõrendû szûrõ esetén: τ 1 = (J max -J min ) - 1, másodrendû szûrõnél: τ 1 = ½ [J min +0,146 (J max -J min )] -1 ; τ 2 = ½ [J max -0,146 (J max -J min )] -1 ; míg harmadrendû szûrõnél: τ 1 = ½ [J min -0,07 (J max -J min )] -1 ; τ 2 = (J max +J min )] -1 ; τ 3 = ½ [J max -0,07 (J max - J min )] -1. Az elsõ szénpulzus elõtt, illetve az n darab szénpulzus után összesen tehát n+1 darab gradienst kell adni, melyek sorrendben úgy aránylanak egymáshoz, mint 2 n -1, 2 n-1, 2 n-2,, 1. A fent ismertetett szabályszerûségek ismeretében tetszõleges mérési módszerhez készíthetünk lowpass szûrõt, ezáltal megszabadítva spektrumunkat a nem kívánt korrelációk megjelenésétõl. 34
35 16. Ábra: A sztrichnin broadband J-MBC spektruma Magában a pulzusprogramban az eddigi három darab 180 fokos pulzus helyett csupán kettõ kapott helyet. Ezt az elõnyt annak rovására élvezhetjük, hogy a konstans pulzushosszért felelõs várakozási idõk (t A, t B és t C ) mindegyike más-más módon függ t 1 -tõl. atásuk teljesen megegyezik a J-MBC-2 résznél leírtakkal, így erre külön itt nem térek ki. Ami viszont külön említésre méltó, az a gradiens szelekció megváltozása, mivel itt egy antiszimmetrikus echo/antiecho szelekcióval találkozunk, amely 13 C és 1 esetében +5/-3 és 3/+5 arányú gradienseket jelent echo és anti-echo esetekben. Ennek gyakorlati megvalósítása külön problémát jelent, melyhez gradiens fájlokat használtam. Az EA módszer kb. kétszeresére növeli az érzékenységet, amint azt a 16. Ábrán látható spektrum jól példáz, ha összehasonlítjuk a J-MBC-2 módszerrel felvett spektrummal (14. Ábra). 35
36 4.7 J-IMPEAC-MBC Williamson és munkatársai szintén elején ismertették a J-MBC-2 szekvenciára alapuló módszerüket, a J-IMPEAC-MBC programot (17. Ábra). 14 Ez még kevesebb 180 fokos pulzust tartalmaz, mint az elõbbiekben bemutatott broadband J-MBC pulzusprogram. A J- IMPEAC-MBC a adden és munkatársainak 1999-ben publikált IMPEAC-MBC programján alapul, 15 azzal a különbséggel, hogy eltávolították a t 2 -t megelõzõ refókuszáló tagot, valamint a J-scaling technikának megfelelõen módosult a program közepe. 17. Ábra: A J-IMPEAC-MBC pulzusprogram, a fehér és fekete téglalapok 90 és 180 fokos pulzusokat jelentenek, φ 1 : 0202, φ 2 : 0022, φ 3 : 0220, 11, 12 : az LPJF-ben használt idõk (lásd a szöveget a broadband J-MBC résznél), δ = effektív gradiens hossz, G x : 1 ms hosszú gradiens pulzus, G 1 : G 2 : G 3 : G 4 : G 5 : G 6 : G 7 : G 8 = 28: -18.5: -9.5: 4: -4: 50: 30: 40.1 A módszer nagy elõnyét a csupán egyetlen 180 fokos pulzust használó konstans idejû rész jelenti, amelyet a szemléletesség kedvéért két részre oszthatunk. Az elsõ részben, melynek közepén a 180 fokos, heteroatomra adott pulzus található, a heteronukleáris csatolási állandók nem fejlõdnek, mivel a 180 fokos pulzus lecsatolja õket. Ennek a résznek a szerepe mindössze annyi, hogy a második rész (n t 1 ), ahol a heteronukleáris csatolási állandók fejlõdnek, soronkénti 36
37 növekedését kompenzálja. Ezáltal a másodrendû low-pass szûrõ és a szokásosnak mondható kémiai eltolódás kifejlõdéséért felelõs rész közötti idõ állandó, azaz az itt kifejlõdõ homonukleáris csatolások nincsenek hatással az F1 dimenzióban kialakuló jelformára. Viszont a kémiai eltolódás fejlõdése mellett t 1 idõtartományban a homonukleáris csatolások is fejlõdnek, míg a heteronukleáris csatolásokat lecsatolja a 180 fokos proton pulzus. Ennek eredményeképpen látszólag egy olyan spektrumot kapunk (18. Ábra), mint amilyet a J-MBC-2 (14. Ábra), vagy a broadband J-MBC (16. Ábra) módszerek is nyújtanak, azonban az F1 dimenzióban megjelenõ dublettek az adott homonukleáris csatolás- 18. Ábra: A sztrichnin J-IMPEAC-MBC spektruma -nak megfelelõen kiszélesednek. Ez elméletileg rontja a csatolási állandók meghatározásának pontosságát, azonban, ha figyelembe vesszük, hogy a felskálázott (akár z nagyságú) 37
38 csatolások mellett a vicinális homonukleáris csatolások 0-9 z-es értéke jószerivel elhanyagolható, úgy azt mondhatjuk, hogy a módszer hatékonyságát ez csupán kis mértékben csökkenti. 4.8 J-MQC 19. Ábra: A J-MQC pulzusprogram, a fehér és fekete téglalapok 90 és 180 fokos pulzusokat jelentenek, a szaggatottal jelölt 180 fokos pulzus elhagyható (lásd a szöveget), φ 1 : 0202, φ 2 : 0022, φ 3 : 0220, 1 = [2 ( 1 J C, )] -1,G x : 1 ms hosszú gradiens pulzus, G 1 : G 2 : G 3 = 50: 30: 40,1. Furihata és Seto a J-MBC szekvencia kifejlesztése után két évvel közölte a módszer teljesen analóg alkalmazását a MQC pulzusszekvenciára. 16 Ez felhasználását tekintve kicsit kilóg eme fejzetbõl, de mindenképpen ideillik, mint a J-skálázásos módszerek egyik képviselõje. Amint a 19. Ábrán láthatjuk a csatolások skálázásáért felelõs rész ezúttal a pulzusprogram végén kapott helyet. Mivel egyszerre két 180 fokos pulzust alkalmazunk a proton és az X csatornán, ezért a pulzusprogram ezen részében mind a homonukleáris, mind a heteronukleáris csatolások fejlõdhetnek. Összességében a következõket állapíthatjuk meg. A kémiai eltolódás csak t 1 idõ alatt, a heteronukleáris csatolások n t 1 idõ alatt, míg a homonukleáris csatolások n t 1 +t 1 = (n+1) t 1 idõ alatt fejlõdnek. Mivel a 1 idõ az egykötésen keresztüli csatolásokra van optimálva, 1 = (2 1J X, ) -1, ezért a heteronukleáris csatolások közül csupán az egykötésen keresztüli csatolások fognak megjelenni. a az ábrán szaggatott vonallal jelzett 180 fokos, heteroatomra adott pulzust eltávolítjuk, úgy F1 dimenzióban kvázi 38
39 20. Ábra: A sztrichnin J C -MQC spektruma 39
40 21. Ábra: A sztrichnin J -MQC spektruma lecsatoljuk a heteronukleáris csatolásokat. A szerzõk a két esetet sorrendben J C - és J -MBCnek nevez-ték el. A két módszer eredményét összehasonlíthatjuk a 20. és 21. Ábrák összevetésével, mely a sztrichninbõl készített J C - és J -MBC spektrumok azonos részletét tartlamazza. Amint látható, a J C -MQC esetében az egykötésen keresztüli csatolások felskálázása ( 1 J(C,) skálafaktor) miatt a keresztcsúcsok két, a felskálázott homonukleáris csatolásokat tartalmazó része jól elkülönül az F1 dimenzióban (több ezer z-el). Ez a jelek szeparálását segíti elõ abban az esetben, ha a J -MBC spektrum túl zsúfolt lenne. Ez utóbbiban, a fent leírtaknak megfelelõen, ugyanis F1 dimenzióban csak a felskálázott homonukleáris csatolásokat, míg F2 dimenzióban az 1 J(C,) csatolást találjuk. A módszerek gyakorlati felhasználása közül a legfontosabb, hogy olyan esetekben, amikor két csatoló proton kémiai eltolódás-különbsége a csatolással összemérhetõ, azaz egy rutin spektrumból (pl. proton, MQC) a csatolási kép magasabbrendû volta miatt nem tudjuk meghatározni a proton-proton csatolási állandót, akkor a J-MQC módszereket alkalmazva könnyedén hozzájuthatunk a kívánt csatolásokhoz. Mivel ekkor a csatolódó jelek a skálázás következtében eltávolodnak egymástól, ezzel hasonló eredményt adva, mint a szintén nemrégiben közölt 13 C szatellit módszer. 17 Magasabbrendû spektrumokkal számos esetben találkozunk, pl. kettõs kötések geometriai konfigurációjának meghatározásakor, vagy zsúfolt protonspektrumú, nagy móltömegû vegyületeknél. Ez utóbbiaknál különösen fontos a proton-proton csatolások biztos meghatározása, hiszen a számítógéppel történõ szerkezetfinomításhoz ezek elengedhetetlen paraméterek. 4.9 Összefoglalás A fejezet összefoglalásaként összegezném a mérési módszerekkel kapcsolatos észrevételeimet: a) felhasználás szempontjából: A gs-etlc, SQC-TCSY és SQC-ECADE mérések éppen a módszerek nagy elõnyt jelentõ TCSY típusú mágnesezettségi átvitel miatt szenvedik el a legnagyobb hátrányukat, legalábbis a felhasználásuk szemszögébõl. Ugyanis olyan esetekben, 40
41 amikor a csatolási állandó szempontjából kérdéses magok között heteroatom, vagy kvaterner szénatom található, a módszer nem alkalmazható. Ezzel szemben a GSQMBC, SQMBC, valamint a J-MBC módszerek esetében ez nem probléma, mivel ezekben az esetekben MBC jellegû spektrumokat kapunk. b) érzékenység szempontjából: Az itt bemutatott módszerek minden esetben gradiens szelekciót, valamint inverz detektálást alkalmaznak, így jelentõs különbséget nem tapasztalunk érzékenység szempontjából. A kisebb eltéréseket elsõsorban a hosszabb pulzusoknál, illetve az echo/anti-echo (röviden EA) gradiens szelekciót használó szekvenciák esetében találunk. Így a konstans idejû pulzushosszt megvalósító J-MBC módszerek mindenképpen gyengébb teljesítõképességûek, melyek esetében a broadband J-MBC EA szelekciója részben kompenzálja ezt a hátrányt. c) csatolások meghatározása szempontjából: Ezen a területen egyértelmûen azok a módszerek vezetnek, amelyek spektrumából a csatolási állandó egyszerûen, további szerkesztések nélkül megkaphatók. Így a ETLC, SQC-ECADE, J-MBC-2, broadband J-MBC, J- IMPEAC-MBC, J-MQC módszerek elõnyt élveznek. Ebbõl a szempontból a GSQMBC, SQMBC és a SQC-TCSY sem szenved nagy hátrányt, hiszen ezeknél a méréseknél csak akkor találkozunk bonyolultabb kiértékeléssel, ha a vizsgált proton multiplicitása nagyobb (triplett, kvartett, stb.). d) a mért csatolási állandó pontossága szempontjából: Ebbõl a szempontból elsõ helyen mindenképpen a ETLC és SQC-ECADE módszerek állnak, hiszen itt még abban az esetben is 0.1 z pontossággal tudunk mérni, amikor a csatolási állandó nagysága összemérhetõ a proton jel félérték-szélességével. asonló pontosságot érhetünk el a GSQMBC, a SQMBC és a SQC-TCSY módszerekkel is, azonban ebben az esetben a szükséges számítások, illetve jelszimulálás a csatolási állandó mérésének rovására mehet. Az eddig említett módszerekkel a minimális, pontosan meghatározható csatolási állandó kb. 0.5 z. A J-MBC módszerek esetében a pontosság valamivel gyengébb, 0.2 z körüli, valamint a mérés alsó határa is kb. 1 z-re módosul. Amint látható, az egyes mérések közül mindig azt kell kiválasztanunk, ami az adott célra leginkább megfelel, mivel számos korláttal találkozunk az egyes esetekben. Általánosságban azonban mindenképpen az érzékenyebb J-MBC módszerek (broadband J-MBC és J- 41
42 IMPEAC-MBC) azok, amiket akár a napi rutinméréseknél is alkalmazhatunk. Ezek a módszerek gyorsak, nagy hatékonyságúak és kiértékelésük is egyszerû, valamint megvan az a nagy elõnyük, hogy a csatolásban résztvevõ atomok közötti heteroatomok, illetve hidrogénnel nem rendelkezõ atomok nem akadályozzák meg a csatolási állandó mérését. Éppen ez az oka, hogy, az egyébként nagyon jó tulajdonságokkal rendelkezõ, ETLC-alapú módszerek felhasználása nem terjedt el jelentõsen Irodalomjegyzék [1] Karplus M. J. Am. Chem. Soc. 1963, 85: [2] Kurz M, Schmieder P, Kessler. Angew. Chem., Int. Ed. Engl. 1991, 30: [3] Uhrin D, Batta Gy, ruby VJ, Barlow PN, Kövér KE. J. Magn. Reson. 1998, 130: 155. [4] Marquez BL, Gerwick W, Williamson RT. Magn. Reson. Chem. 2001, 39: 499. [5] Kövér KE, ruby VJ, Uhrin D. J. Magn. Reson. 1997, 129:125. [6] Kay LE, Keifer T, Saaerinen T. J. Am. Chem. Soc. 1992, 114: [7] Kozminski W, Nanz D. J. Magn. Reson. 2000, 142: 294. [8] Palmer AG III, Cavanagh J, Wright PE, Rance M. J. Magn. Reson. 1991, 93: 151. [9] Marek R, Kralik L, Sklenaø V. Tetrahedron Lett. 1997, 38: 665. [10]Prestegard J, Kim Y. J. Magn. Reson. 1989, 84: 9. [11] Wu M, kino T, Nogel LM, Marquez BL, Williamson RT, Sitachitta N, Berman FW, Murray TF, McGough K, Jacobs R, Colsen K, Asano T, Yokokawa F, Shioiri T, Gerwick W. J. Am. Chem. Soc. 2000, 122: [12]Furihata K, Seto. Tetrahedron Lett. 1999, 40: [13]Meissner A. Sørensen W. Magn. Reson. Chem. 2001, 39: 49. [14] Williamson RT, Marquez BL, Gerwick W, Martin GE, Krishnamurthy VV. Magn. Reson. Chem. 2001, 39: 127. [15]adden CE, Martin GE, Krishnamurthy VV. J. Magn. Reson. 1999, 140: 274. [16]Furihata K, Seto. Tetrahedron Lett. 2001, 42: 859. [17]Williamson RT, Carney JR, Gerwick W. J. Nat. Prod. 2000, 63:
43 5. Szteroid-glikozidok szerkezetvizsgálata 5.1 Bevezetés A szteroidok tetraciklikus vázrendszerrel rendelkeznek, melyhez két anguláris metil-csoport kapcsolódik (18-as és 19-es helyzetben). A természetes vegyületek körében kiemelkedõ fontossággal bírnak. Biológiai szempontból vitaminhatás, hormonszerû viselkedés, gyulladást csökkentõ készség, anyagcserére gyakorolt hatás egyaránt megfigyelhetõ. Nemcsak biológiai szempontból érdekes ez a vegyületcsalád, hanem az ipar, elsõsorban a gyógyszeripar szempontjából is Me R 1 A B 11 8 C D dezoxi-β-D-allopiranozil- R Glu(1-4)6-dezoxi-allozil Glu(1-2)Glu Glu: β-d-glükopiranozil- 1. Ábra: Az 1 és 2 vegyületek szerkezete A természetes eredetû szteránvázas vegyületeket egyik csoportja a szívre ható szteroidglikozidok, melyek a gyógyászatban már régóta használt anyagok, mivel a szívizom összehúzódásának erõsségét fokozzák. Ilyen anyag a digitoxigenin és a strophantin is, melyek a leggyakrabban alkalmazott szívgyógyszerek közé tartoznak. A szteroidok ezen fajtájának közös jellemzõje, hogy valamilyen egyszerû, vagy összetett cukorral alkotott glikozidjaik formájában jelennek meg. Azok a növények, melyek az emberi szívre ható glikoszteroidokat termelik, régóta 43
44 ismert fajok: Digitalis prupuera, Digitalis lanata, Scilla maritima, Strophathus kome, Acokanthera spectabilis, Calotropis procera, stb. Megjegyezendõ, hogy a szívre ható glikozidokhoz hasonló szerkezetû bufotoxinok nem növényi eredetû hatóanyagok, hanem varangymérgek, a varangyok váladékának alkotórészei. Az általam vizsgált vegyületeket (1 és 2) a Calotropis Procera vegetatív részeibõl izolálták M. ani A. Elgamal és munkatársai (National Research Center, Kairó). A Calotropis Procera vadon nõ az egyiptomi sivatagban, de elõfordul Ázsiában és Afrika más részein is. Az arabok már az ókor óta használják galenikumként 1 a népi gyógyászatban, illetve nyílméregként 2. A növény tejébõl esse 3 és munkatársai több szívglikozidot, kalotropint, kalaktint, usaridint, usarin calotoxint és vorusarint izoláltak. Míg a növény magja frugozidot, koroglaucigenint és krotoxigenint tartalmazott. 4 Más szerzõk procerozidot, uzarigenint, sziriogenint, proceragenint, 4,5 valamint szterolokat és triterpéneket mutattak ki. 6 A szteroidok kémiai szerkezete sok esetben csak a gyûrûkapcsolatok cisz, vagy transz jellegében, továbbá egy-két funkciós csoport α, vagy β térhelyzetében tér el egymástól. A viszonylag csekély különbözõségük ellenére mégis drámai funkcionális eltérések jelentkezhetnek biológiai hatásmechanizmusukban. Éppen ezért, a biológiai tulajdonságok szerkezettõl való erõs függése miatt a megbízható, nagy pontosságú szerkezet-vizsgálat alapfeltétele a szteroid kutatásnak. Egy ilyen vizsgálat részleteit mutatom be ebben a fejezetben. 5.2 Extrakció és izoláció A Calotropis Procera vegetatív részeit a Sínai-félszigeti Elarich-ban gyûjtötték májusában, melyet Dr. M. El-Gibaly azonosított. A növény egy példánya bizonyítékként a kairói Központi Kutatóintézet herbáriumába került. Az extrakciót és izolációt egyiptomi kooperációs partnereink végezték a National Research Centre, Laboratory of Natural Products kairói intézetében. Ezen munka részletei a témakört ismertetõ publikációban (lásd melléklet) találhatóak. 44
45 5.3 Jelhozzárendelés Az NMR módszerekkel történõ szerkezet-felderítés alapját képezõ jelhozzárendelést az 1 vegyületen mutatom be részletesen. A vegyületbõl csak 2 mg állt rendelkezésemre, valamint a vizsgálat idõpontjában csoportunk még nem rendelkezett Shigemi mérõcsövekkel (lásd 3. Fejezet), ami a jelen vizsgálatokat tovább nehezítette. A szerkezet meghatározásához az olvadáspontok, valamint a tématerületen eddig szerzett tapasztalataim alapján 7 az 1. Ábrán látható aglikon alapszerkezetet feltételeztem, melyen csupán az egyes szubsztituensek minõsége és helye volt kérdéses. A 2 vegyület hozzárendelése analóg módon történt. A folyamat nyomon követéséhez az 1. és 2. Táblázat nyújt segítséget, melyben megadtam a 1 és 13 C kémiai eltolódásokat, valamint a karakterisztikus MBC és RESY korrelációkat. A jelhozzárendelést a SQC spektrum feldolgozásával kezdtem. A spektrumból a közvetlenül kapcsolódó 1 és 13 C atomokat lehet meghatározni. Így nem csak az egyes 13 C jelekhez tartozó 1 jeleket tudjuk meghatározni, hanem a protonok számából következtethetünk arra is, hogy az adott 13 C atom milyen csoporthoz (C, C, C 2, C 3 ) tartozik. A C, illetve C 3 csoportok megkülönböztetéséhez, mivel mindkettõ esetben a 13 C jelhez egy 1 jel tartozik, a 1 NMR spektrumot is vizsgálnunk kell, melyben a metil csoport protonjainak jelei a háromszoros intenzitás miatt jól megkülönböztethetõek. E csoportosítás után a jelhozzárendelés lényegesen egyszerûsödik, mivel pl. egy C a b metilén-csoport a atomjának jelhozzárendelésével az egész csoport jelhozzárendelését is elvégeztük. Eredményképpen megállapíthatjuk, hogy a spektrumban detektált 35 jel közül 3 metil-csoportot, 11 C 2 -csoportot, 16 C-csoportot és 5 kvaterner szénatomhoz tartozik. 13 C 45
46 1 13 C MBC ( 13 C partnerek) RESY 1 α α, 3α β α 2 α α, 1β, 2β β α 3 α C-1 1α, 2α, 4α, 1 4 α α, 5α, 4β, 1 β α, 19 5 α α, 6α 6 α α, 5α β β 7 α α, 7β β α, 6β, 7α, 8β 8 β β, 12β, 18, 19 9 α α,7α, 12α, α β, 9α β β, 18, α α, 17α β β, 17α, α α, 15β, 17α β α 16 α β, 17α β α, 21a, 21b 17 α α, 12β, 15α, 16α, 16β, 18, 21a, 21b, C-12, C-13, C-14, C-17 8β, 11β, 12β, 17α, 21a, 21b, C-1, C-5, C-9, C-10 4β, 6β, 8β, 11β a C-20 21b, 16β, 17α, 18 b 5.25 C-20 21a, 16β, 17α, C-21, C-23 16β, 17α, C-3 3α, 4α, 2, C-1 1, 3, , 4, C-6 2, 3, 6, , 6, C-5, C-4 4, 5, C-4 4, 5, 6, 2, 3, C-3, C C-4 1, C-3, C , 6 a 6 a , 6 b b a 1. Táblázat: Az 1 vegyület 1 és 13 C kémia eltoldásai, valamint karakterisztikus MBC és RESY korrelációi piridin-d 5 oldószerben 46
47 1 13 C MBC ( 13 C partnerek) RESY 1 α β, 3α β α, 11α, 19 2 α β, 3α, 4α β α, 19 3 α α, 2α 4 α α, 4β, 6α β α, 5α, 6β 5 α β 6 α α, 6β, 9α β β, 6α, 7β 7 α β, 9α, 15α, 15β β β, 7α, 8β 8 β β, 11β, 18, 19 9 α α, 7α, 11α α β, 9α, 11β β β, 11α, 18, α α β α, α α, 15β, 17α β α, 15α 16 α α β α, 21b, α α, 12β, 16α, 16β, 18, C-12, C-13, C-14, β, 11β, 12β, 17α, 21a, 21b, C-1, C-5 C-9, C-10 1β, 2β, 8β, 11β a C-22 18, 21b b 4.97 C-22 18, 21a C-21 17α, C-3 3, C-1, C-3, C C-2, C C-3, C a, 6 b 6 a , 6 b b , 6 a C-2 2, 3, C-3, C C-2, C-4, C C-3, C a, 6 b 6 a , 6 b b , 6 a 2. Táblázat: A 2 vegyület 1 és 13 C kémia eltoldásai, valamint karakterisztikus MBC és RESY korrelációi piridin-d 5 oldószerben 47
48 5.3.1 Az aglikon jelhozzárendelése Az egyes csoportok összekapcsolásához 1, 1 -CSY (2. Ábra, továbbiakban csak CSY), MBC (3. Ábra, lent), és RESY (3. Ábra, fent) spektrumokat használtam. Az egyes hidrogénés szénatomok konnektivitásának megbízható felderítéséhez biztos kiindulópontra van szükség. Jelen esetben az anguláris metil-csoportok ilyen biztos kiindulópontok. Mivel a három metilcsoport közül az 1.66 ppm eltolódású dublett szerkezetû, azaz a cukorrészre jellemzõ C-Me szerkezetet mutatja, így a kiindulópontok biztos hozzárendelése a 18 és 19 metil-csoportok azonosítására korlátozódik. A feltételezett szerkezetet vizsgálva az látható, hogy a 18-as helyzetû protonok két kvaterner 13 C atomot ( C-13, C-14 ) jelölhetnek ki, míg a 19-es helyzetûek csupán egyet ( C-10 ). Megvizsgálva a MBC spektrumot azt tapasztaljuk, hogy a nagyobb kémiai eltolódású metil-jel két kvaterner 13 C atommal ad kapcsolatot (δ C : 49.6, 84.1), a kisebb kémiai eltolódású pedig egyel (δ C : 35.7). Ezáltal bizonyítottá vált, hogy a nagyobb kémiai eltolódású jel a -18 atomokhoz tartozik a keresztcsúcsot adó jelek közül. A vizsgált MBC keresztcsúcsok alapján a 10, 13 és 14-es helyzetû kvaterner atomok jelhozzárendelése is megtörtént, mivel a C- 14 atom kémiai eltolódását a glikozidokra jellemzõ, a hozzá kapcsolódó elektronvonzó csoport jelentõsen megnöveli. A C-17 azonosítása is egyértelmû -18-ról, mivel csupán ez az egy szénatom tarozik C-csoporthoz. A továbbiakban -17 a CSY spektrumban kijelöli a 16-os helyzetû protonokat, melyekrõl szintén a CSY spektrumban eljutunk a 15-ös helyzetû protonokig. Innen tovább nem vezet korreláció, mely egyezésben van a D-gyûrû öttagú szerkezetével. Visszatérve a -18 MBC korrelációihoz, láthatjuk, hogy a megmaradt egy szénjel csakis a 12-es helyzethez tartozhat. A -12 protonok a CSY spektrumban megadják a -11 protonokat, ahonnan továbblépve megkapjuk -9-et. C-9-et -19 is kijelöli a MBC spektrumban. -9-rõl folytatva a CSY spektrum vizsgálatát eljutunk -8-ra, majd a 7-es helyzetû, továbbiakban pedig a 6-os helyzetû protonokhoz. Az 5-ös helyzet azonosítása -19-rõl MBC segítségével, vagy - 6-ról CSY-val történhet. Az itt megadott korrelációk összhangban vannak a feltételezett szerkezettel. 48
49 2. Ábra: Az 1 vegyület 1, 1 -CSY spektrumának két részlete: fent: cukor, lent: aglikon 49
50 3. Ábra: Az 1 vegyület RESY (fent) és MBC (lent) spektrumainak fontosabb részletei 50
51 Visszatérve -19 MBC korrelációihoz, láthatjuk, hogy a megmaradt egy szénatom csakis az 1-es helyzethez tartozhat, melyrõl a protonok a CSY spektrumban kijelölik a 2-es helyzetû protonokat. A 3-as helyzet hozzárendelése a CSY spektrum segítségével a 2-es helyzetrõl teljesen egyértelmû, hiszen -3 jele a 3-as helyzethez kapcsolódó oxigén atom miatt teljesen elkülönül az aglikon protonjeleitõl. Ennek megfelelõen a -3/ 2-4 keresztcsúcsok is jól láthatóak. Mivel a 4-es helyzetû protonok szintén kijelölik -5-öt a CSY spektrumban, ezért az A-gyûrû hattagú volta bizonyítottá válik. Ezzel az aglikon teljes jelhozzárendelése megtörtént, mely alapján látható, hogy a feltételezett négygyûrûs szerkezet helytálló. A 17-es helyzethez egy γ-lakton gyûrû, míg a 14-es helyzethez egy -csoport kapcsolódik, valamint az aglikont a cukorral összekötõ glikozidos kötés az aglikon 3-as helyzetén alakult ki, melyre a -3 és C-3 kémiai eltolódások is bizonyságul szolgálnak. A 17-es helyzethez kapcsolódó γ-lakton gyûrû jelhozzárendelését nagyban megkönnyítette a lakton gyûrû speciális szerkezete, melynek eredményeképpen a =C proton szingulettje és az oxigén atom melletti C 2 -csoport csak geminális csatolást tartalmazó dublettjei könnyen azonosíthatók a jelátfedések ellenére is. A C-20 és C-23 jelek megkülönböztetése már nem ennyire egyszerû, ugyanis sem a -21a és -21b, sem a -22 protonok nem adnak egyértelmû MBC korrelációt a két kvaterner szénatomra. A kettõ és három kötésen keresztüli korrelációk megkülönböztetése nem bizonyító erejû a szerkezet-felderítés szempontjából. Mivel a MBC mérés F1 dimenzióbeli digitális felbontása nem teszi lehetõvé a két nagyon közeli szénatom megkülönböztetését a -17/C-20 keresztcsúcs esetén, ezért szelektív INAPT kísérletet végeztem, melynél a -17 protont besugározva az egyértelmûen kijelöli a C-20-at A cukeregységek jelhozzárendelése A rendelkezésre álló alkotóelemekbõl 1 metil-csoport, 1 C 2 -csoport és 10 C-csoport maradt arra, hogy a cukrok szerkezetét felépítsük. A jobb áttekinthetõség kedvéért az aglikonhoz közvetlenül kapcsolódó cukoregységet A-val, míg a másikat B-vel jelöltem. A kiinduláshoz a 3-as helyzet és az 1A helyzet közötti -3/C-1A és -1A/C-3 MBC korrelációkat használtam fel, melyek egyértelmûen megadják az 1A helyzet proton és szén kémiai 51
52 eltolódásokat. A továbbiakban a CSY mérés segítségével megkaptam ennek a cukornak a teljes jelhozzárendelését, mely azt mutatta, hogy 1A-5A helyzetekben C-csoportok, míg 6A helyzetben metil-csoport található. A protonok között mért vicinális csatolási állandók a következõk: 3 J(-1A,-2A) = 8.0 z, 3 J(-2A,-3A) = 3.1 z, 3 J(-3A,-4A) = 2.7 z, 3 J(- 4A,-5A) = 9.4 z, 3 J(-5A,-6A) = 6.2 z. Ezek alapján kijelenthetjük, hogy az 1A, 2A, 4A és 5A helyzetekben axiális, míg 3A helyzetben ekvatoriális protonok találhatóak. Az aglikonhoz közvetlenül kapcsolódó cukoregység 6-dezoxi-β-D-allopiranozil csoport. A megmaradt 5 C és 1 C 2 egységeket szintén a kiemelkedõen nagy kémiai eltolódású anomer pozícióból kiindulva tudjuk összefûzni a CSY spektrum segítségével, melynek eredményéül azt kapjuk, hogy 1B-5B helyzetekben C-csoport, míg 6B helyzetben C 2 - csoport található. A 6-dezoxi-allózzal létrehozott glikozidos kötés helyét a -1B/C-4A MBC korreláció egyértelmûen megadja, azaz a második cukoregység a 6-dezoxi-allóz 4A helyzetéhez kapcsolódik. A cukor azonosításához szintén nagy segítségemre voltak a vicinális proton-proton csatolási állandók: 3 J(-1B,-2B) = 8.0 z, 3 J(-2B,-3B) = 8.5 z, 3 J(-3B,-4B) = 9.1 z, 3 J(-4B,-5B) = 9.1 z, 3 J(-5B, a -6B) = 2.4 z, 3 J(-5B, b -6B) = 5.2 z. Ezek alapján ebben a cukorban a C egységek protonjai axiális helyzetet foglalnak el, melybõl következik, hogy a cukor egy β-d-glükopiranozil egység. A meghatározott cukorszerkezeteket teljes mértékben alátámasztják a RESY spektrumban tapasztalt, a térközelséget jelzõ korrelációk. 5.4 Szerkezeti sajátságok vizsgálata Az aglikon gyûrûkapcsolódási jellegének meghatározása Az aglikont felépítõ egy öttagú és három hattagú gyûrû kapcsolódási jellegének meghatározásához a RESY spektrum által jelzett térközelségeket használtam fel (5. Ábrán látható kettõs nyilak). A hattagú gyûrûk esetében az energetikailag legstabilisabb szék-konformert vettem alapul. Az A/B-transz gyûrûkapcsolódást a -19 metil protonok és a -4β közötti térközelség jelzi. A B/C-transz gyûrûkapcsolatot a -19/ -8β és -18/-8β keresztcsúcsok jelzik. A C/D-cisz gyûrûkapcsolódás pedig egyértelmûen következik a -9/-15α térközelségbõl. Itt szeretném megjegyezni, hogy a B/C és C/D gyûrûkapcsolódások összhangban vannak a 52
53 természetben elõforduló szívglikozidok gyûrûkapcsolódási jellegével. Az ilyen típusú vegyületeket az A/B gyûrûkapcsolódást egyértelmûen jelzõ -5 pozíciójának megadásával szokás jellemezni, így e két vegyület az 5α-kardenolidok csoportjába tartozik. C 3 C 3 R 5. Ábra: A RESY spektrum alapján meghatározott fontosabb térközelségek, melyeket a nyilak jelölnek Szubsztituensek pozíciója A RESY keresztcsúcsok, valamint a vicinális proton-proton csatolások alapján határoztam meg az aglikonhoz kapcsolódó szubsztituensek térhelyzetét. A 3-as helyzethez kapcsolódó cukoregység térállásának megállapításához a -3 jel multiplicitását vizsgáltam. A -3 proton két 12 z és két kb. 3 z nagyságú vicinális csatolási állandóiból egyértelmûen következik a proton axiális térállása. A C(3)-as helyzetû szubsztituens β térállása igazolást nyert. A fentieket támasztják alá a -3/-1α, -3/-2α és -3/-4α RESY korrelációk is. A 14-es helyzethez kapcsolódó -csoport esetében részletes vizsgálat nem szükséges, hiszen a C/D-cisz gyûrûkapcsolat egyértelmûen meghatározza a csoport β pozícióját. A 17-es helyzethez kapcsolódó γ-lakton gyûrû pozíciója a -17 és -15α protonok között mért térközelség alapján β-nak bizonyult. A C-17 C-20 kötés körül a lakton gyûrû szabadon elfordulhat, melyet a - 18/-21a, -18/-21b és -18/-22 RESY keresztcsúcsok igazolnak. A kapott eredményeket szintén az 5. Ábra mutatja be. 53
54 5.4.3 A glikozidos kötések mentén kialakuló konformációs viszonyok vizsgálata Glikozidos kötés mentén kialakuló konformációs viszonyok vizsgálatánál figyelembe kell venni bizonyos effektusokat, melyek alapvetõen befolyásolják az egyes konformerek kialakulási valószínûségét. Ilyen effektus az anomer effektus és az exo-anomer effektus. Az anomer effektus, mely X-C 1 -Y-R fragmenseknél lép fel, ahol X és Y heteroatomok közül legalább az egyik, N vagy F atom, és ahol az R vagy, vagy C atom, azt eredményezi, hogy az X és R atomok szünklinális helyzetûek, vagyis a C 1 -Y tengely körüli rotációs szög +30º és +90º, vagy -30º és - 90º között van. Az exo-anomer effektus 8 alapján azok a konformációs helyzetek kerülnek elõtérbe, melyeknél a glikozidos atom nemkötõ elektronpályái a szacharidban lévõ C- kötés lazító pályáival kölcsönhatásba tud lépni, mellyel stabilizáló hatást ér el. A glikozidos kötéseken keresztül mért heteronukleáris csatolási állandók (pl. 3 J(C-1,-3)) 3 z körüli értéke, ami a Karplus-típusú összefüggés alapján közel 60 fokos diéderes szögnek felel meg, azt mutatja, hogy a kialakult domináns konformer összhangban van a fent említett effektusok által meghatározott szerkezettel. 5.5 Összefoglalás Összefoglalásként elmondhatom, hogy a két vizsgált természetes vegyület az 5αkardenolidok családjába tartozik, az alapváz mindkét esetben az uzarigenin (3β, 14β-dihidroxi- 5α-kard-20(22)-enolid), melyhez 6-dezoxi-β-D-allopiranozil-[1,4]-β-D-glükopiranóz (1) és β-dglükopiranozil-[1,2]-β-d-glükopiranóz (2) egységek kapcsolódnak. Ezek közül 1 egy teljesen új természetes vegyületnek bizonyult. A tématerülettel kapcsolatban megjelent közlemények, elõadások (E) és poszterelõadások (P): Atef G. anna, M. ani A. Elgamal, Nagy A. M. Morsy, elmut Duddeck, József Kovács, Gábor Tóth, Magn. Reson. Chem. 1999, 37: 754. József Kovács, András Simon, Tamás Gáti, elmut Duddeck, Gábor Tóth, NMR Investigation of 5α- and 5β-cardenolides isolated from Calotropis procera and Acokanthera spectabilis, Central European Discussion Groups, 14 th NMR, Valtice, Csehország, (E) 54
55 József Kovács, Tamás Gáti, András Simon, elmut Duddeck, Gábor Tóth, Complete 1 and 13 C signal assignment and structure elucidation of 5α- and 5β-cardenolides isolated from Acokanthera spectabilis and Calotropis procera, Central European NMR Symposium and Bruker NMR Users Meeting, Szeged (P) 5.6 Irodalomegyzék [1] a) Dymock W. A. Pharmacographia India 1883, 3: 270, Zain Packaging Industries, Karachi; b) El-Antaki D. Takaret li Alabab. 1923, 217, Azharia Press, Cairo [2] Chopra RN, Badhwar RL, Ghosh S. Poisonous Plants f India 1949, 674, Gout f Indian Press, Calcutta. [3] a) esse G, Reicheneder F. Ann. Chem. 1936, 526: 252; b) esse G, euser LJ, ütz E and Reicheneder F, Ann. Chem., 1950, 566: 130; c) esse G, Lettenbauer G. Angew. Chem. 1957, 69: 392. [4] Brüschweiler F, Stöcklin W, Atöckel A, Reichstein T. elv. Chem. Acta. 1969, 52: [5] Brüschweiler F, Stöcklin W, Reichstein T. elv. Chem. Acta. 1969, 52: [6] a) Akhtar N, Malik A, Ali SN, Kazmi SU. Phytochemistry 1992, 31: 2821; bkhan AQ, Ahmed Z, Kazmi SN, Malik A. J. Nat. Prod. 1988, 51: 925; c) Khan AQ, Malik A. Fitoterapia 1990, 61: 891; d) Pant R, Chaturvedi K. Curr. Sci. 1989, 58: 1093; e) Khan AQ, Malik A. Phytochemistry 1989, ; f) Bhutani KK, Gupta DK, Kapil RS. Tetrahedron Lett.1992, 33: [7] anna AG, Elgamal MA, assan AZ, Duddeck, Simon A, Kovács J, Tóth G. Magn. Reson. Chem. 1998, 36: 936. [8] a) Lemieux RU, Koto S, Voisin D. Anomeric Effect rigin and Consequences 1979, 87: 17, in Szarek WA, orton D. (Eds.), ACS Symposium Series, American Chemical Society, Washington D. C.; b) Kirby AJ. The Anomeric Effect and Related Stereoelectronic Effects at xygen 1983, Springer, eidelberg 6. Z-3-arilidén-1-tioflavan-4-on származékok epoxidációja 6.1 Irodalmi áttekintés 55
56 A 3-arilidén-flavanonok (flavindogenidek) jól ismert szerves vegyületek. E-izomereik, melyben a karbonil- és az aril-csoport a kettõs kötés ellentétes oldalán helyezkedik el, flavanonok és aromás aldehidek sav- és báziskatalizált kondenzációjával is elõállíthatók. 1 Fotoizomerizáció segítségével megkaphatjuk a vegyületek Z-izomerét is, melyben az említett két csoport egy oldalon található. 1a-c,2 Ezek az exociklikus α,β-telítetlen ketonok számos kémiai transzformáció kiindulási vegyületének bizonyultak, melyek tri- és tetraciklusos gyûrûrendszereket szolgáltatnak. 3 Epoxidálásuk különösen érdekes preparatív szempontból, melyet számos oxidálószerrel valósítottak meg. Ilyen oxidálószerek az alkáli hidrogén-peroxid (Weis-Scheffer reakció), 4 a nátrium-hipoklorid, 5 vagy a m-klór-perbenzoesav. Közös jellemzõjük, hogy eredményül epoxidok diasztereomer keverékét kapjuk. Dimetil-dioxiránt (DMD) használva E-3- arilidén-flavanonok epoxidálása során (1. Ábra) diasztereoszelektív reakcióban kizárólag transz,transz epoxid izomereket szolgáltat a reakció. 2,6 Ph Ar Ph Ar C 2 Cl 2 E-3-arilidén-flavanon 1. Ábra: E-3-arilidén-flavanonok sztereoszelektív epoxidálása trans,trans ~ 100% A 3-arilidén-flavanonok 1-tio-analógjai, azaz a 3-arilidén-1-tioflavanonok szintén ismert vegyületek. Elõállításuk hasonló lépésekkel történik, mint flavanon társaiké. 7,8 Z-izomerjeik, melyben a karbonil- és az aril-csoport a kettõs kötés ellentétes oldalán helyezkednek el, fotoizomerizációval a megfelelõ E-izomerekké alakíthatóak. xidációjuk azonban koránt sem olyan egyszerû, mivel maga a kén atom is oxidációs centrumot jelent. Elektrofil reagensekkel (mklór-perbenzoesav, DMD) végezve az oxidációs reakciót epoxidok helyett 3-arilidén-1- tioflavanon-1-oxidokat és -1,1-dioxidokat (szulfonokat) kapunk (2. Ábra), melyek még 56
57 feleslegben adott reagensekkel sem szolgáltatnak epoxidokat. 7,9 Ezek alapján megállapíthatjuk, hogy elektrofil reagensek nem képesek az erõsen elektronhiányos kettõs kötést oxidálni. S Ph Ar S Ph Ar C 2 Cl 2 szulfoxidok S Ph Z-3-arilidén-1-tioflavanonok Ar szulfonok 2. Ábra: Z-3-arilidén-1-tioflavanonok reakciója dimetil-dioxiránnal 6.2 Bevezetés Az irodalmi adatok ismeretében Lévai és munkatársai nukleofil oxidálószereket (NaCl és alkáli 2 2 ) alkalmaztak Z-3-arilidén-tioflavanonok (1) epoxidációjához. Az epoxidálási reakció során elméletileg négy izomer keletkezhet: transz,cisz; transz,transz; cisz,cisz és cisz,transz (3. Ábra). Az izomereket leíró elsõ elõtag a karbonil-csoport és az aril-csoport relatív pozícióját adja meg az epoxid gyûrûn, míg a második elõtag a 2-es helyzetû fenil-csoport és az epoxid gyûrû oxigénjének relatív helyzetét írja le. A jelen esetben a reakció két diasztereomer epoxid 2 és 3 3:2 arányú keverékét szolgáltatta, melyeket a továbbiakban folyadékkromatográfiás módszerrel választottak el. Mindkét vegyület racemát. 57
58 8 5 S 1 8a 4a Ph 3' 1 + R 4 + S Ph R S Ph R i. NaCl ii. 2 2 /Na 2 transz,cisz 3 transz,transz S Ph S Ph a b c d e f R 4 + -Me 4 + -Me 4 + -F 2 + -Me 2 + -Cl R R cisz,cisz cisz,transz 3. Ábra: Z-3-arilidén-1-tioflavan-4-onok epoxidációjának lehetséges termékei Munkám során NMR spektroszkópia segítségével a két keletkezett epoxidot azonosítottam, valamint szerkezeti és konformációs viszonyait vizsgáltam, melynek menetét ebben a fejezetben ismertetem. A kapott eredményeket kvantumkémiai számítások is alátámasztották. 6.3 Jelhozzárendelés A teljes 1 és 13 C NMR jelhozzárendelést gs- 1, 1 -CSY, gs-sqc és gs-mbc mérések segítségével végeztem el. A kapott eredményeket az 1. és 2. Táblázatok tartalmazzák. A proton spektrum jellegzetességeit a 4.a. Ábrán látható CSY spektrum projekcióján mutatom be a 2d vegyület esetében. Jól látható, hogy a peri-helyzetû karbonil-csoport anizotrop-effektusa jelentõs downfield eltolódást okoz a dublett szerkezetû -5-ön, valamint a -2 és -3 szingulettjei is nagyon jól elkülönülnek az aromás tartományban megtalálható többi jeltõl, vagy az esetenkénti metil- és metoxi-csoport hármas intenzitású jelétõl. A CSY spektrumon egyúttal nyomon követhetjük az egyes spinrendszerek meghatározását. A 2-es és 3 helyzetekhez kapcsolódó aromás gyûrûk egyértelmû megkülönböztetését -2 és -3 atomoknõ MBC keresztcsúcsok 58
59 szolgáltatják. Ehhez azonban meg kell különböztetnünk ezt a két azonos intenzitású és multiplicitású jelet. Mint ismeretes, egy epoxid gyûrûben lévõ C-csoport esetében az egykötésen keresztüli csatolási állandójának értéke rendkívül magas, 180 z körüli érték. 13 C- csatolt SQC spektrumot felvéve egyértelmûen megállapíthatjuk, hogy az 5.3/64 és 4.4/65 ppmnél lévõ keresztcsúcsok 180 z körüli egykötésen keresztüli csatolást tartalmaznak a 2 és 3 vegyületek esetében, melyek egyértelmûen bizonyítják, hogy a magasabb kémiai eltolódású szingulett jel tartozik a -3 atomhoz mindkét izomer esetében (4.b. Ábra). 2a 2b 2c 2d 2e 2f 3a 3b 3c 3d 3e 3f ' Me ",6" ",5" " Táblázat: A 2 és 3 vegyületek 1 kémiai eltolódásai kloroform-d oldószerben 59
60 2a 2b 2c 2d 2e 2f 3a 3b 3c 3d 3e 3f ' a , a Me " ",6" ",5" " ,1 128, Táblázat: A 2 és 3 vegyületek 13 C kémiai eltolódásai kloroform-d oldószerben 60
61 4.a Ábra: A 2d vegyület CSY spektrumának részlete 4.b Ábra: 13 C-csatolt SQC spektrumrészlet 61
62 6.4 Szerkezeti sajátságok vizsgálata NESY mérések A protonok közötti térközelségek meghatározásához szelektív 1D-NESY és kétdimenziós fázisérzékeny NESY méréseket végeztem. Ezek alapján megállapítottam, hogy a -2 atom és a C-3 -hoz kapcsolódó aromás gyûrû orto protonjai térközelségben vannak, míg -3 és -2, valamint -3 és -2,6 atomok között nem tapasztaltam térközelséget. Ezek a megfigyelések arra engednek következtetni, hogy a két keletkezett izomer trans,cisz (2) és transz,transz (3) szerkezetûek. Így a cisz,cisz és cisz,transz izomerek jelenléte kizárható. Ez a megállapítás összhangban van azzal a megfigyeléssel, miszerint analóg flavanonok epoxidációja során a Z geometriájú kettõs kötésbõl transz, míg az E-bõl cisz epoxid izomerek keletkeznek. 10, Konformációs vizsgálatok A 2 és 3 spiroepoxidok sztereokémiájának és konformációs viselkedésének felderítését nagyban megnehezíti, hogy a kénatomot tartalmazó gyûrû flexibilis, így a következõ konformációs egyensúlyt kell vizsgálnunk: kád-a boríték-a boríték-b kád-b, melyet az 5. Ábra mutat be a transz,transz izomerek esetében. A heterogyûrû inverziója a 2-es helyzetû fenil-csoport kvázi axiális (A konformerek) és kvázi ekvatoriális (B konformerek) átalakulásával jár. 62
63 Ar S Ph Ar Ph S kád-a kád-b Ar Ph S Ar S Ph boríték-a 3 J (C-8a,-2) =7-8z boríték-b δ -3 = 5.30; δ -5 = Ábra: A 3 vegyületek konformációs egyensúlya Tóth és munkatársai korábban megállapították, hogy a -2 és C-8a atomok között mért csatolási állandó értéke jellemzõ a 2-fenil-csoport térbeli pozíciójára. Egy közel 8 z-es érték kb. 180º-os, míg az 1 z körüli érték egy 80º-hoz közeli φ((2)-c(2)-s-c(8a)) diéderes szöggel függ össze. 2,12,13,14 A fent említett csatolási állandó meghatározásához különbözõ mérési módszereket használtam fel: gradiens szelekciót alkalmazó proton detektált távolható 13 C, 1 korrelációs mérést, 15,16 2D INAPT-ot, 17 valamint GSQMBC-t. 18 A 2c vegyület esetén jól látható, hogy mindhárom mérési módszer ugyanazt a csatolási állandót szolgáltatta: 3 J(-2,C-8a)=7.6 z (6. Ábra a-c). A különbözõ mérési módszerekkel dolgozva alkalmam nyílt az egyes módszerek 63
64 6. Ábra: A 3 J(C-8a,-2) mérése A) GSQMBC; B) 1D-gs-C/ távolható korreláció; C) 2D-INAPT módszerek segítségével 64
65 a felhasználó szempontjából történõ összehasonlítására. A GSQMBC módszert (lásd 4.4 Fejezet) találtam a leghatékonyabbnak, hiszen egyetlen mérésbõl az összes csatolási állandót megkaphatjuk viszonylag rövid idõn belül. A mérés pontosságának a határát az F2 dimenzió felbontása jelenti. Mivel kétdimenziós mérések esetében ez 2k-8k adatpontot jelent, ezért e tekintetben az egydimenziós 13 C, 1 korrelációs mérés elõnyt élvez, hiszen ott 32k-64k adatpontot is használhatunk még rutin körülmények között is. Ez utóbbi módszer hátránya abban jelentkezik, hogy csak a szelektíven besugárzott szénatomhoz tartozó heteronukleáris távolható csatolásokat kapjuk meg. A GSQMBC egyetlen hátránya nagy multiplicitással rendelkezõ protonok esetében nyilvánul meg, mivel ekkor a csatolási állandó leolvasása nem lehetséges közvetlenül, hanem számítógépes analízisre van szükség. A 2D INAPT nem szenved ettõl a problémától, hiszen a jelforma mindig dublett. A mérés pontossága itt az F1 dimenzió pontsûrûségétõl függ. A 13 C detektálás miatt érzékenysége meglehetõsen szerény. Mindezeket figyelembe véve a GSQMBC bizonyult a legmegfelelõbb módszernek, hiszen a csatolási állandót egy szingulett protonról kellett meghatározni, így a csatolási állandó leolvasása lehetséges volt közvetlenül a spektrumból. 2b 2c 2e 2f 3b 3c 3e 3f 3 J(C-8a,-2) J(C-2,6,-2) J(C-2 +,6 +,-3 ) , , , , Táblázat: Karakterisztikus 3 J(C,) értékek néhány 2 és 3 vegyület esetén A mért értékeket összefoglaló 3. Táblázat mutatja, hogy a 3 J(-2,C-8a) csatolási állandó a z-es tartományba esik, mely a 2-fenil-csoport kvázi axiális helyzetét támasztja alá, azaz a kitüntetett konformer a 2 és 3 vegyületek esetén boríték-a. A konformációs viszonyokat feltûntetõ 5. Ábrán látható, hogy, ha a mérési és a Karplus-összefüggés hibahatárait is figyelembe vesszük, akkor a kád-b konformer is szóba kerülhet. Ezt azonban a -5 jel vizsgálatával egyértelmûen kizártam. Ahogy azt már a jelhozzárendelés résznél is említettem, a karbonil-csoport anizotrop-effektusa a -5 atom kémiai eltolódását jelentõsen megnöveli, mely így a ppm-es tartományba kerül. a figyelembe vesszük, hogy a flavanonokat és a tioflavanonokat összehasonlítva 0.2 ppm-es eltolódás-növekedést tapasztalunk -5-ön a tioflavanonokban, 8 valamint, hogy a 2 és 3 vegyületekkel analóg flavanon spiroepoxidokban δ-5 = , akkor joggal állíthatjuk, 65
66 hogy a karbonil-csoport és a kondenzált aromás gyûrû közel koplanáris helyzetû. Mindez ellentétben van a kád-b szerkezettel és további bizonyságul szolgál a boríték-a konformer dominanciájára. A kvantumkémiai számítások szintén a boríték-a konformert adták meg, mint a legkisebb energiával rendelkezõ konformert mindkét esetben. A számított φ((2)-c(2)-s-c(8a)) diéderes szög közel 180º volt (153.9º º ). A kád-a és boríték-b konformerek esetében ez a szög 60º -80º tartományban helyezkedik el. A kád-b jelenlétét ebben az esetben csak a konformerek energiájának összehasonlítása zárja ki, mivel a második legstabilabb konformer a boríték-b. A karbonil-csoport és a kondenzált aromás gyûrû közel koplanáris elhelyezkesédére is további bizonyítékul szolgáltak a számított szerkezetek, hiszen boríték-a konformer esetében a φ(=c(4)-c(4a)-c(5)) diéderes szög 2.3º -8.5º tartományba esik, míg kád konformerek esetében ez a szög közel 25º. A 7. Ábrán a két izomerre számított legkedvezõbb konformer látható. 7. Ábra: A 2a és 3a vegyületek kitûntetett konformerei Transz,cisz és transz,transz izomerek megkülönböztetése A 2-fenil-csoport és az epoxid gyûrû oxigénjének relatív helyzetét a -3 kémiai eltolódás segítségével határoztam meg, ezzel a két izomer karakterisztikus és rendkívül gyors megkülönböztetését lehetõvé téve. A transz,transz izomerben a C-3 kvázi ekvatoriális helyzetet foglal el a heterogyûrûben, így a -3 a karbonil-csoporthoz viszonylag közel 66
67 helyezkedik el és közelítõleg koplanáris vele, mely δ = ppm kémiai eltolódást okoz. Transz,cisz izomer esetén azonban a -3 a karbonil-csoport síkja alatt foglal helyet, a diéderes szög kb. 35º, melynek hatására karbonil-csoport anizotrop-effektusa gyengébben érvényesül, mint az elõzõ esetben. Ez δ = ppm kémiai eltolódást okoz. Mivel a két tartomány között jelentõs eltérés van, ezért egyetlen proton spektrum elegendõ az ilyen típusú izomerek meghatározásához és megkülönböztetéséhez. A fent közölt megállapítás további alátámasztására a karbonil-csoport anizotróp effektusa került számításra a két izomer esetében. A még egy ilyen nagyságú molekula esetében is rendkívül idõigényes számolás helyett a karbonil-csoport helyére 2 C= molekula került. Amint a 8.a Ábrán láthatjuk a transz,cisz izomer esetében a -3 a -0.4 ppm-es hatású térrészbe (sárga) kerül, míg transz,transz esetben +0.4 ppm-es hatást (piros) tapasztalunk. Így a két izomerben fellépõ kb. 0.8 ppm-es eltérés jól értelmezhetõ A fenil- és aril-csoportok konformációs vizsgálata A 2-es helyzethez kapcsolódó fenil-csoport, valamint a 3 helyzetben lévõ aril-csoport konformációs (rotációs) tulajdonságait a 3 J(-2,C-2,6 ) és 3 J(-3,C-2 +,6 + ) csatolási állandók segítségével vizsgáltam meg. a egy C-csoport és a hozzá kapcsolódó aromás gyûrû koplanáris, úgy a C-csoport protonja és az orto helyzetû szénatomok között mért csatolási állandó értéke 5-6 z között található, mely érték arányosan csökken ennek a rotamer-populációnak a csökkenésével. 2,13,14 A 2 és 3 vegyületek esetében a fent említett csatolási állandók az z-es tartományba esnek (3. Táblázat), melyek azt mutatják, hogy a C(2)-C(1 ) és C(3)-C(1 + ) kötések körül nem található jelentõs energiaminimummal rendelkezõ rotamer, azaz az egyes rotamer-populációk között nem találunk olyanokat, amik lénygesen nagyobbak lennének. Természetesen a 3 -aril csoporton esetlegesen elhelyezkedõ orto-helyzetû szubsztituensek térkitöltöttségének megfelelõen tovább módosulnak az egyes rotamerek megjelenésének valószínûségei. Azonban csak a csatolási állandók vizsgálatával a közöltnél részletesebb információ nem nyerhetõ. 67
68 8.a Ábra: A karbonil-csoport számított anizotróp kúpja és hatása -3 -re 8.b Ábra: Az aril-gyûrûáramok okozta anizotróp effektus 3a esetén Az aromás gyûrûk kapcsán érdemes megemlíteni azt a tényt, hogy a transz,transz vegyületek esetében a 2-fenil-csoport orto protonjainak kémiai eltolódása jelentõsen 68
69 lecsökken (δ = ppm). Ez részben azzal magyarázható, hogy ezek a protonok a 3 - aril-gyûrû gyûrûárama okozta árnyékolási térbe esnek. A 8.b Ábra a számolt anizotróp kúpot mutatja be -0.3 ppm (sárga) és +0.3 ppm (piros) ICSS felületeken keresztül. Jól látható, hogy a fenil-csoport orto helyzetû protonjai a fenil-csoport forgása során csak a sárgával jelzett, negatív eltolódást okozó térrészbe eshetnek. 6.5 Összefoglalás Megállapítottam, hogy a Z-3-arilidén-1-tioflavanonok nukleofil oxidálószerekkel történt reakciója során transz,cisz és transz,transz izomerek keletkeznek, melyek megkülönböztetésésre egyértelmû NMR spektrális adatot találtam. Legstabilabb konformerként a boríték-a konformert azonosítottam, míg az aromás csoportok forgása nem korlátozott. Megállapításaimat kvantumkémiai számítások is igazolták. A tématerülettel kapcsolatban megjelent közlemények, elõadások (E) és poszterelõadások (P): Gábor Tóth, József Kovács, Albert Lévai, Erich Kleinpeter and Andreas Koch, Magn. Reson. Chem. 2001, 39: 251. Albert Lévai, Gábor Tóth, József Kovács, Tamás Patonay and Erzsébet B. Vass, Monat. Chem. 2001, 132: 707. József Kovács, Gábor Tóth, Albert Lévai, Barbara Balázs Stereochemistry of spiroepoxides obtained by oxidation of 3-arylidene-1-thioflavanone, Central European Discussion Groups, 15 th NMR, Valtice, Czech, (E) Kovács József, Tóth Gábor, B. Vass Erzsébet, Lévai Albert 3-Arilidén-1-tioflavanonok oxidációja során nyert spiroepoxidok sztereokémiája, MKE Vegyészkonferencia, Debrecen, (E) József. Kovács, Gábor Tóth, Albert Lévai, Erich Kleinpeter, Andreas Koch, Stereochemistry of Spiroepoxides obtained by xidation of Z-arylidene-1-thioflavan-4-ones and GIA- F/DFT Calculation of 13 C Chemical Shifts, 22 nd Discussion Meeting, Progress in the 69
70 Magnetic Resonance of Bioactive Compounds and New Materials, Regensburg, Germany, September 27-30, 2000 (P) Albert Lévai, Erzsébet B. Vass, Tamás Patonay, Gábor Tóth, József Kovács, Epoxidation of 3-arylidene-1-thioflavanones, 19 th International Symposium rganic Chemistry of Sulfur, Sheffield, United Kingdom, (P) Lévai Albert, Tóth Gábor, Kovács József, Patonay Tamás 3-Arilidén-1-tioflavanonok oxidációs átalakításai, MTA eterociklusos Kémiai Munkabizottság évi elõadóülése, Balatonszemes, (P) 6.6 Irodalomjegyzék [1] a) Keane DD, Marathe KG, Sullivan WI, Philbin EM, Simons RM, Teague PC. J. rg. Chem. 1970, 35: 2286; b) Lévai A, etey E. Pharmazie, 1978, 33: 378; c) Dhavale DD, Joshi P, Marathe KG. J. Chem. Soc. Perkin Trans 2, 1987, 449; d) Lévai A, Szabó Z. Pharmazie 1992, 47: 56. [2] Nemes C, Lévai A, Patonay T, Tóth G, Boros S, alász J, Adam W, Golsch D. J. rg. Chem. 1994, 59: 900. [3] Lévai A, Tóth G. Trends eterocycl Chem, 1995, 4: 89. [4] a) Doherty R, Keane DD, Marathe KG, Sullivan WI, Philbin EM, Simons RM, Teague PC. Tetrahedron Lett. 1968, 441; b) Keane DD, Sullivan WI, Philbin, EM, Simons RM, Teague PC. Tetrahedron 1970, 26: 2533 [5] Keane DD, Sullivan WI, Philbin EM, Simons RM, Teague PC. Tetrahedron 1971, 27: [6] Adam W, Bialas J, adjiarapoglou L. Chem. Ber. 1991, 124: [7] (a) Auwers K, Arndt F. Ber dtsch Chem. Ges. 1909, 42: 2706; (b) Arndt F, Fleming W, Scholz E, Löwensohn V. Ber dtsch Chem. Ges. 1923, 56: 1269; (c) Bierne JJ and Sullivan WI. Proc. Roy. Irish. Acad. 1977, 77B: 331. [8] Lévai A, Szöllõsy Á, Tóth G. Acta. Chim. ung. 1991, 128: 359. [9] Adam W, Golsch D, adjiarapoglou L, Lévai A, Nemes C, Patonay T. Tetrahedron 1994, 46: [10]Keane DD, Sullivan WI, Philbin EM. Tetrahedron 1970, 26: [11]Keane DD, Sullivan WI, Philbin EM. Tetrahedron 1971, 27:
71 [12]Adam W, alász J, Lévai A, Nemes Cs, Tóth G. Liebigs. Ann. Chem. 1994, 795. [13]Tóth G, Szöllõsy Á, Lévai A, szbach Gy, Dietrich W, Kühne. Magn. Reson. Chem. 1991, 29: 801. [14]Tóth G, Lévai A, Szöllõsy Á, Duddeck. Tetrahedron, 1993, 49: 863. [15]Stelten J, Leibfritz D. Magn. Reson.Chem. 1995, 33: 827. [16]kogun JI, Duddeck, abermehl G, Krebs C, Tóth G, Simon A. Magn. Reson. Chem. 1998, 36: 371. [17]Jippo T, Kamo, Nagayama K, J. Magn. Reson.1986, 66: 344. [18]Marek R, Kralik L, Sklenaø V. Tetrahedron Lett., 1997, 33:
72 7. Z-3-arilidén-1-tioflavan-4-on epoxidok oxidációja 7.1 Irodalmi áttekintés Mivel ennek a fejezetnek a témája szorosan kapcsolódik a 6. Fejezethez, annak folytatásának tekinthetõ, ezért az irodalmi áttekintés ismétlésétõl itt eltekintek. 7.2 Bevezetés A 6. Fejezetben már szó volt arilidén-flavanonok dimetil-dioxirános (DMD) reakciójáról, amely az oxidálószer karakterének megfelelõen nem az elektronszegény kettõs kötést oxidálta, hanem a reagens feleslegétõl függõen szulfoxid és szulfon termékeket adott. 1,2 Ennek alapján a 6. Fejezetben vizsgált E-arilidén-flavanon epoxidokat Lévai és munkatársai DMD-vel reagáltatták, melynek során a reagens feleslegétõl függõen szulfoxidokat és szulfonokat nyertek. Az oxidációs lépések teljesebb áttekinthetõsége miatt a 6. Fejezetben már ismertetett reakciólépéseket is tartalmazza az 1. Ábra. Munkám során a feltételezett termékek azonosítását és teljes szerkezetvizsgálatát végeztem el. Az NMR vizsgálatok alapján megállapított szerkezeti sajátságokat kvantumkémiai számítások igazolták. 7.3 Jelhozzárendelés A teljes 1 és 13 C jelhozzárendelést rutin kétdimenziós mérések alapján végeztem el: gs- SQC, gs-mbc, gs- 1, 1 -CSY. Mivel a vegyületek oxigén atomokat is tartalmaznak (4 és 5 esetében hármat, 6 és 7 esetében négyet), ezért a 17 NMR spektrumok is felvételre kerültek, ahol a detektált jelek hozzárendelése irodalmi adatok alapján történt. 3 A kapott eredményeket az 1-4. Táblázatok foglalják össze. A proton spektrum általános jellemzõ sajátsága a -5 rendkívül nagy eltolódású dublett jele, ami a peri-helyzetben lévõ karbonilcsoport hatása. A ppm tartományban két szingulettet találunk, melyek a -2 és -3 atomokhoz tartoznak. Megkülönböztetésükhöz azt vettem figyelembe, hogy az epoxidgyûrûben elhelyezkedõ C-csoportok esetén az egykötésen keresztüli heteronukleáris csatolás nagysága lényegesen nagyobb, kb. 180 z körüli. 72
73 trans,cis trans,trans S Ph i. NaCl ii. 2 2 /Na R R S 1 8a 4a Ph 3' S Ph R 1-7 a b c d e f R 4 + -Me 4 + -Me 4 + -F 2 + -Me 2 + -Cl S DMD Ph S DMD Ph R 4 5 R DMD DMD S Ph S Ph R 6 7 R 1. Ábra: Z-3-arilidén-tioflavanonok vizsgált oxidációs termékei A 13 C-csatolt SQC spekrum felhasználásával megállapítottam, hogy -3 kémiai eltolódása mindig nagyobb, mint a 2-es helyzetben lévõ protoné. Ezek alapján az is bizonyítottá vált, hogy az oxidáció során az epoxid-gyûrû megmaradt. 5 és 7 esetében a karbonil-csoport anizotróp effektusa következtében 0.2 ppm értékû lowfield eltolódást tapasztalunk a -3 atomon. A 2 és 3 helyzetekhez kapcsolódó aromás gyûrûk egyértelmû megkülönböztetését - 2 és -3 atomokról történõ MBC keresztcsúcsok szolgáltatják. Az egyes spinrendszereket és az azokon belüli kapcsolódási sorrendet a CSY mérések alapján állapítottam meg. A Sés S 2 -csoportok M-effektusa ppm paramágneses eltolódást indukál a -6 atomon, míg a C-6 atom egy kb. 7-8 ppm nagyságú kémiai eltolódás csökkenést szenved a megfelelõ 2 és 3 kiindulási vegyületekkel összehasonlítva. 73
74 4a 4b 4c 4d 4e 4f 5a 5b 5c 5d 5e 5f ' Me ",6" ",5" " Táblázat: A 4 és 5 szulfoxid izomerek 1 kémiai eltolódásai kloroform-d oldószerben 6a 6b 6c 6d 6e 6f 7a 7b 7c 7d 7e 7f ' Me ",6" ",5" " Táblázat: A 6 és 7 szulfon izomerek 1 kémiai eltolódásai kloroform-d oldószerben 74
75 4a 4b 4c 4d 4e 4f 5a 5b 5c 5d 5e 5f ' a a x x Me " ",6" 128.x ",5" " S= epoxi C= Táblázat: A 4 és 5 szulfoxid izomerek 13 C és 17 kémiai eltolódásai kloroform-d és toluol-d 6 oldószerekben 75
76 6a 6b 6c 6d 6e 6f 7a 7b 7c 7d 7e 7f ' a a Me " ",6" ",5" " S= ax S= eq epoxi C= Táblázat: A 6 és 7 szulfon izomerek 13 C és 17 kémiai eltolódásai kloroform-d és toluol-d 6 oldószerekben 76
77 7.4 Szerkezeti sajátságok vizsgálata Konformációs vizsgálatok A heterogyûrû mozgékonyságát figyelembe véve mind transz,cisz, mind transz,trans z izomerek esetében a F ab-initio számítások során megkapott két konformert vettem figyelembe, melyeket 6a és 7a vegyületek esetében a 2. Ábrán tûntettem fel a számított relatív energiákkal együtt. Mint látható mindkét izomer esetében a 2-fenil-csoportot axiális helyzetben tartalmazó csavart boríték-a konformerek a stabilisabbak. A csavart boríték-b (transz,cisz izomer) és boríték-b (transz,transz izomer) konformerek számított energiái 5.2, illetve 3.3 kcal/mol-lal nagyobbak, ami ezen konformerek (ekvatoriális 2-fenil-csoport) spektrális hatásának megfigyelését valószínûtlenné teszik. transz,cisz 6a Ph S Ar S Ph Ar csavart boríték-a E rel = 0.00 kcal/mol φ calc [-C(4)-C(4a)-C(8a)] = o transz,transz 7a Ph S Ar csavart boríték-a E rel = 3.03 kcal/mol φ calc [-C(4)-C(4a)-C(8a)] = o csavart boríték-b E rel = 5.20 kcal/mol φ calc [-C(4)-C(4a)-C(8a)] = o Ar S Ph boríték-b E rel = 6.34 kcal/mol φ calc [-C(4)-C(4a)-C(8a)] = o 2. Ábra: A 6 és 7 vegyületek számított konformációs egyensúlya 77
78 A heterogyûrû inverziója a 2-es helyzetû fenil-csoport kvázi axiális (A konformerek) és kvázi ekvatoriális (B konformerek) átalakulásával jár. Tóth és munkatársai korábban megállapították, hogy a -2 és C-8a atomok között mért csatolási állandó értéke indikatív a 2- fenil-csoport térbeli pozíciójára. Egy közel 8 z-es érték kb. 180º -os, míg az 1 z körüli érték egy 80º -hoz közeli φ((2)-c(2)-s-c(8a)) diéderes szöggel függ össze. 4-7 A heteronukleáris csatolási állandók meghatározásához különbözõ mérési módszereket használtam: GSQMBC, 8 proton detektált távolható 13 C, 1 korrelációs mérést, 9,10 valamint az általam legjobbnak talált (lásd a csatolási állandók mérésével foglalkozó 4. Fejezetet) broadband J-MBC-nek nevezett J-skálázott MBC verziót. 11 Példaként az 5b vegyületrõl készített J-MBC mérés eredményét mutatom be (3. Ábra). A mért 3 J(C-8a,-2) csatolási állandókat 4-7 vegyületek esetében az 5. Táblázat tartalmazza. 3. Ábra: Az 5b vegyület broadband J-MBC spektruma, skálafaktor = 20 78
79 a b c d e f Táblázat: 3 J(C-8a,-2) csatolási állandók nagyságai 4-7 esetén A mért értékek alapján megállapítottam, hogy a 4 és 5 szulfoxid vegyületek esetében ( z-es értékek) a 2-es helyzetû fenil-csoport axiális állású. Azonban a 6 és 7 szulfon vegyületek esetében a mért csatolási állandót és a diéderes szög - 3 J(C-8a,-2) összefüggést megadó Karplus-típusú függvényt figyelembe véve azt kaptam, hogy az A és B típusú konformerek aránya kb. 1:1. Ez a szerkezet-felderítés jelen állásánál ellentmondásban áll a számítások által kapott feltételezett szerkezetekkel 6 és 7 esetében. Az ellentét feloldására további spektrális bizonyítékokra volt szükség. A térközelségek mérésére alkalmas 2D NESY alapján megállapítottam, hogy a -2 és a -2 +,6 + protonok térközelben találhatók a transz,transz izomerekben (5 és 7), amely a csavart boríték-a konformer meglétét, azaz a fenil-csoport axiális állását bizonyította. A C-3 atom kémiai eltolódása szintén jól látható összefüggésben van a konformációs viszonyokkal. Transz,transz izomerek (5 és 7) esetében egy 5-6 ppm nagyságú γ-gauche-effektus lép fel mind A, mind B típusú konformer esetében, ekkor a mért kémiai eltolódás 61 ppm körüli. Transz,cisz vegyületeknél a mért érték 68 ppm körüli, ami azt jelenti, hogy itt nem lép fel γ- gauche-effektus. a megvizsgáljuk a két lehetséges konformációtípust (A és B), akkor azt tapasztaljuk, hogy csak az A típusú, azaz a fenil-csoportot axiális helyzetben tartalmazó, konformer esetében nem tapasztaljuk a kémiai eltolódást csökkentõ effektust. Amint a fentiek alapján láthatjuk 6 és 7 esetben a 3 J(C-8a,-2) csatolási állandó alapján megállapított konformációs viszonyok nem helytállóak, mivel a többi módszer alapján egyedül a csavart boríték-a a kedvezményezett konformer. Ennek az érdekes jelenségnek a részletesebb tanulmányozásához tioanizolt, valamint annak szulfoxiddá és szulfonná oxidált származékait vizsgáltam. A 4. Ábrán a metil-csoport, valamint az ipszo helyzetû szénatom közötti csatolási állandót mutatom be a kénatom különbözõ oxidációs fokának függvényében. 79
80 A mérések hitelességének bizonyítékaként az alsó sorban néhány, elkülönült keresztcsúcsot adó korreláció szerepel. 4. Ábra: A 3 J(C-1,Me) csatolási állandók tioanizol, valamint oxidációs származékainál (felsõ sor), a mérések jóságát bizonyítandó, az adott vegyületen belüli egyéb csatolási állandók (alsó sor) Amint látható, tionaizol esetében a mért 3 J(C-1,Me) csatolási állandó értéke 3.9 z, ami a három metil-proton csatolási állandójának átlaga. Az elsõ lépésben bevitt oxigén atom csupán kis mértékben csökkenti a csatolási értékeket. Azonban a második oxigén bevitele után a csatolási állandók átlaga 1 z-nél kisebb értékre csökken. Ezek alapján megállapítottam, hogy szulfon-csoporton keresztül mért csatolási állandók nem használhatók konformációs vizsgálatokra. Azaz 6 és 7 vegyületeknél a konformációs viszonyok vizsgálatánál el kell tekintenünk a 3 J(C-8a,-2) csatolási állandók felhasználásától. 80
81 Konfigurációs vizsgálatok A 4 és 5 vegyületekben a szulfoxid-csoport megjelenésével egy új sztereogén centrum is jelentkezik a kénatom személyében, így az S= csoportnak a 2-fenil-csoporthoz viszonyított relatív állását is fel kell deríteni. Mivel az 1 és 13 C spektrumok csupán egy-egy jelsorozatot tartalmaznak, ezért rögtön megállapíthatjuk, hogy a szulfoxidokhoz vezetõ reakció erõsen sztereoszelektív. Mivel nem állt rendelkezésemre olyan diasztreomer modellvegyület, amelyekben az S= csoportok oxigénje axiális, illetve ekvatoriális helyzetben található, valamint csak az NMR adatok alapján nem találtam egyértelmû bizonyítékot a S= csoport állására nézve, ezért ennek a problémának a megoldásánál a kvantumkémiailag számított adatokat is figyelembe kellett vennem. Mivel magának az S= csoportnak a konfigurációjára vagyunk kíváncsiak, ezért célszerûnek láttam az oxigén atom kémiai eltolódását vizsgálni. A 17 spektrum három jelen tartalmaz: a karbonil-csoport oxigénje 541 ppm körül bukkan fel, míg az epoxid-gyûrû és a szulfoxid-csoport oxigénje a ppm-es tartományban helyezkedik el. A 17 kémiai eltolódások GIA-módszerrel kerültek számításra 12 mindkét diasztereomer esetében. A 6. Táblázat ezeket az adatokat mutatja be. Mért értékek Számított értékek S= S 2 S= axiális S= ekvat. S 2 4a 5a 6a 7a 4a 5a 4a 5a 6a 7a S= epoxi C= Táblázat: Mért és számított 17 kémiai eltolódások 4a-7a vegyületek esetén. A mért és számított adatok összehasonlítása alapján az S= csoport axiális állása valószínûsíthetõ. A számított és mért értékek között ebben az esetben is van eltérés, azonban az egyes számított mennyiségek különbsége nagyon jól igazodik a mért értékek 81
82 különbségéhez. Amint láthatjuk a karbonil-csoport esetében nagyon jó egyezést is tapasztalhatunk. Az S=-csoport axiális állását bizonyította az S= csoportnak a -8 protonra ható anizotróp effektusának számítása is. Ugyanis az S= axiális elhelyezkedése esetén a számított effektus ppm nagyságú 4a és 5a esetében, míg ekvatoriális állás esetén az effektus csak szerény, ppm-es nagyságban lép fel. a összevetjük a 4a és 5a vegyületekben szereplõ -8 kémia eltolódásokat (7.56 és 7.49 ppm) a kiindulási 2a és 3a vegyületekével (7.22 és 7.29 ppm), akkor egyértelmûvé válik, hogy a -8 kémia eltolódásának megnövekedéséért az axiális helyzetbe belépõ oxigén a felelõs. Az összehasonlítást megtehetjük, hiszen majdnem teljesen azonosak a vegyületpárok konformációs viszonyai. asonló vizsgálatot folytattunk a -2 proton esetében is, azonban itt azt találtuk, hogy az S= állásától függetlenül a -2-n fellépõ anizotrop effektus kb ppm nagyságú. Ez közelítõleg meg is felel a mért értékeknek. A DMS modellvegyület segítségével számított anizotrop kúpot az 5. Ábrán mutatom be. 5. Ábra: Az S= csoport anizotrop kúpja 5a esetén (sárga: -0.1 ppm, piros: +0.1 ppm nagyságú effektus) 82
83 Mindezek alapján bizonyítottá vált, hogy 4a és 5a szulfoxidok létrejöttekor a kén atomhoz kapcsolódó oxigén atom az axiális helyzetet foglalja el. Ez teljes egyezésben van azzal, hogy a DMD-vel történõ oxidáláskor az átmeneti állapot nagy térigényû, így a belépõ oxigén atom a kevésbé zsúfolt oldalról, azaz a 2-fenil-csoporttal ellentétes irányból közelíti meg a kén atomot. Érdekes megemlíteni azt a tényt is, hogy a transz,cisz izomerek (4 és 6) esetében a - 2 /6 protonok kémiai eltolódása kb. 0.5 ppm-el nagyobb, mint a transz,transz (5 és 7) párjaiké. Ennek vizsgálatára az oxirán-gyûrû anizotrop effektusát számoltuk a két-két izomer kitüntetett konformerére. A 2-fenil-csoport forgása tiltott volt, így -2 és -6 esetében másmás eredményt kaptunk, melyek átlagát hasonlítottuk a mért értékekkel össze. Az eredményeket a 7. Táblázat, míg a számított anizotrop kúpot a 6. Ábra mutatja be. Vegyület Anizotrop effektus Vegyület Anizotrop effektus [ppm] [ppm] 4a (0.01) 6a (0.01) 5a (-0.03) 7a (-0.03) Ää (-0.04) Ää (-0.04) Ää mért Ää mért Táblázat: Az oxirán gyûrû anizotrop effektusa -2 (-6 ) protonokra 6. Ábra: Az oxirán-gyûrû anizotrop kúpja, valamint hatása -2 és -6 protonokra (sárga: -0.1 ppm, piros: +0.1 ppm nagyságú effektus) 83
1D multipulzus NMR kísérletek
 D multipulzus NMR kísérletek Rohonczy János ELTE, Szervetlen Kémia Tanszék Modern szerkezetkutatási módszerek elıadás 202. . Protonlecsatolt heteronukleáris mérések Elv 3 C mag detektálása alatt a protoncsatornán
D multipulzus NMR kísérletek Rohonczy János ELTE, Szervetlen Kémia Tanszék Modern szerkezetkutatási módszerek elıadás 202. . Protonlecsatolt heteronukleáris mérések Elv 3 C mag detektálása alatt a protoncsatornán
Spektroszkópiai módszerek 2.
 Spektroszkópiai módszerek 2. NMR spektroszkópia magspinek rendeződése külső mágneses tér hatására az eredő magspin nem nulla, ha a magot alkotó nukleonok közül legalább az egyik páratlan a szerves kémiában
Spektroszkópiai módszerek 2. NMR spektroszkópia magspinek rendeződése külső mágneses tér hatására az eredő magspin nem nulla, ha a magot alkotó nukleonok közül legalább az egyik páratlan a szerves kémiában
Műszeres analitika II. (TKBE0532)
 Műszeres analitika II. (TKBE0532) 7. előadás NMR spektroszkópia Dr. Andrási Melinda Debreceni Egyetem Természettudományi és Technológiai Kar Szervetlen és Analitikai Kémiai Tanszék NMR, Nuclear Magnetic
Műszeres analitika II. (TKBE0532) 7. előadás NMR spektroszkópia Dr. Andrási Melinda Debreceni Egyetem Természettudományi és Technológiai Kar Szervetlen és Analitikai Kémiai Tanszék NMR, Nuclear Magnetic
Mi mindenről tanúskodik a Me-OH néhány NMR spektruma
 Mi mindenről tanúskodik a Me-OH néhány NMR spektruma lcélok és fogalmak: l- az NMR-rezonancia frekvencia (jel), a kémiai környezete, a kémiai eltolódás, l- az 1 H-NMR spektrum, l- az -OH és a -CH 3 csoportokban
Mi mindenről tanúskodik a Me-OH néhány NMR spektruma lcélok és fogalmak: l- az NMR-rezonancia frekvencia (jel), a kémiai környezete, a kémiai eltolódás, l- az 1 H-NMR spektrum, l- az -OH és a -CH 3 csoportokban
Mágneses módszerek a mőszeres analitikában
 Mágneses módszerek a mőszeres analitikában NMR, ESR: mágneses momentummal rendelkezı anyagok minıségi és mennyiségi meghatározására alkalmas analitikai módszer Atommag spin állapotok közötti energiaátmenetek:
Mágneses módszerek a mőszeres analitikában NMR, ESR: mágneses momentummal rendelkezı anyagok minıségi és mennyiségi meghatározására alkalmas analitikai módszer Atommag spin állapotok közötti energiaátmenetek:
I. Az NMR spektrométer
 I. Az NMR spektrométer I. Az NMR spektrométer fő részei Rádióelektronikai konzol Munkaállomás Mágnes 2 I. Ultra-árnyékolt mágnesek Kettős szupravezető tekerccsel csökkenthető a mágnes szórt tere. Kisebb
I. Az NMR spektrométer I. Az NMR spektrométer fő részei Rádióelektronikai konzol Munkaállomás Mágnes 2 I. Ultra-árnyékolt mágnesek Kettős szupravezető tekerccsel csökkenthető a mágnes szórt tere. Kisebb
Mágneses módszerek a műszeres analitikában
 Mágneses módszerek a műszeres analitikában NMR, ESR: mágneses momentummal rendelkező anyagok minőségi és mennyiségi meghatározására alkalmas Atommag spin állapotok közötti energiaátmenetek: NMR (magmágneses
Mágneses módszerek a műszeres analitikában NMR, ESR: mágneses momentummal rendelkező anyagok minőségi és mennyiségi meghatározására alkalmas Atommag spin állapotok közötti energiaátmenetek: NMR (magmágneses
Szacharóz OH HO O O OH HO O OH HO OH HO 1
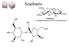 Szacharóz 1 A jelek átfedése miatt oldószer váltás DMS helyett D2 Measured by... Evaluated by... NMR-01 Bruker Avance-500 103.59 92.08 81.28 DEPTq 300K ns=1k D2 115 110 105 100 95 90 85 80 75 70 65 60
Szacharóz 1 A jelek átfedése miatt oldószer váltás DMS helyett D2 Measured by... Evaluated by... NMR-01 Bruker Avance-500 103.59 92.08 81.28 DEPTq 300K ns=1k D2 115 110 105 100 95 90 85 80 75 70 65 60
Az NMR spektroszkópia a fehérjék szolgálatában. Bodor Andrea. ELTE Szerkezeti Kémia és Biológia Laboratórium Visegrád
 Az NMR spektroszkópia a fehérjék szolgálatában Bodor Andrea ELTE Szerkezeti Kémia és Biológia Laboratórium 2011.01.18. Visegrád Nobel díjak tükrében 1952 Fizika: Módszer és elméleti alapok Felix Bloch
Az NMR spektroszkópia a fehérjék szolgálatában Bodor Andrea ELTE Szerkezeti Kémia és Biológia Laboratórium 2011.01.18. Visegrád Nobel díjak tükrében 1952 Fizika: Módszer és elméleti alapok Felix Bloch
NMR a peptid- és fehérje-kutatásban
 NMR a peptid- és fehérje-kutatásban A PDB adatbázisban megtalálható NMR alapú fehérjeszerkezetek számának alakulása az elmúlt évek során 4000 3500 3000 2500 2000 1500 1000 500 0 1987 1988 1989 1990 1991
NMR a peptid- és fehérje-kutatásban A PDB adatbázisban megtalálható NMR alapú fehérjeszerkezetek számának alakulása az elmúlt évek során 4000 3500 3000 2500 2000 1500 1000 500 0 1987 1988 1989 1990 1991
MÁGNESES MAGREZONANCIA A KÉMIÁBAN, GYÓGYSZERÉSZETBEN, ORVOSTUDOMÁNYBAN
 MÁGNESES MAGREZONANIA A KÉMIÁBAN, GYÓGYSZERÉSZETBEN, ORVOSTUDOMÁNYBAN 1) A jelenség 2) Nuclear Magnetic Resonance (NMR) 3) Magnetic Resonance Imaging (MRI) 4) Magnetic Resonance Spectroscopy (MRS) NMR
MÁGNESES MAGREZONANIA A KÉMIÁBAN, GYÓGYSZERÉSZETBEN, ORVOSTUDOMÁNYBAN 1) A jelenség 2) Nuclear Magnetic Resonance (NMR) 3) Magnetic Resonance Imaging (MRI) 4) Magnetic Resonance Spectroscopy (MRS) NMR
MÁGNESES MAGREZONANCIA A KÉMIÁBAN, GYÓGYSZERÉSZETBEN, ORVOSTUDOMÁNYBAN
 MÁGNESES MAGREZONANIA A KÉMIÁBAN, GYÓGYSZERÉSZETBEN, ORVOSTUDOMÁNYBAN 1) A jelenség 2) Nuclear Magnetic Resonance (NMR) 3) Magnetic Resonance Imaging (MRI) 4) Magnetic Resonance Spectroscopy (MRS) NMR
MÁGNESES MAGREZONANIA A KÉMIÁBAN, GYÓGYSZERÉSZETBEN, ORVOSTUDOMÁNYBAN 1) A jelenség 2) Nuclear Magnetic Resonance (NMR) 3) Magnetic Resonance Imaging (MRI) 4) Magnetic Resonance Spectroscopy (MRS) NMR
FEHÉRJÉK A MÁGNESEKBEN. Bodor Andrea ELTE, Szerkezeti Kémiai és Biológiai Laboratórium. Alkímia Ma, Budapest,
 FEHÉRJÉK A MÁGNESEKBEN Bodor Andrea ELTE, Szerkezeti Kémiai és Biológiai Laboratórium Alkímia Ma, Budapest, 2013.02.28. I. FEHÉRJÉK: L-α aminosavakból felépülő lineáris polimerek α H 2 N CH COOH amino
FEHÉRJÉK A MÁGNESEKBEN Bodor Andrea ELTE, Szerkezeti Kémiai és Biológiai Laboratórium Alkímia Ma, Budapest, 2013.02.28. I. FEHÉRJÉK: L-α aminosavakból felépülő lineáris polimerek α H 2 N CH COOH amino
Sohár Pál Varázslat, amitől láthatóvá válnak és életre kelnek a molekulák: Az NMR spektroszkópia
 MTA -ELTE FEÉRJEMODELLEZŐ KUTATÓCSOPORT - ÁLTALÁNOS ÉS SZERVETLEN KÉMIAI TANSZÉK EÖTVÖS LORÁND TUDOMÁNYEGYETEM Sohár Pál Varázslat, amitől láthatóvá válnak és életre kelnek a molekulák: Az NMR spektroszkópia
MTA -ELTE FEÉRJEMODELLEZŐ KUTATÓCSOPORT - ÁLTALÁNOS ÉS SZERVETLEN KÉMIAI TANSZÉK EÖTVÖS LORÁND TUDOMÁNYEGYETEM Sohár Pál Varázslat, amitől láthatóvá válnak és életre kelnek a molekulák: Az NMR spektroszkópia
Modern Fizika Labor. Fizika BSc. Értékelés: A mérés dátuma: A mérés száma és címe: 5. mérés: Elektronspin rezonancia. 2008. március 18.
 Modern Fizika Labor Fizika BSc A mérés dátuma: 28. március 18. A mérés száma és címe: 5. mérés: Elektronspin rezonancia Értékelés: A beadás dátuma: 28. március 26. A mérést végezte: 1/7 A mérés leírása:
Modern Fizika Labor Fizika BSc A mérés dátuma: 28. március 18. A mérés száma és címe: 5. mérés: Elektronspin rezonancia Értékelés: A beadás dátuma: 28. március 26. A mérést végezte: 1/7 A mérés leírása:
N I. 02 B. Mágneses anyagvizsgálat G ép. 118 2011.11.30. A mérés dátuma: A mérés eszközei: A mérés menetének leírása:
 N I. 02 B A mérés eszközei: Számítógép Gerjesztésszabályzó toroid transzformátor Minták Mágneses anyagvizsgálat G ép. 118 A mérés menetének leírása: Beindítottuk a számtógépet, Behelyeztük a mintát a ferrotestbe.
N I. 02 B A mérés eszközei: Számítógép Gerjesztésszabályzó toroid transzformátor Minták Mágneses anyagvizsgálat G ép. 118 A mérés menetének leírása: Beindítottuk a számtógépet, Behelyeztük a mintát a ferrotestbe.
Vektorok, mátrixok, tenzorok, T (emlékeztető)
 Vektorok, mátrixok, tenzorok, T (emlékeztető) A = T*B Tenzor: lineáris vektorfüggvény, amely két vektormennyiség közötti összefüggést ír le, egy négyzetmátrix, M reprezentálja. M M M M = M M M M M M 11
Vektorok, mátrixok, tenzorok, T (emlékeztető) A = T*B Tenzor: lineáris vektorfüggvény, amely két vektormennyiség közötti összefüggést ír le, egy négyzetmátrix, M reprezentálja. M M M M = M M M M M M 11
Modern Fizika Labor. Értékelés: A mérés dátuma: A mérés száma és címe: Az optikai pumpálás. A beadás dátuma: A mérést végezte:
 Modern Fizika Labor A mérés dátuma: 2005.10.19. A mérés száma és címe: 7. Az optikai pumpálás Értékelés: A beadás dátuma: 2005.10.28. A mérést végezte: Orosz Katalin Tóth Bence Optikai pumpálás segítségével
Modern Fizika Labor A mérés dátuma: 2005.10.19. A mérés száma és címe: 7. Az optikai pumpálás Értékelés: A beadás dátuma: 2005.10.28. A mérést végezte: Orosz Katalin Tóth Bence Optikai pumpálás segítségével
Cikloalkánok és származékaik konformációja
 1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
Eddigi tanulmányaink alapján már egy sor, a szeizmikában általánosan használt műveletet el tudunk végezni.
 Eddigi tanulmányaink alapján már egy sor, a szeizmikában általánosan használt műveletet el tudunk végezni. Kezdjük a sort a menetidőgörbékről, illetve az NMO korrekcióról tanultakkal. A következő ábrán
Eddigi tanulmányaink alapján már egy sor, a szeizmikában általánosan használt műveletet el tudunk végezni. Kezdjük a sort a menetidőgörbékről, illetve az NMO korrekcióról tanultakkal. A következő ábrán
Mágneses rezonanciás képalkotás AZ MRI elve, fizikai alapok
 MR-ALAPTANFOLYAM 2011 SZEGED Mágneses rezonanciás képalkotás AZ MRI elve, fizikai alapok Martos János Országos Idegtudományi Intézet Az agy MR vizsgálata A gerinc MR vizsgálata Felix Bloch Edward Mills
MR-ALAPTANFOLYAM 2011 SZEGED Mágneses rezonanciás képalkotás AZ MRI elve, fizikai alapok Martos János Országos Idegtudományi Intézet Az agy MR vizsgálata A gerinc MR vizsgálata Felix Bloch Edward Mills
Mag-mágneses rezonancia
 Mag-mágneses rezonancia jegyzıkönyv Zsigmond Anna Fizika BSc III. Mérés vezetıje: Csorba Ottó Mérés dátuma: 2010. március 25. Leadás dátuma: 2010. április 7. Mérés célja A labormérés célja a mag-mágneses
Mag-mágneses rezonancia jegyzıkönyv Zsigmond Anna Fizika BSc III. Mérés vezetıje: Csorba Ottó Mérés dátuma: 2010. március 25. Leadás dátuma: 2010. április 7. Mérés célja A labormérés célja a mag-mágneses
Dóczy-Bodnár Andrea október 3. Magmágneses rezonancia (NMR) és elektronspinrezonancia (ESR) alapjai
 Dóczy-Bodnár Andrea 2012. október 3. Magmágneses rezonancia (NMR) és elektronspinrezonancia (ESR) alapjai Atommagok saját impulzusmomentuma (spin) protonok, neutronok (elektronhoz hasonlóan) saját impulzusmomentum
Dóczy-Bodnár Andrea 2012. október 3. Magmágneses rezonancia (NMR) és elektronspinrezonancia (ESR) alapjai Atommagok saját impulzusmomentuma (spin) protonok, neutronok (elektronhoz hasonlóan) saját impulzusmomentum
Biomolekuláris szerkezeti dinamika
 Kísérletek, mérések célja Biomolekuláris szerkezeti dinamika Kellermayer Miklós Biomolekuláris szerkezet és működés pontosabb megismerése (folyamatok, állapotok, átmenetek, kölcsönhatások, mozgások, stb.)
Kísérletek, mérések célja Biomolekuláris szerkezeti dinamika Kellermayer Miklós Biomolekuláris szerkezet és működés pontosabb megismerése (folyamatok, állapotok, átmenetek, kölcsönhatások, mozgások, stb.)
Kutatási beszámoló. 2015. február. Tangens delta mérésére alkalmas mérési összeállítás elkészítése
 Kutatási beszámoló 2015. február Gyüre Balázs BME Fizika tanszék Dr. Simon Ferenc csoportja Tangens delta mérésére alkalmas mérési összeállítás elkészítése A TKI-Ferrit Fejlsztő és Gyártó Kft.-nek munkája
Kutatási beszámoló 2015. február Gyüre Balázs BME Fizika tanszék Dr. Simon Ferenc csoportja Tangens delta mérésére alkalmas mérési összeállítás elkészítése A TKI-Ferrit Fejlsztő és Gyártó Kft.-nek munkája
Műszeres analitika. Abrankó László. Molekulaspektroszkópia. Kémiai élelmiszervizsgálati módszerek csoportosítása
 Abrankó László Műszeres analitika Molekulaspektroszkópia Minőségi elemzés Kvalitatív Cél: Meghatározni, hogy egy adott mintában jelen vannak-e bizonyos ismert komponensek. Vagy ismeretlen komponensek azonosítása
Abrankó László Műszeres analitika Molekulaspektroszkópia Minőségi elemzés Kvalitatív Cél: Meghatározni, hogy egy adott mintában jelen vannak-e bizonyos ismert komponensek. Vagy ismeretlen komponensek azonosítása
MRI áttekintés. Orvosi képdiagnosztika 3. ea ősz
 MRI áttekintés Orvosi képdiagnosztika 3. ea. 2015 ősz MRI Alapelv: hogyan lehet mágneses vizsgálattal valamilyen anyag (jelen esetben az élő emberi szervezet) belső felépítéséről információt kapni? A mágneses
MRI áttekintés Orvosi képdiagnosztika 3. ea. 2015 ősz MRI Alapelv: hogyan lehet mágneses vizsgálattal valamilyen anyag (jelen esetben az élő emberi szervezet) belső felépítéséről információt kapni? A mágneses
Elektronspinrezonancia (ESR) - spektroszkópia
 Elektronspinrezonancia (ESR) - spektroszkópia Paramágneses anyagok vizsgáló módszere. A mágneses momentum iránykvantáltságán alapul. A mágneses momentum energiája B indukciójú mágneses térben E m S μ z
Elektronspinrezonancia (ESR) - spektroszkópia Paramágneses anyagok vizsgáló módszere. A mágneses momentum iránykvantáltságán alapul. A mágneses momentum energiája B indukciójú mágneses térben E m S μ z
Hangfrekvenciás mechanikai rezgések vizsgálata
 Hangfrekvenciás mechanikai rezgések vizsgálata (Mérési jegyzőkönyv) Hagymási Imre 2007. május 7. (hétfő délelőtti csoport) 1. Bevezetés Ebben a mérésben a szilárdtestek rugalmas tulajdonságait vizsgáljuk
Hangfrekvenciás mechanikai rezgések vizsgálata (Mérési jegyzőkönyv) Hagymási Imre 2007. május 7. (hétfő délelőtti csoport) 1. Bevezetés Ebben a mérésben a szilárdtestek rugalmas tulajdonságait vizsgáljuk
Mágneses magrezonancia (NMR) spektroszkópiák
 1 A szerves vegyületek szerkezetének meghatározására kezdetben az elemi analízist és az analógiákon alapuló szerkezetbizonyító szintézist illetve lebontást alkalmazták. Bonyolultabb vegyületek szerkezetének
1 A szerves vegyületek szerkezetének meghatározására kezdetben az elemi analízist és az analógiákon alapuló szerkezetbizonyító szintézist illetve lebontást alkalmazták. Bonyolultabb vegyületek szerkezetének
A II. kategória Fizika OKTV mérési feladatainak megoldása
 Nyomaték (x 0 Nm) O k t a t á si Hivatal A II. kategória Fizika OKTV mérési feladatainak megoldása./ A mágnes-gyűrűket a feladatban meghatározott sorrendbe és helyre rögzítve az alábbi táblázatban feltüntetett
Nyomaték (x 0 Nm) O k t a t á si Hivatal A II. kategória Fizika OKTV mérési feladatainak megoldása./ A mágnes-gyűrűket a feladatban meghatározott sorrendbe és helyre rögzítve az alábbi táblázatban feltüntetett
Problémás regressziók
 Universitas Eotvos Nominata 74 203-4 - II Problémás regressziók A közönséges (OLS) és a súlyozott (WLS) legkisebb négyzetes lineáris regresszió egy p- változós lineáris egyenletrendszer megoldása. Az egyenletrendszer
Universitas Eotvos Nominata 74 203-4 - II Problémás regressziók A közönséges (OLS) és a súlyozott (WLS) legkisebb négyzetes lineáris regresszió egy p- változós lineáris egyenletrendszer megoldása. Az egyenletrendszer
Mérés és adatgyűjtés
 Mérés és adatgyűjtés 4. óra - levelező Mingesz Róbert Szegedi Tudományegyetem 2011. március 18. MA lev - 4. óra Verzió: 1.3 Utolsó frissítés: 2011. május 15. 1/51 Tartalom I 1 A/D konverterek alkalmazása
Mérés és adatgyűjtés 4. óra - levelező Mingesz Róbert Szegedi Tudományegyetem 2011. március 18. MA lev - 4. óra Verzió: 1.3 Utolsó frissítés: 2011. május 15. 1/51 Tartalom I 1 A/D konverterek alkalmazása
Magmágneses rezonancia (NMR) és elektronspinrezonancia (ESR) alapjai
 Magmágneses rezonancia (NMR) és elektronspinrezonancia (ESR) alapjai Dóczy-Bodnár Andrea 2011. szeptember 28. Magmágneses rezonanciához kapcsolódó Nobel-díjak * Otto Stern, USA: Nobel Prize in Physics
Magmágneses rezonancia (NMR) és elektronspinrezonancia (ESR) alapjai Dóczy-Bodnár Andrea 2011. szeptember 28. Magmágneses rezonanciához kapcsolódó Nobel-díjak * Otto Stern, USA: Nobel Prize in Physics
Biomolekuláris szerkezeti dinamika
 Kísérletek, mérések célja Biomolekuláris szerkezeti dinamika Kellermayer Miklós Biomolekuláris szerkezet és működés pontosabb megismerése (folyamatok, állapotok, átmenetek, kölcsönhatások, stb.) Rádióspektroszkópiák
Kísérletek, mérések célja Biomolekuláris szerkezeti dinamika Kellermayer Miklós Biomolekuláris szerkezet és működés pontosabb megismerése (folyamatok, állapotok, átmenetek, kölcsönhatások, stb.) Rádióspektroszkópiák
2. Hangfrekvenciás mechanikai rezgések vizsgálata jegyzőkönyv. Zsigmond Anna Fizika Bsc II. Mérés dátuma: Leadás dátuma:
 2. Hangfrekvenciás mechanikai rezgések vizsgálata jegyzőkönyv Zsigmond Anna Fizika Bsc II. Mérés dátuma: 2008. 09. 24. Leadás dátuma: 2008. 10. 01. 1 1. Mérések ismertetése Az 1. ábrán látható összeállításban
2. Hangfrekvenciás mechanikai rezgések vizsgálata jegyzőkönyv Zsigmond Anna Fizika Bsc II. Mérés dátuma: 2008. 09. 24. Leadás dátuma: 2008. 10. 01. 1 1. Mérések ismertetése Az 1. ábrán látható összeállításban
A nehézfémek növényi vízháztartásra gyakorolt hatásának vizsgálata Mágneses Rezonancia készülékkel. Készítette: Jakusch Pál Környezettudós
 A nehézfémek növényi vízháztartásra gyakorolt hatásának vizsgálata Mágneses Rezonancia készülékkel Készítette: Jakusch Pál Környezettudós Célkitűzés MR készülék növényélettani célú alkalmazása Kontroll
A nehézfémek növényi vízháztartásra gyakorolt hatásának vizsgálata Mágneses Rezonancia készülékkel Készítette: Jakusch Pál Környezettudós Célkitűzés MR készülék növényélettani célú alkalmazása Kontroll
Stern Gerlach kísérlet. Készítette: Kiss Éva
 Stern Gerlach kísérlet Készítette: Kiss Éva Történelmi áttekintés 1890. Thomson-féle atommodell ( mazsolás puding ) 1909-1911. Rutherford modell (bolygó hasonlat) Bohr-féle atommodell Frank-Hertz kísérlet
Stern Gerlach kísérlet Készítette: Kiss Éva Történelmi áttekintés 1890. Thomson-féle atommodell ( mazsolás puding ) 1909-1911. Rutherford modell (bolygó hasonlat) Bohr-féle atommodell Frank-Hertz kísérlet
Név... intenzitás abszorbancia moláris extinkciós. A Wien-féle eltolódási törvény szerint az abszolút fekete test maximális emisszióképességéhez
 A Név... Válassza ki a helyes mértékegységeket! állandó intenzitás abszorbancia moláris extinkciós A) J s -1 - l mol -1 cm B) W g/cm 3 - C) J s -1 m -2 - l mol -1 cm -1 D) J m -2 cm - A Wien-féle eltolódási
A Név... Válassza ki a helyes mértékegységeket! állandó intenzitás abszorbancia moláris extinkciós A) J s -1 - l mol -1 cm B) W g/cm 3 - C) J s -1 m -2 - l mol -1 cm -1 D) J m -2 cm - A Wien-féle eltolódási
Szerves vegyületek szerkezetfelderítése NMR spektroszkópia
 Szerves vegyületek szerkezetfelderítése NMR spektroszkópia Az anyag összeállításához Krajsovszky Gábor, Mátyus Péter és Perczel András diáit is felhasználtuk. 1 (hullámhossz) -sugárzás röntgensugárzás
Szerves vegyületek szerkezetfelderítése NMR spektroszkópia Az anyag összeállításához Krajsovszky Gábor, Mátyus Péter és Perczel András diáit is felhasználtuk. 1 (hullámhossz) -sugárzás röntgensugárzás
Készítette: NÁDOR JUDIT. Témavezető: Dr. HOMONNAY ZOLTÁN. ELTE TTK, Analitikai Kémia Tanszék 2010
 Készítette: NÁDOR JUDIT Témavezető: Dr. HOMONNAY ZOLTÁN ELTE TTK, Analitikai Kémia Tanszék 2010 Bevezetés, célkitűzés Mössbauer-spektroszkópia Kísérleti előzmények Mérések és eredmények Összefoglalás EDTA
Készítette: NÁDOR JUDIT Témavezető: Dr. HOMONNAY ZOLTÁN ELTE TTK, Analitikai Kémia Tanszék 2010 Bevezetés, célkitűzés Mössbauer-spektroszkópia Kísérleti előzmények Mérések és eredmények Összefoglalás EDTA
A TÖMEGSPEKTROMETRIA ALAPJAI
 A TÖMEGSPEKTROMETRIA ALAPJAI web.inc.bme.hu/csonka/csg/oktat/tomegsp.doc alapján tömeg-töltés arány szerinti szétválasztás a legérzékenyebb módszerek közé tartozik (Nagyon kis anyagmennyiség kimutatására
A TÖMEGSPEKTROMETRIA ALAPJAI web.inc.bme.hu/csonka/csg/oktat/tomegsp.doc alapján tömeg-töltés arány szerinti szétválasztás a legérzékenyebb módszerek közé tartozik (Nagyon kis anyagmennyiség kimutatására
Biomatematika 12. Szent István Egyetem Állatorvos-tudományi Kar. Fodor János
 Szent István Egyetem Állatorvos-tudományi Kar Biomatematikai és Számítástechnikai Tanszék Biomatematika 12. Regresszió- és korrelációanaĺızis Fodor János Copyright c Fodor.Janos@aotk.szie.hu Last Revision
Szent István Egyetem Állatorvos-tudományi Kar Biomatematikai és Számítástechnikai Tanszék Biomatematika 12. Regresszió- és korrelációanaĺızis Fodor János Copyright c Fodor.Janos@aotk.szie.hu Last Revision
Medical Imaging 10 2009.04.07. 1. Mágneses rezonancia (MR, MRI, NMR) x B. Makroszkopikus tárgyalás
 Mágneses rezonancia (MR, MRI, NMR) Bloch, Purcell 1946, Nobel díj 1952. Mágneses momentum + - Mágneses térben a mágneses momentum az erővonalakkal csak meghatározott szöget zárhat be. Különböző irányokhoz
Mágneses rezonancia (MR, MRI, NMR) Bloch, Purcell 1946, Nobel díj 1952. Mágneses momentum + - Mágneses térben a mágneses momentum az erővonalakkal csak meghatározott szöget zárhat be. Különböző irányokhoz
Alkalmazás a makrókanónikus sokaságra: A fotongáz
 Alkalmazás a makrókanónikus sokaságra: A fotongáz A fotonok az elektromágneses sugárzás hordozó részecskéi. Spinkvantumszámuk S=, tehát kvantumstatisztikai szempontból bozonok. Fotonoknak habár a spinkvantumszámuk,
Alkalmazás a makrókanónikus sokaságra: A fotongáz A fotonok az elektromágneses sugárzás hordozó részecskéi. Spinkvantumszámuk S=, tehát kvantumstatisztikai szempontból bozonok. Fotonoknak habár a spinkvantumszámuk,
2. Laboratóriumi gyakorlat A TERMISZTOR. 1. A gyakorlat célja. 2. Elméleti bevezető
 . Laboratóriumi gyakorlat A EMISZO. A gyakorlat célja A termisztorok működésének bemutatása, valamint főbb paramétereik meghatározása. Az ellenállás-hőmérséklet = f és feszültség-áram U = f ( I ) jelleggörbék
. Laboratóriumi gyakorlat A EMISZO. A gyakorlat célja A termisztorok működésének bemutatása, valamint főbb paramétereik meghatározása. Az ellenállás-hőmérséklet = f és feszültség-áram U = f ( I ) jelleggörbék
Hogyan bírhatjuk szóra a molekulákat, avagy mi is az a spektroszkópia?
 Hogyan bírhatjuk szóra a molekulákat, avagy mi is az a spektroszkópia? Prof. Túri László (ELTE, Kémiai Intézet) turi@chem.elte.hu 2012. november 19. Szent László Gimnázium Önképzőkör 1 Kapcsolódási pontok
Hogyan bírhatjuk szóra a molekulákat, avagy mi is az a spektroszkópia? Prof. Túri László (ELTE, Kémiai Intézet) turi@chem.elte.hu 2012. november 19. Szent László Gimnázium Önképzőkör 1 Kapcsolódási pontok
Klórbenzol lebontásának vizsgálata termikus rádiófrekvenciás plazmában
 Klórbenzol lebontásának vizsgálata termikus rádiófrekvenciás plazmában Fazekas Péter Témavezető: Dr. Szépvölgyi János Magyar Tudományos Akadémia, Természettudományi Kutatóközpont, Anyag- és Környezetkémiai
Klórbenzol lebontásának vizsgálata termikus rádiófrekvenciás plazmában Fazekas Péter Témavezető: Dr. Szépvölgyi János Magyar Tudományos Akadémia, Természettudományi Kutatóközpont, Anyag- és Környezetkémiai
Akusztikai tervezés a geometriai akusztika módszereivel
 Akusztikai tervezés a geometriai akusztika módszereivel Fürjes Andor Tamás BME Híradástechnikai Tanszék Kép- és Hangtechnikai Laborcsoport, Rezgésakusztika Laboratórium 1 Tartalom A geometriai akusztika
Akusztikai tervezés a geometriai akusztika módszereivel Fürjes Andor Tamás BME Híradástechnikai Tanszék Kép- és Hangtechnikai Laborcsoport, Rezgésakusztika Laboratórium 1 Tartalom A geometriai akusztika
Alkalmazott spektroszkópia
 Alkalmazott spektroszkópia 009 Bányai István MR és a fémionok: koordinációs kémiai alkalmazások Bányai István Debreceni Egyetem TEK Kolloid- és Környezetkémiai Tanszék A mágnesség A mágneses erő: F pp
Alkalmazott spektroszkópia 009 Bányai István MR és a fémionok: koordinációs kémiai alkalmazások Bányai István Debreceni Egyetem TEK Kolloid- és Környezetkémiai Tanszék A mágnesség A mágneses erő: F pp
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
Mérés és adatgyűjtés
 Mérés és adatgyűjtés 4. óra Mingesz Róbert Szegedi Tudományegyetem 2012. február 27. MA - 4. óra Verzió: 2.1 Utolsó frissítés: 2012. március 12. 1/41 Tartalom I 1 Jelek 2 Mintavételezés 3 A/D konverterek
Mérés és adatgyűjtés 4. óra Mingesz Róbert Szegedi Tudományegyetem 2012. február 27. MA - 4. óra Verzió: 2.1 Utolsó frissítés: 2012. március 12. 1/41 Tartalom I 1 Jelek 2 Mintavételezés 3 A/D konverterek
1 kérdés. Személyes kezdőlap Villamos Gelencsér Géza Simonyi teszt május 13. szombat Teszt feladatok 2017 Előzetes megtekintés
 Személyes kezdőlap Villamos Gelencsér Géza Simonyi teszt 2017. május 13. szombat Teszt feladatok 2017 Előzetes megtekintés Kezdés ideje 2017. május 9., kedd, 16:54 Állapot Befejezte Befejezés dátuma 2017.
Személyes kezdőlap Villamos Gelencsér Géza Simonyi teszt 2017. május 13. szombat Teszt feladatok 2017 Előzetes megtekintés Kezdés ideje 2017. május 9., kedd, 16:54 Állapot Befejezte Befejezés dátuma 2017.
NMR spektroszkópia (Nuclear Magnetic Resonance) Mágneses (atom)magrezonancia Spektroszkópia
 NMR spektroszkópia (Nuclear Magnetic Resonance) Mágneses (atom)magrezonancia Spektroszkópia Anyagszerkezeti vizsgálatok 2016. őszi félév Balogh Szabolcs sz.balogh@gmail.com Pannon Egyetem, NMR Laboratórium
NMR spektroszkópia (Nuclear Magnetic Resonance) Mágneses (atom)magrezonancia Spektroszkópia Anyagszerkezeti vizsgálatok 2016. őszi félév Balogh Szabolcs sz.balogh@gmail.com Pannon Egyetem, NMR Laboratórium
2010. január 31-én zárult OTKA pályázat zárójelentése: K62441 Dr. Mihály György
 Hidrosztatikus nyomással kiváltott elektronszerkezeti változások szilárd testekben A kutatás célkitűzései: A szilárd testek elektromos és mágneses tulajdonságait az alkotó atomok elektronhullámfüggvényeinek
Hidrosztatikus nyomással kiváltott elektronszerkezeti változások szilárd testekben A kutatás célkitűzései: A szilárd testek elektromos és mágneses tulajdonságait az alkotó atomok elektronhullámfüggvényeinek
Fizikai kémia Mágneses magrezonancia spektroszkópia alapjai. Mágneses magrezonancia - NMR. Mágneses magrezonancia - NMR
 Fizikai kémia 2.. Mágneses magrezonancia spektroszkópia alapjai Dr. Berkesi Ottó SZTE Fizikai Kémiai és Anyagtudományi Tanszéke 205 Mágneses magrezonancia - NMR Amint azt a korábbiakban megismertük a molekulákban
Fizikai kémia 2.. Mágneses magrezonancia spektroszkópia alapjai Dr. Berkesi Ottó SZTE Fizikai Kémiai és Anyagtudományi Tanszéke 205 Mágneses magrezonancia - NMR Amint azt a korábbiakban megismertük a molekulákban
Modern Fizika Labor. Fizika BSc. Értékelés: A mérés dátuma: A mérés száma és címe: 12. mérés: Infravörös spektroszkópia. 2008. május 6.
 Modern Fizika Labor Fizika BSc A mérés dátuma: A mérés száma és címe: 12. mérés: Infravörös spektroszkópia Értékelés: A beadás dátuma: 28. május 13. A mérést végezte: 1/5 A mérés célja A mérés célja az
Modern Fizika Labor Fizika BSc A mérés dátuma: A mérés száma és címe: 12. mérés: Infravörös spektroszkópia Értékelés: A beadás dátuma: 28. május 13. A mérést végezte: 1/5 A mérés célja A mérés célja az
Méréselmélet és mérőrendszerek
 Méréselmélet és mérőrendszerek 6. ELŐADÁS KÉSZÍTETTE: DR. FÜVESI VIKTOR 2016. 10. Mai témáink o A hiba fogalma o Méréshatár és mérési tartomány M é r é s i h i b a o A hiba megadása o A hiba eredete o
Méréselmélet és mérőrendszerek 6. ELŐADÁS KÉSZÍTETTE: DR. FÜVESI VIKTOR 2016. 10. Mai témáink o A hiba fogalma o Méréshatár és mérési tartomány M é r é s i h i b a o A hiba megadása o A hiba eredete o
M N. a. Spin = saját impulzus momentum vektor: L L nagysága:
 Az MR és MRI alapjai Magmágneses Rezonancia Spektroszkópia (MR) és Mágneses Rezonancia Képalkotás (MRI) uclear Magnetic Resonance: Alapelv felfedezéséért Fizikai obel díj, 1952 Felix Bloch és Edward M.
Az MR és MRI alapjai Magmágneses Rezonancia Spektroszkópia (MR) és Mágneses Rezonancia Képalkotás (MRI) uclear Magnetic Resonance: Alapelv felfedezéséért Fizikai obel díj, 1952 Felix Bloch és Edward M.
Konvexitás, elaszticitás
 DIFFERENCIÁLSZÁMÍTÁS ALKALMAZÁSAI Konveitás, elaszticitás Tanulási cél A másodrendű deriváltat vizsgálva milyen következtetéseket vonhatunk le a üggvény konveitására vonatkozóan. Elaszticitás ogalmának
DIFFERENCIÁLSZÁMÍTÁS ALKALMAZÁSAI Konveitás, elaszticitás Tanulási cél A másodrendű deriváltat vizsgálva milyen következtetéseket vonhatunk le a üggvény konveitására vonatkozóan. Elaszticitás ogalmának
Mérési hibák 2006.10.04. 1
 Mérési hibák 2006.10.04. 1 Mérés jel- és rendszerelméleti modellje Mérési hibák_labor/2 Mérési hibák mérési hiba: a meghatározandó értékre a mérés során kapott eredmény és ideális értéke közötti különbség
Mérési hibák 2006.10.04. 1 Mérés jel- és rendszerelméleti modellje Mérési hibák_labor/2 Mérési hibák mérési hiba: a meghatározandó értékre a mérés során kapott eredmény és ideális értéke közötti különbség
Szilárdtestek mágnessége. Mágnesesen rendezett szilárdtestek
 Szilárdtestek mágnessége Mágnesesen rendezett szilárdtestek 2 Mágneses anyagok Permanens atomi mágneses momentumok: irány A kétféle spin-beállású elektronok betöltöttsége különbözik (spin-polarizáció)
Szilárdtestek mágnessége Mágnesesen rendezett szilárdtestek 2 Mágneses anyagok Permanens atomi mágneses momentumok: irány A kétféle spin-beállású elektronok betöltöttsége különbözik (spin-polarizáció)
NMR SPEKTROSZKÓPIAI SPEKTRUMGYŰJTEMÉNY
 S ZEGEDI T UDMÁNYEGYETEM G YÓGYSZERANALITIKAI I NTÉZET NMR SPEKTRSZKÓPIAI SPEKTRUMGYŰJTEMÉNY KÜLÖNÖS TEKINTETTEL AZ ÉLELMISZERIPARBAN ÉS TÁPLÁLÉK-KIEGÉSZÍTŐKBEN ELŐFRDULÓ VEGYÜLETEKRE Dr. Dombi György
S ZEGEDI T UDMÁNYEGYETEM G YÓGYSZERANALITIKAI I NTÉZET NMR SPEKTRSZKÓPIAI SPEKTRUMGYŰJTEMÉNY KÜLÖNÖS TEKINTETTEL AZ ÉLELMISZERIPARBAN ÉS TÁPLÁLÉK-KIEGÉSZÍTŐKBEN ELŐFRDULÓ VEGYÜLETEKRE Dr. Dombi György
Méréselmélet és mérőrendszerek 2. ELŐADÁS (1. RÉSZ)
 Méréselmélet és mérőrendszerek 2. ELŐADÁS (1. RÉSZ) KÉSZÍTETTE: DR. FÜVESI VIKTOR 2016. 10. Mai témáink o A hiba fogalma o Méréshatár és mérési tartomány M é r é s i h i b a o A hiba megadása o A hiba
Méréselmélet és mérőrendszerek 2. ELŐADÁS (1. RÉSZ) KÉSZÍTETTE: DR. FÜVESI VIKTOR 2016. 10. Mai témáink o A hiba fogalma o Méréshatár és mérési tartomány M é r é s i h i b a o A hiba megadása o A hiba
Fizikai kémia Részecskék mágneses térben, ESR spektroszkópia. Részecskék mágneses térben. Részecskék mágneses térben
 06.08.. Fizikai kémia. 3. Részecskék mágneses térben, ESR spektroszkópia Dr. Berkesi Ottó SZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Részecskék mágneses térben A részecskék mágneses térben ugyanúgy
06.08.. Fizikai kémia. 3. Részecskék mágneses térben, ESR spektroszkópia Dr. Berkesi Ottó SZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Részecskék mágneses térben A részecskék mágneses térben ugyanúgy
Modern Fizika Labor Fizika BSC
 Modern Fizika Labor Fizika BSC A mérés dátuma: 2009. március 2. A mérés száma és címe: 5. Elektronspin rezonancia Értékelés: A beadás dátuma: 2009. március 5. A mérést végezte: Márton Krisztina Zsigmond
Modern Fizika Labor Fizika BSC A mérés dátuma: 2009. március 2. A mérés száma és címe: 5. Elektronspin rezonancia Értékelés: A beadás dátuma: 2009. március 5. A mérést végezte: Márton Krisztina Zsigmond
Uef UAF. 2-1. ábra (2.1) A gyakorlatban fennálló nagyságrendi viszonyokat (r,rh igen kicsi, Rbe igen nagy) figyelembe véve azt kapjuk, hogy.
 Az alábbiakban néhány példát mutatunk a CMR számítására. A példák egyrészt tanulságosak, mert a zavarelhárítással kapcsolatban fontos, általános következtetések vonhatók le belőlük, másrészt útmutatásul
Az alábbiakban néhány példát mutatunk a CMR számítására. A példák egyrészt tanulságosak, mert a zavarelhárítással kapcsolatban fontos, általános következtetések vonhatók le belőlük, másrészt útmutatásul
Áramköri elemek mérése ipari módszerekkel
 3. aboratóriumi gyakorlat Áramköri elemek mérése ipari módszerekkel. dolgozat célja oltmérők, ampermérők használata áramköri elemek mérésénél, mérési hibák megállapítása és azok függősége a használt mérőműszerek
3. aboratóriumi gyakorlat Áramköri elemek mérése ipari módszerekkel. dolgozat célja oltmérők, ampermérők használata áramköri elemek mérésénél, mérési hibák megállapítása és azok függősége a használt mérőműszerek
Foton-visszhang alapú optikai kvantum-memóriák: koherens kontroll optikailag sűrű közegben
 Foton-visszhang alapú optikai kvantum-memóriák: koherens kontroll optikailag sűrű közegben Demeter Gábor MTA Wigner Fizikai Kutatóközpont, RMI Demeter Gábor (MTA Wigner RCP... / 4 Bevezetés / Motiváció
Foton-visszhang alapú optikai kvantum-memóriák: koherens kontroll optikailag sűrű közegben Demeter Gábor MTA Wigner Fizikai Kutatóközpont, RMI Demeter Gábor (MTA Wigner RCP... / 4 Bevezetés / Motiváció
π π A vivőhullám jelalakja (2. ábra) A vivőhullám periódusideje T amplitudója A az impulzus szélessége szögfokban 2p. 2p [ ]
![π π A vivőhullám jelalakja (2. ábra) A vivőhullám periódusideje T amplitudója A az impulzus szélessége szögfokban 2p. 2p [ ] π π A vivőhullám jelalakja (2. ábra) A vivőhullám periódusideje T amplitudója A az impulzus szélessége szögfokban 2p. 2p [ ]](/thumbs/92/108201304.jpg) Pulzus Amplitúdó Moduláció (PAM) A Pulzus Amplitúdó Modulációról abban az esetben beszélünk, amikor egy impulzus sorozatot használunk vivőhullámnak és ezen a vivőhullámon valósítjuk meg az amplitúdómodulációt
Pulzus Amplitúdó Moduláció (PAM) A Pulzus Amplitúdó Modulációról abban az esetben beszélünk, amikor egy impulzus sorozatot használunk vivőhullámnak és ezen a vivőhullámon valósítjuk meg az amplitúdómodulációt
T I T - M T T. Hevesy György Kémiaverseny. A megyei forduló feladatlapja. 7. osztály. A versenyző jeligéje:... Megye:...
 T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
 http://www.nature.com 1) Magerő-sugár: a magközéppontból mért távolság, ameddig a magerők hatótávolsága terjed. Rutherford-szórásból határozható meg. R=1,4 x 10-13 A 1/3 cm Az atommag terének potenciálja
http://www.nature.com 1) Magerő-sugár: a magközéppontból mért távolság, ameddig a magerők hatótávolsága terjed. Rutherford-szórásból határozható meg. R=1,4 x 10-13 A 1/3 cm Az atommag terének potenciálja
Speciális fluoreszcencia spektroszkópiai módszerek
 Speciális fluoreszcencia spektroszkópiai módszerek Fluoreszcencia kioltás Fluoreszcencia Rezonancia Energia Transzfer (FRET), Lumineszcencia A molekuláknak azt a fényemisszióját, melyet a valamilyen módon
Speciális fluoreszcencia spektroszkópiai módszerek Fluoreszcencia kioltás Fluoreszcencia Rezonancia Energia Transzfer (FRET), Lumineszcencia A molekuláknak azt a fényemisszióját, melyet a valamilyen módon
Compton-effektus. Zsigmond Anna. jegyzıkönyv. Fizika BSc III.
 Compton-effektus jegyzıkönyv Zsigmond Anna Fizika BSc III. Mérés vezetıje: Csanád Máté Mérés dátuma: 010. április. Leadás dátuma: 010. május 5. Mérés célja A kvantumelmélet egyik bizonyítékának a Compton-effektusnak
Compton-effektus jegyzıkönyv Zsigmond Anna Fizika BSc III. Mérés vezetıje: Csanád Máté Mérés dátuma: 010. április. Leadás dátuma: 010. május 5. Mérés célja A kvantumelmélet egyik bizonyítékának a Compton-effektusnak
A soros RC-kör. t, szög [rad] feszültség áramerősség. 2. ábra a soros RC-kör kapcsolási rajza. a) b) 3. ábra
![A soros RC-kör. t, szög [rad] feszültség áramerősség. 2. ábra a soros RC-kör kapcsolási rajza. a) b) 3. ábra A soros RC-kör. t, szög [rad] feszültség áramerősség. 2. ábra a soros RC-kör kapcsolási rajza. a) b) 3. ábra](/thumbs/54/33962402.jpg) A soros RC-kör Az átmeneti jelenségek vizsgálatakor soros RC-körben egyértelművé vált, hogy a kondenzátoron a késik az áramhoz képest. Váltakozóáramú körökben ez a késés, pontosan 90 fok. Ezt figyelhetjük
A soros RC-kör Az átmeneti jelenségek vizsgálatakor soros RC-körben egyértelművé vált, hogy a kondenzátoron a késik az áramhoz képest. Váltakozóáramú körökben ez a késés, pontosan 90 fok. Ezt figyelhetjük
Modern Fizika Labor. 12. Infravörös spektroszkópia. Fizika BSc. A mérés dátuma: okt. 04. A mérés száma és címe: Értékelés:
 Modern Fizika Labor Fizika BSc A mérés dátuma: 011. okt. 04. A mérés száma és címe: 1. Infravörös spektroszkópia Értékelés: A beadás dátuma: 011. dec. 1. A mérést végezte: Domokos Zoltán Szőke Kálmán Benjamin
Modern Fizika Labor Fizika BSc A mérés dátuma: 011. okt. 04. A mérés száma és címe: 1. Infravörös spektroszkópia Értékelés: A beadás dátuma: 011. dec. 1. A mérést végezte: Domokos Zoltán Szőke Kálmán Benjamin
Az anyagi rendszer fogalma, csoportosítása
 Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
Nagyhatékonyságú folyadékkromatográfia (HPLC)
 Nagyhatékonyságú folyadékkromatográfia (HPLC) Kromatográfiás módszerek osztályba sorolása 2 Elúciós technika A mintabevitel ún. dugószerűen történik A mozgófázis a kromatogram kifejlesztése alatt folyamatosan
Nagyhatékonyságú folyadékkromatográfia (HPLC) Kromatográfiás módszerek osztályba sorolása 2 Elúciós technika A mintabevitel ún. dugószerűen történik A mozgófázis a kromatogram kifejlesztése alatt folyamatosan
NEUTRON-DETEKTOROK VIZSGÁLATA. Mérési útmutató BME NTI 1997
 NEUTRON-DETEKTOROK VIZSGÁLATA Mérési útmutató Gyurkócza Csaba, Balázs László BME NTI 1997 Tartalomjegyzék 1. Bevezetés 3. 2. Elméleti összefoglalás 3. 2.1. A neutrondetektoroknál alkalmazható legfontosabb
NEUTRON-DETEKTOROK VIZSGÁLATA Mérési útmutató Gyurkócza Csaba, Balázs László BME NTI 1997 Tartalomjegyzék 1. Bevezetés 3. 2. Elméleti összefoglalás 3. 2.1. A neutrondetektoroknál alkalmazható legfontosabb
Fizikai kémia 2. ZH V. kérdések I. félévtől
 Fizikai kémia 2. ZH V. kérdések 2016-17 I. félévtől Szükséges adatok és állandók: k=1,38066 10-23 JK; c= 2,99792458 10 8 m/s; e= 1,602177 10-19 C; h=6,62608 10-34 Js; N A= 6,02214 10 23 mol -1 ; me= 9,10939
Fizikai kémia 2. ZH V. kérdések 2016-17 I. félévtől Szükséges adatok és állandók: k=1,38066 10-23 JK; c= 2,99792458 10 8 m/s; e= 1,602177 10-19 C; h=6,62608 10-34 Js; N A= 6,02214 10 23 mol -1 ; me= 9,10939
τ Γ ħ (ahol ħ=6,582 10-16 evs) 2.3. A vizsgálati módszer: Mössbauer-spektroszkópia (Forrás: Buszlai Péter, szakdolgozat) 2.3.1. A Mössbauer-effektus
 2.3. A vizsgálati módszer: Mössbauer-spektroszkópia (Forrás: Buszlai Péter, szakdolgozat) 2.3.1. A Mössbauer-effektus A Mössbauer-spektroszkópia igen nagy érzékenységű spektroszkópia módszer. Alapfolyamata
2.3. A vizsgálati módszer: Mössbauer-spektroszkópia (Forrás: Buszlai Péter, szakdolgozat) 2.3.1. A Mössbauer-effektus A Mössbauer-spektroszkópia igen nagy érzékenységű spektroszkópia módszer. Alapfolyamata
Orvosi jelfeldolgozás. Információ. Információtartalom. Jelek osztályozása De, mi az a jel?
 Orvosi jelfeldolgozás Információ De, mi az a jel? Jel: Információt szolgáltat (információ: új ismeretanyag, amely csökkenti a bizonytalanságot).. Megjelent.. Panasza? információ:. Egy beteg.. Fáj a fogam.
Orvosi jelfeldolgozás Információ De, mi az a jel? Jel: Információt szolgáltat (információ: új ismeretanyag, amely csökkenti a bizonytalanságot).. Megjelent.. Panasza? információ:. Egy beteg.. Fáj a fogam.
Analóg-digitális átalakítás. Rencz Márta/ Ress S. Elektronikus Eszközök Tanszék
 Analóg-digitális átalakítás Rencz Márta/ Ress S. Elektronikus Eszközök Tanszék Mai témák Mintavételezés A/D átalakítók típusok D/A átalakítás 12/10/2007 2/17 A/D ill. D/A átalakítók A világ analóg, a jelfeldolgozás
Analóg-digitális átalakítás Rencz Márta/ Ress S. Elektronikus Eszközök Tanszék Mai témák Mintavételezés A/D átalakítók típusok D/A átalakítás 12/10/2007 2/17 A/D ill. D/A átalakítók A világ analóg, a jelfeldolgozás
A Mössbauer-effektus vizsgálata
 A Mössbauer-effektus vizsgálata Tóth ence fizikus,. évfolyam 006.0.0. csütörtök beadva: 005.04.0. . A mérés célja három minta: lágyvas, nátrium-nitroprusszid és rozsdamentes acél Mössbauereffektusának
A Mössbauer-effektus vizsgálata Tóth ence fizikus,. évfolyam 006.0.0. csütörtök beadva: 005.04.0. . A mérés célja három minta: lágyvas, nátrium-nitroprusszid és rozsdamentes acél Mössbauereffektusának
lásd: enantiotóp, diasztereotóp
 anizokrón anisochronous árnyékolási állandó shielding constant árnyékolási járulékok és empirikus értelmezésük shielding contributions diamágneses és paramágneses árnyékolás diamagnetic and paramagnetic
anizokrón anisochronous árnyékolási állandó shielding constant árnyékolási járulékok és empirikus értelmezésük shielding contributions diamágneses és paramágneses árnyékolás diamagnetic and paramagnetic
KOVÁCS BÉLA, MATEMATIKA I.
 KOVÁCS BÉLA, MATEmATIkA I. 1 I. HALmAZOk 1. JELÖLÉSEk A halmaz fogalmát tulajdonságait gyakran használjuk a matematikában. A halmazt nem definiáljuk, ezt alapfogalomnak tekintjük. Ez nem szokatlan, hiszen
KOVÁCS BÉLA, MATEmATIkA I. 1 I. HALmAZOk 1. JELÖLÉSEk A halmaz fogalmát tulajdonságait gyakran használjuk a matematikában. A halmazt nem definiáljuk, ezt alapfogalomnak tekintjük. Ez nem szokatlan, hiszen
Az elválasztás elméleti alapjai
 Az elválasztás elméleti alapjai Az elválasztás során, a kromatogram kialakulása közben végbemenő folyamatok matematikai leirása bonyolult, ezért azokat teljességgel nem tárgyaljuk. Cél: * megismerni az
Az elválasztás elméleti alapjai Az elválasztás során, a kromatogram kialakulása közben végbemenő folyamatok matematikai leirása bonyolult, ezért azokat teljességgel nem tárgyaljuk. Cél: * megismerni az
Mágneses szuszceptibilitás mérése
 KLASSZIKUS FIZIKA LABORATÓRIUM 7. MÉRÉS Mágneses szuszceptibilitás mérése Mérést végezte: Enyingi Vera Atala ENVSAAT.ELTE Mérés időpontja: 2011. október 5. Szerda délelőtti csoport 1. A mérés célja Az
KLASSZIKUS FIZIKA LABORATÓRIUM 7. MÉRÉS Mágneses szuszceptibilitás mérése Mérést végezte: Enyingi Vera Atala ENVSAAT.ELTE Mérés időpontja: 2011. október 5. Szerda délelőtti csoport 1. A mérés célja Az
2, = 5221 K (7.2)
 7. Gyakorlat 4A-7 Az emberi szem kb. 555 nm hullámhossznál a Iegnagyobb érzékenységű. Adjuk meg annak a fekete testnek a hőmérsékletét, amely sugárzásának a spektrális teljesitménye ezen a hullámhosszon
7. Gyakorlat 4A-7 Az emberi szem kb. 555 nm hullámhossznál a Iegnagyobb érzékenységű. Adjuk meg annak a fekete testnek a hőmérsékletét, amely sugárzásának a spektrális teljesitménye ezen a hullámhosszon
Korszerű méréstechnikák az NMR-ben
 Magyar Kémiai Folyóirat - Előadások 27 Korszerű méréstechnikák az NMR-ben Batta Gyula, az MTA doktora Debreceni Egyetem, EC, Gyógyszerészi Kémia Tanszék MTA Antibiotikum-kémiai Kutatócsoport batta@tigris.unideb.hu
Magyar Kémiai Folyóirat - Előadások 27 Korszerű méréstechnikák az NMR-ben Batta Gyula, az MTA doktora Debreceni Egyetem, EC, Gyógyszerészi Kémia Tanszék MTA Antibiotikum-kémiai Kutatócsoport batta@tigris.unideb.hu
Átmenetifém-komplexek ESR-spektrumának jellemzıi
 Átmenetifém-komplexek ESR-spektrumának jellemzıi A párosítatlan elektron d-pályán van. Kevéssé delokalizálódik a fémionról, a fém-donoratom kötések meglehetısen ionos jellegőek. A spin-pálya csatolás viszonylag
Átmenetifém-komplexek ESR-spektrumának jellemzıi A párosítatlan elektron d-pályán van. Kevéssé delokalizálódik a fémionról, a fém-donoratom kötések meglehetısen ionos jellegőek. A spin-pálya csatolás viszonylag
Kémiai kötések. Kémiai kötések. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
T E R M É K T Á J É K O Z TAT Ó
 T E R M É K T Á J É K O Z TAT Ó ÚJ!!! SeCorr 08 korrrelátor A legújabb DSP technikával ellátott számítógépes támogatással rendelkező korrelátor a hibahelyek megtalálásához. 1 MI A KORRELÁCIÓ? A korreláció
T E R M É K T Á J É K O Z TAT Ó ÚJ!!! SeCorr 08 korrrelátor A legújabb DSP technikával ellátott számítógépes támogatással rendelkező korrelátor a hibahelyek megtalálásához. 1 MI A KORRELÁCIÓ? A korreláció
Koherens lézerspektroszkópia adalékolt optikai egykristályokban
 Koherens lézerspektroszkópia adalékolt optikai egykristályokban Kis Zsolt MTA Wigner Fizikai Kutatóközpont H-1121 Budapest, Konkoly-Thege Miklós út 29-33 2015. június 8. Hogyan nyerjünk információt egyes
Koherens lézerspektroszkópia adalékolt optikai egykristályokban Kis Zsolt MTA Wigner Fizikai Kutatóközpont H-1121 Budapest, Konkoly-Thege Miklós út 29-33 2015. június 8. Hogyan nyerjünk információt egyes
Jegyzőkönyv. mágneses szuszceptibilitás méréséről (7)
 Jegyzőkönyv a mágneses szuszceptibilitás méréséről (7) Készítette: Tüzes Dániel Mérés ideje: 8-1-1, szerda 14-18 óra Jegyzőkönyv elkészülte: 8-1-8 A mérés célja A feladat egy mágneses térerősségmérő eszköz
Jegyzőkönyv a mágneses szuszceptibilitás méréséről (7) Készítette: Tüzes Dániel Mérés ideje: 8-1-1, szerda 14-18 óra Jegyzőkönyv elkészülte: 8-1-8 A mérés célja A feladat egy mágneses térerősségmérő eszköz
Természettudományi Kutatóközpont, Magyar Tudományos Akadémia (MTA-TTK) Agyi Képalkotó Központ (AKK)
 Szimultán multi-slice EPI szekvenciák: funkcionális MRI kompromisszumok nélkül? Kiss Máté, Kettinger Ádám, Hermann Petra, Gál Viktor MTA-TTK Agyi Képalkotó Központ Természettudományi Kutatóközpont, Magyar
Szimultán multi-slice EPI szekvenciák: funkcionális MRI kompromisszumok nélkül? Kiss Máté, Kettinger Ádám, Hermann Petra, Gál Viktor MTA-TTK Agyi Képalkotó Központ Természettudományi Kutatóközpont, Magyar
Komplex számok trigonometrikus alakja
 Komplex számok trigonometrikus alakja 015. február 15. 1. Alapfeladatok 1. Feladat: Határozzuk meg az alábbi algebrai alakban adott komplex számok trigonometrikus alakját! z 1 = 4 + 4i, z = 4 + i, z =
Komplex számok trigonometrikus alakja 015. február 15. 1. Alapfeladatok 1. Feladat: Határozzuk meg az alábbi algebrai alakban adott komplex számok trigonometrikus alakját! z 1 = 4 + 4i, z = 4 + i, z =
Vezetők elektrosztatikus térben
 Vezetők elektrosztatikus térben Vezető: a töltések szabadon elmozdulhatnak Ha a vezető belsejében a térerősség nem lenne nulla akkor áram folyna. Ha a felületen a térerősségnek lenne tangenciális (párhuzamos)
Vezetők elektrosztatikus térben Vezető: a töltések szabadon elmozdulhatnak Ha a vezető belsejében a térerősség nem lenne nulla akkor áram folyna. Ha a felületen a térerősségnek lenne tangenciális (párhuzamos)
Tevékenység: Olvassa el a fejezetet! Gyűjtse ki és jegyezze meg a ragasztás előnyeit és a hátrányait! VIDEO (A ragasztás ereje)
 lvassa el a fejezetet! Gyűjtse ki és jegyezze meg a ragasztás előnyeit és a hátrányait! VIDE (A ragasztás ereje) A ragasztás egyre gyakrabban alkalmazott kötéstechnológia az ipari gyakorlatban. Ennek oka,
lvassa el a fejezetet! Gyűjtse ki és jegyezze meg a ragasztás előnyeit és a hátrányait! VIDE (A ragasztás ereje) A ragasztás egyre gyakrabban alkalmazott kötéstechnológia az ipari gyakorlatban. Ennek oka,
