Alkinek kötésrendszere és kémiai tulajdonságaik. C-H savasság, az abból eredő reakciók, etinilezés. Addíciós reakciók és jelentőségük.
|
|
|
- Ede Bognár
- 7 évvel ezelőtt
- Látták:
Átírás
1 Alkinek kötésrendszere és kémiai tulajdonságaik. C- savasság, az abból eredő reakciók, etinilezés. Addíciós reakciók és jelentőségük. Az acetilén vegyipari szerepe, kőszénbázisú vegyipar. Alkinek előállítása.
2 Alkinek 1 Egy vagy több hármaskötést tartalmazó szénhidrogének. Gyűrűben csak nagy tagszámnál. Általános képlet: C n 2n-2 (monoalkin), C C Alkinek kötésrendszere Legegyszerűbb: + 2 modell -váz a hibrid (sp) A-kból, a -kötések a p z A-k oldalirányú átlapolásával (két egymásra merőleges -kötés) A digonális sp hibridpályák miatt lineáris térszerkezet rövid, erős C C kötés E C C = kj/mól (de! 3 E C-C 1050 kj/mól, vagyis továbbra is érvényesül a -kötés kisebb hozzájárulása) r C C = nm (vö. r C-C = nm, r C=C = nm) De a C- kötés is rövidül az sp hibridállapotú szénatom növekvő EN-a miatt!! Alkinek fizikai sajátságai asonlatosság az alkánokhoz, alkénekhez alacsony op, fp (hasonló másodlagos kötőerők) ldékonyság: apoláros oldószerekben jó, de a -elektronfelhő nagy elektronsűrűsége és jó polarizálhatósága miatt poláros oldószerekben is jobban oldódnak, mint az alkánok. 2 ldószer 2 Et Me 2 C S (tf%) (12 bar) Gyakorlati jelentőség: dissous gáz Dipólusmomentum: EN C(sp) > EN C(sp3) miatt töltéseltolódás valamennyi 1-alkin esetében permanens dipólmomentum. Me C C = 0.4 D
3 Alkinek kémiai sajátságai 1. Sav-bázis sajátságok Savasság Brönsted-savasság feltétel: alapállapotú polározottság, visszamaradó anion stabilitása Megjegyzés: savi erősség szempontjából döntő a képződő anion stabilitása (minél stabilabb az anion, annál erősebb a sav!) R C C R C C :B -B R C C Eredmény: megnövekedett C- savasság (pk > 25) Szénhidrogének savasságának összehasonlítása: alkán < alkén < 1-alkin Keletkező sók: acetilidek, karbidok 2. Alkinilezési (etinilezési) reakciók Negatív töltés nagy EN-ú atomon Vegyület pk a 3 C-C 3 ~42 2 C=C 2 ~36 C C 25 C- savasság következménye, a képződő karbanion nukleofil sajátságú elektrofil centrumokat támadhat. Jelentőség: C-C kötés kiépítése 2a. Támadás sp 3 szénatomon nukleofil szubsztitúció C-nukleofillel 3 C C C 1. NaN 2 2. BuBr R C C C LG R C C C + :LG távozó csoport 3 C C C (C 2 ) 3 C 3 Legjobb hozamok primer alkilhalogenidek esetében
4 Alkinek kémiai sajátságai 2. 2b. Alkinilezés sp 2 szénatomon C-nukleofil addíciója karbonil szénen R C C R 1 R 2 R C C R 1 R2 R C C R 1 R2 C C C 2 C C C C 2 but-2-in-1,4-diol Buta-1,3-dién gyártás lehetséges intermediere Ac 3. Addíciós reakciók részleges addíció teljes addíció Ac etinil-ösztradiol etinodiol-diacetát rális fogamzásgátló vegyületek R C C R 1 A B R R 1 C C A B A B A B R C C R 1 A B Általában elektrofil addíció, esetenként gyökös mechanizmus. Speciális esetekben megjelenhet a nukleofil addíció is (itt nem tárgyaljuk).
5 3a. alogénaddíció C C Cl 2 3b. idrogénklorid addíció C C Cl g 2 gyökös polimerizáció C C Cl Cl C C Cl vinil-klorid Alkinek kémiai sajátságai 3. Cl 2 Cl 2 C CCl 2 bázis Cl 3 C CCl 2 1,1-diklóretán -Cl ClC CCl 2 1,1,2-triklóretén extrahálószer, ruhatisztítás Az addíció második lépésénél érvényesül a Markovnyikov-szabály! 3c. Vízaddíció n Cl PVC Cl C C 3 C C g 2 3 C 3 C C C 3 g 2 3 C C 3 vinil-alkohol acetaldehid Keto-enol tautomeria Tautomerek: csak a hidrogének, illetve a kettőskötések/nemkötő elektronpárok helyzetében különböző konstitúciós izomerek B protonvándorlás, egyensúlyi folyamat A Dezmotrópia: viszonylag stabil, szétválasztható tautomerek (speciális eset!) X Érvényesül a Markovnyikovszabály! A B X
6 3d. Karbonsavak addíciója Alkinek kémiai sajátságai 4. (Poli)-vinil-alkohol előállítása csak közvetett úton! Gyakorlati jelentőség: műszálgyártás, lakk- és festékipar 3e. C- savak addíciója
7 4. Redukció Alkinek kémiai sajátságai 5. Lehetőség részleges redukcióra, diasztereoszelektív módon Katalitikus hidrogénezés: mérgezett katalizátorok Pd/BaC 3 + piridin, kinolin, Pb, Pb(Ac) 2 Alkinek előállítása 1. Eliminációs reakciók 1a. 1,2-Dihalogénszármazékok bázis-indukált eliminációja 2 /kat. R R1 R R 1 Z Na/csf. N 3 Birch-redukció R 1 R E R R 1 R lg lg R 1 K Et/ -Klg R lg R 1 NaN 2 -Klg 1b. 1,1-Dihalogénszármazékok bázis-indukált eliminációja 2. Alkinilezés R R 1 PCl 5 3 C C C Cl R Cl 1. NaN 2 2. BuBr R 1 K Et/ - 2KCl R R 1 Kétlépéses folyamat, a vinil-halogenid csökkent reakciókészségű, erősebb bázis szükséges R R 1 3 C C C (C 2 ) 3 C 3
8 Ipari acetiléngyártás 1. Klasszikus karbid-bázisú eljárás CaC 3 + C o C CaC Ca() 2 Ívkemence, grafit elektródok átrányai: energiaigény ( V/27 MW), szennyezett termék Kőszén-bázisú szerves vegyipar (koksz). Csúcspont: karbid 2. Krakkolás krakkgáz 3. Metán (földgáz) pirolízis 2 C 4 C G = +405 kj/mól 4. Magas hőmérsékletű parciális oxidáció 2 C o C Acetiléngyártás: 400M kg/év 2 C C szintézisgáz Energiaigény fedezése: 2 részleges elégetése
9 Aromaticitás és feltételei. Semleges és töltéssel rendelkező homo- és heteroaromás rendszerek. Aromás elektrofil szubsztitúció alapesetei és reakciómechanizmusa. Szubsztituensek hatása az elektrofil szubsztitúciós reakciók sebességi viszonyaira (reaktivitás), irányítási szabályok (regioszelektivitás). Öt- és hattagú heteoaromás vegyületek elektrofil szubsztitúciós reakciói. Addíciós reakciók. Alkil oldalláncot tartalmazó aromás szénhidrogének reakciói, a benzil-típusú reaktív intermedierek. Fontosabb policiklusos aromás szénhidrogének.
10 Aromás vegyületek és csoportosításuk Formailag gyűrűs, konjugált kettőskötéseket (és nemkötő elektronpárokat) tartalmazó vegyületek DE! ez önmagában nem elegendő feltétel az aromás jelleghez N Aromás vegyületek jellemző kémiai sajátságok (telítetlenség ellenére nem addíciós, hanem szubsztitúciós reakciók) + anomális NMR spektroszkópiás viselkedés Csoportosítás 1. omoaromás vegyületek karbociklus (csak szénatomok!) N aromásak N N nem aromásak 1.1. Monociklusos homoaromás vegyületek benzol helyettesített származékai. Jellemző: triviális vagy féltriviális nevek (De! a végződés gyakran félrevezető) Ezekre a triviális nevekre alapul az elnevezések zöme szubsztitúciós névalkotás logikájával Néhány fontos csoport
11 Aromás vegyületek csoportosítása Policiklusos homoaromás vegyületek Izolált policiklusok Ar-(C) n -Ar 1 n = 0 Bifenil és származékai E Konjugációs kölcsönhatás a két gyűrű - elektronrendszere között koplanáris jelleg?? Nem! Gáz- és folyadékfázisban az o,o -hidrogének közötti van der Waals taszítás miatt csökkenő átlapolás Következmény: atrop izomeria n 1 Aril-szubsztituált alkánok 90 o 180 o 270 o 360 o C 2 C Ph 3 C Tritilkation (-gyök, -anion) igen nagy stabilitású. k: elektrondelokalizáció 19 centrumon difenilmetán trifenilmetán trifenilmetil- (tritil-)csoport Tritilkation határszerkezeti formái C C C C + további hat határszerkezet
12 Aromás vegyületek csoportosítása Kondenzált policiklusok két ponton (anellációs pont) kapcsolódó gyűrűk 2. eteroaromás vegyületek 1 heteroatom (leggyakrabban,s,n) a gyűrűben de! nem minden heterociklusos vagy telítetlen heterociklusos vegyület heteroaromás!! Csoportosítás: gyűrűtagszám szerint (legfontosabbak: 5 és 6-tagú) heteroatomok fajtája és száma szerint (legfontosabbak: 1 és 2 heteroatomos rendszerek) Nevezéktan itt is sok triviális név
13 eterociklusos vegyületek szisztematikus nomenklatúrája antzsch-widman (valamennyi heterociklusra alkalmazható) Az alapnevet a heteroatom(ok) nevéből származó előtag(ok)ból és a gyűrűtagszámára utaló szótövekből képezzük. A heteroatomok felsorolása megadott sorrendben történik, szükség esetén a név előtti helyzetszámokkal. A monociklusos vegyületek esetében a gyűrűt a legmagasabb rangú heteroatomtól ( S N) indulva számozzuk úgy, hogy a heteroatomok a lehető legkisebb helyzetszámot kapják. oxigén oxa- S kén tia- N nitrogén aza- Gyűrűméret Telítetlen Telített Gyűrűméret Telítetlen Telített 3 -irén -irán 7 -epin -epán 4 -et -etán 8 -ocin -okán 5 -ol -olán 9 -onin -onán 6 -in -án 10 -ecin -ekán A 3, 4, 7, 8, 9 és 10 tagú gyűrűk végződésének szótövét a megfelelő sokszorozó tagokból képezzük: ir-t a tri-ből, et-et a tetrá-ból, ep-et a heptá-ból, ok (oc)-ot az oktá-ból, on-t a noná-ból, ek (ec)-et a deká-ból; ezekhez telítetlen gyűrűk esetén az in (a 3 tagú gyűrűk esetén az én), telített gyűrűk esetén az án utótagot kapcsoljuk.
14 eterociklusos vegyületek szisztematikus nomenklatúrája 2. Néhány példa a heterociklusos vegyületek szisztematikus elnevezésére Aromaticitás és feltételei kiinduló pont: benzol Felfedezés: Faraday (1825) bálnazsír pirolízis, névadó: Liebig, összegképlet (C 6 6 ): Mitscherlich Speciális tulajdonságok: nincsen érzékelhető telítetlenség egyetlen monoszubsztituált származék valamennyi hidrogén ekvivalens egyetlen 1,2- (vagy 1,3- vagy 1,4-) diszubsztituált termék valamennyi szén ekvivalens (csak három diszubsztituált termék létezik) Ötletek vég nélkül Spektroszkópiás vizsgálatok: hattagú, síkalkatú gyűrű, szimmetrikus szerkezet, egyenértékű C-C és C- kötések, átmeneti C-C kötésrend (1 és 2 között!!) d C-C = nm, d C- = nm d C-C = nm, d C=C = nm
15 Aromaticitás és feltételei 2. Legegyszerűbb modell: 6 + kötés, zárt gyűrűben folyamatos elektronáramlás E * 6 rendszer, 6 centrumos M Nem egyszerű konjugáció, teljesen szimmetrikus elektroneloszlás!! ( i vagy i 2 ) * * A benzol nem ciklohexa-1,3,5-trién Extra stabilizációs energia (empirikus rezonanciaenergia) = E ciklohexa-1,3,5-trién - E benzol 147 kj/mól (de ez modellfüggő érték!!) Robinson-gyűrű (1925) csak benzolra jó, policiklusos aromásoknál megtévesztő 2 /kat. Bizonyíték hidrogénezési hők 2 /kat. 2 /kat. 2 /kat. = -119 kj/mól 3x = -357 kj/mól = -208 kj/mól idrogénezési hők különbsége: 149 kj/mól Az első hidrogénezési lépésböl számított hidrogénezési hő különbség (benzolhoz képest): 125 kj/mól Az egyszerű konjugációs energianyereséget messze meghaladó stabilizáció!!
16 Aromaticitás és feltételei 3. Aromaticitáshoz kapcsolódó extra stabilitás reprezentációja határszerkezetekkel 80%-os részesedés Megjegyzés: a határszerkezeti formák nagyon gyakran fiktív/nem az adott struktúrát ténylegesen reprezentáló képződmények Aromaticitás feltételei: síkalkatú gyűrű valamennyi gyűrűt alkotó atom sp 2 hibridállapotú a -rendszert (4n + 2) számú p z elektron alakítja ki (ückel-szabály) (n = 0,1,2,., n) További változatok aromás rendszerek kialakulására 1.1. Töltéses homoaromás rendszerek (ückel-szabály, n = 1) sp 3 sp 2 rehibridizáció hajtóereje az aromás rendszer kialakulása ciklopentadienát anion atárszerkezetek ugyancsak a teljesen szimmetrikus, egyenletes töltéseloszlást mutatják Bizonyíték: ciklopentadién szokatlanul erős C- savassága
17 Aromaticitás és feltételei 4. Megvalósulás kation esetére cikloheptatrienilium (tropilium) ion Megjegyzés: az aromaticitás szempontjából a gyűrűt alkotó atomok számának nincsen jelentősége! atárszerkezeti formák: Az elektroneloszlás itt is teljesen egyenletes a gyűrűt alkotó szénatomokon 1.2. Policiklusos homoaromás vegyületek (ückel-szabály, n > 1) PA ( polycyclic aromatic hydrocarbons ) n = 2 n = 3 n = 3 n = 4 n = 4 De! -elektronfelhő nemszimmetrikussá válik, eltérő kötéshosszak, eltérő elektronsűrűség csökkenő rezonanciaenergia (stabilizációs energia)
18 Aromaticitás és feltételei 5. Rezonanciaenergia (kj/mól): Egy gyűrűre jutó eteroaromás vegyületek aromaticitása 2.1. Öttagú heteroaromás vegyületek Forrás: March: Advanced rganic Chemistry Legegyszerűbb eset: 1 heteroatom (,N,S), közös jellemző: nemkötő párok sp 2 heteroatom, részvétel a 6 rendszerben egy nemkötő párral Nemszimmetrikus elektroneloszlás, csökkent aromás jelleg heteroatomon csökken, szeneken nő az elektronsűrűség Szemléltetés rezonancia formákkal elektronban gazdag heteroaromás rendszer
19 Aromaticitás és feltételei 6. Rezonanciaenergia: (kj/mól) A legkevésbé aromás öttagú rendszer! További heteroatomok beépülése a gyűrűbe: az aromaticitás megőrzése csak piridinszerű nitrogénatomok beépülésével lehetséges! Nitrogén: kétféle sp 2 hibridállapot pirrolszerű : h 11 h 21 h 31 p z 2 piridinszerű : h 11 h 21 h 32 p z attagú heteroaromás vegyületek Piridin: benzollal analóg szerkezet, a nitrogén heteroatom csak egy p z elektront ad a 6 rendszerbe N EN különbségek miatt itt is torzuló elektroneloszlás, de itt a heteroatomon nő, a szeneken csökken az elektronsűrűség elektronban szegény heteroaromás rendszer nemkötő pár hibridpályán
20 Aromaticitás és feltételei 7. Látható: benzolhoz hasonló M-k, de! a kétszeresen degenerált pályák ekvivalenciája megszűnik. Erősen aromás rendszer, rezonanciaenergia: 117 kj/mól Piridin határszerkezeti formák: A hattagú heteroaromás gyűrűbe további piridinszerű nitrogének beépülhetnek. xigén és kén heteroatom hattagú heteroaromás gyűrűben csak pozitív töltéssel szerepelhet!
21 omoaromás vegyületek (benzolszármazékok) reakciói 1. Sav-bázis sajátságok gyenge C- savasság (pk a 36), forrás: sp 2 szénatom nagyobb EN-a savassági sorrend: R- < Ar- < RC C- deprotonálódást követően visszamaradó nemkötő pár (negatív töltés) sp 2 hibridpályán nincs kölcsönhatás a -elektronokkal, nincsen stabilizáció Bázicitás: -elektronfelhő jelenléte miatt gyenge -donorbázisok (Lewis-savak támadhatják) 2. Aromás elektrofil szubsztitúció (S E ) Kiindulás: -donorbázis jellegből fakadóan (az alkénekhez hasonlóan) elektronhiányos részecskék, elsődlegesen elektrofilek támadnak. E Első lépés: -komplex képződése, E még nem kötődik egy szénatomhoz sem, csak a -felhővel hat kölcsön (többen vitatják ) Második lépés: 6 rendszer megbomlása, -komplex (Wheland-komplex) kialakulása; az elektrofil kötődik az egyik szénatomhoz E E E E E -komplex -komplex
22 omoaromás vegyületek (benzolszármazékok) reakciói 2. De! a -komplex kialakulásával megbomlik a -szextett elvész az aromaticitásból eredő stabilizációs energia nehéz, nagy G -t igénylő lépés; erős elektrofil és/vagy katalizátor alkalmazása szükséges Második lépés alternatívái: addíció vagy szubsztitúció E E - :Nu Összegezve: E Nu Rearomatizáció kedvezményezett! Általában az második lépés (a -komplex képződése) a sebességmeghatározó
23 omoaromás vegyületek (benzolszármazékok) reakciói 3. Szubsztituált benzolszármazékok S E reakciói reaktivitás és regioszelektivitás aktivál o,p dezaktivál m Szubsztituensek csoportosíthatók 1. Reaktivitás szerint aktiváló (k Ph-G / k Ph- > 1) de! valamennyi pozícióban (o-, m-, p-) aktivál dezaktiváló (k Ph-G / k Ph- < 1) de! valamennyi pozícióban (o-, m-, p-) dezaktivál 2. Irányítás (regioszelektivitás) szerint I. rendű (o-, p-termék dominál) II. rendű (m-termék dominál) Két egymásra épülő, de egymástól független (eltérő tényezők által szabályozott) jelenség
24 omoaromás vegyületek (benzolszármazékok) reakciói 4. Legfontosabb szubsztituensek besorolása
25 omoaromás vegyületek (benzolszármazékok) reakciói 5. Összességében elektronküldő szubsztituens stabilabb -komplex (nagyobb reaktivitás) Összességében elektronszívó szubsztituens instabilabb -komplex (kisebb reaktivitás) Adott szubsztituens esetén a több határszerkezet miatt stabilabb -komplex megnövekedett részesedés a termékek között! Effektus Reaktivitás Regioszelektivitás +I +M aktiválás I. rendű -I +M -I < + M aktiválás I. rendű -I +M -I > + M dezaktiválás I. rendű -I -M dezaktiválás II. rendű Az aromás gyűrű elektronsűrűségéért (a -komplex stabilitásért/reaktivitásért) az induktív és a mezomer effektus együttesen felelős Egy adott -komplex stabilitásáért (irányítás, regioszelektivitás) kizárólagosan a mezomer effektus felelős o,p-irányítás: +M effektus (ok: eggyel több határszerkezet)
26 omoaromás vegyületek (benzolszármazékok) reakciói 6. Kompetitív reakciók TS-ok energiaszintje, a ammond-elv alapján közelítés a -komplex stabilitások alapján Lehetséges -komplexek és határszerkezeti formáik:
27 omoaromás vegyületek (benzolszármazékok) reakciói 7. Legfontosabb aromás elektrofil szubsztitúciós reakciók 2.1. alogénezés lg lg 2 G G Lewis-sav lg: általában Cl, Br Lewis-sav: Allg 3, Felg 3, BF 3, stb. push-pull mechanizmus Formális elektrofil: lg Katalizátor funkciója: lg generálás Br Br FeBr 3 Br + FeBr 4 nagy stabilitású anion G Br Br FeBr Friedel-Crafts alkilezés formális elektrofil: alkil kation (karbéniumion, R ) G R-lg Lewis-sav Katalizátor funkciója: R generálás Lewis-sav: Allg 3, BF 3, SnCl 4, SbF 5, stb. G R push-pull mechanizmus Megjegyzés: alkilkation (karbéniumion) egyéb úton is generálható ipari jelentőség G R lg Lewis-sav R R 2-2 R 2 C C 2 R C C2 R C C3 izopropil-benzol = kumol etil-benzol Protonforrás: F, 2 S 4, 3 P 4 /szilárd hordozó
28 omoaromás vegyületek (benzolszármazékok) reakciói Friedel-Crafts acilezés formális elektrofil: aciliumion (RC ) Katalizátor funkciója: RC generálás R-Clg vagy (RC2 ) C R G G G X Lewis-sav Lewis-sav R acilező ágensek: savkloridok vagy savanhidridek Aril-ketonok könnyű szintézise diacilezés veszélye csekély, nagy szelektivitás! 2.4. Nitrálás formális elektrofil: nitrilkation (nitróniumion, N 2 ) Alapvető különbség: elektrofil generálás Brönsted-savval 2 N cc. 2S 4 2 N 2-2 N 2 G cc. N3 G cc. 2 S 4 N 2 Füstölgő salétromsav di- és polinitro vegyületek. (Megjegyzés: a nitráló reagens jellege függ a G csoporttól is!) 2.5. Szulfonálás elektrofil: kén-trioxid (reagens: füstölgő kénsav, óleum) Különbség: az eddigi reakciókkal szemben a szulfonálás reverzibilis G S G S G S 2 Szintetikus alkalmazás: aromás szulfonsavak híg savval főzve deszulfonálhatók A reakciók a legfontosabb alaptípusok, rajtuk kívül számos további S E folyamat ismert!
29 omoaromás vegyületek (benzolszármazékok) reakciói 9. Policiklusos aromás vegyületek szubsztitúciója Kiindulás: nemszimmetrikus elektroneloszlás, csökkenő stabilizációs energia (kisebb aromaticitás) nagyobb reaktivitás, szubsztitúciók katalizátor nélkül is! Regioszelektivitás asonló módon: könnyű klórozás, nitrálás, Friedel-Crafts acilezés Antracén, fenantrén még könnyebb reakciók
30 3. Egyéb reakciók 3.1. xidációs reakciók Kiindulási pont: aromatizáció mértékének csökkenésével növekvő reaktivitás Benzol: nagyon kis reakciókészség KMn 4, Cr 3, 2 2, s 4 : nincs reakció 2 /V o C maleinsavanhidrid Fontos vegyipari alapanyag: poliésztergyanták, kopolimerek, műanyaglágyítók, lakkok, peszticidek + ideális dienofil Diels- Alder-reakciókban Policiklusos aromás vegyületek oxidációja a csökkent aromaticitás miatt növekvő reakciókészség Cr 3 Ac/RT megõrzõdõ 6 -rendszer! 2 /V o C ftálsavanhidrid Fontos vegyipari alapanyag: poliésztergyanták, műanyaglágyítók, lakkok, peszticidek K 2 Cr S 4 /RT megõrzõdõ 6 -rendszerek! megõrzõdõ 6 -rendszerek! 9,10-pozíciók kiemelt reakciókészsége
31 3.2. Redukciós reakciók 2 /kat. magas T, nagy p = +28 kj/mól = -114 kj/mól = -118 kj/mól Csak erőteljes körülmények között, köztitermékek nem izolálhatók A csökkenő stabilizációs energiával könnyebbé válik a redukció, mindig a maximális számú intakt 6 rendszer őrződik meg Diels-Alder reakciók Formálisan dién szerkezet. Benzol nem reagál, a naftalin nagyon nehezen, rossz hozammal. DE! 9,10 szénatomok kiemelt reaktivitása (maximális mértékű stabilizációs energia őrződik!)
32 Alkil-benzolok reakciói benzil pozíció kiemelt reakciókészsége benzil szénatom benzil helyzet k: benzil gyök kiemelt stabilitása delokalizált rendszer, rezonanciastabilizáció C 2 C 2 C 2 C 2 7 centrumos M, 7 elektronnal
33 eteroaromás vegyületek reakciói 1. Sav-bázis reakciók 1.1. Bázicitás Azolok és azinok: protonálódás a nitrogén nemkötő párján. Meghatározó: nemkötő pár része-e a 6 aromás rendszernek? Pirrolszerű nitrogén gyenge bázis Piridinszerű nitrogén erősebb bázis N pk b ~ 13.5 N Megszűnő aromás jelleg!! N pk b ~ 3.0 N pk b = 8.8 N 1.2. Savasság Pirrolszerű nitrogén tartalmazó rendszereknél gyenge Brönsted-savasság K N pk a ~ 15-2 N K
34 2. Elektrofil szubsztitúciós (S E ) reakciók 2.1. Öttagú ( -elektronfölösleggel rendelkező) heteroaromás vegyületek eteroaromás vegyületek reakciói 2. -elektronban gazdag szénatomok, benzolnál kisebb aromatizációs energia növekvő reakciókészség Reaktivitási sorrend: pirrol > furán > tiofén > benzol
35 eteroaromás vegyületek reakciói Friedel-Crafts acilezés Furán és pirrol instabillak az erős Lewis-sav katalizátorok jelenlétében (legfeljebb BF 3 Et 2, TiCl 4, SnCl 4 ) Ac 2 /BF 3 -Et 2 0 o C 2.2. attagú ( -elektronhiányos) heteroaromás vegyületek piridin -elektronban elszegényedett szénatomok, benzollal összemérhető aromatizációs energia gyenge reakciókészség További probléma: nitrogén nemkötő párja miatt Lewis-bázicitás a - felhő és a nemkötő pár verseng az elektrofilért, a reagens és a nemkötő pár verseng a katalizátorért gyenge reakciókészség
36 eteroaromás vegyületek reakciói 4. Példák a versengésre Brönsted-bázicitás X R lg N-alkilezés X: N N lg: N R N-alkilpiridinium só Jellemző: piridin esetében korlátozott számú és teljesítőképességű S E reakció, brutális körülmények, gyenge hozamok
37 eteroaromás vegyületek reakciói 5. Regioszelektivitás (irányítás) értelmezése a piridin esetében omoaromás vegyületek előállítása Alapvegyületek (benzol, toluol, xilol, naftalin ): természetes forrásból korábban: kőszénkátrány lepárlás, kémiai kezelés, frakcionálás jelenleg: kőolajbázis benzinfrakciók pirolízise, C 6 -C 8 frakciók katalitikus reformálása (dehidrociklizáció) R R R = R
38 Szubsztituált származékok omoaromás vegyületek előállítása 2. Benzol, toluol, xilol elektrofil szubsztitúciós reakcióival és azt követő funkciós csoport módosítással Példák: anilin, fenol nitrálás S E N 2 N 2 redukció Friedel-Crafts S E oxidáció + Alkilbenzolok előállítása Wurtz-Fittig-reakció G lg R-lg/Na Et 2 G R + melléktermékek Friedel-Crafts alkilezés megjegyzés: C 3 fölött előnytelen, keveréktermék keletkezése, továbbá polialkileződés veszélye Friedel-Crafts acilezés és azt követő redukció G R-Clg vagy (RC2 ) Lewis-sav G C R Clemmensen- vagy Kizsnyer-Wolff-redukció G 2 C R
AROMÁS SZÉNHIDROGÉNEK
 AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
Szénhidrogének III: Alkinok. 3. előadás
 Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Nitrogéntartalmú szerves vegyületek. 6. előadás
 Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Aromás vegyületek II. 4. előadás
 Aromás vegyületek II. 4. előadás Szubsztituensek irányító hatása Egy következő elektrofil hova épül be orto, meta, para pozíció CH 3 CH 3 CH 3 CH 3 E E E orto (1,2) meta (1,3) para (1,4) Szubsztituensek
Aromás vegyületek II. 4. előadás Szubsztituensek irányító hatása Egy következő elektrofil hova épül be orto, meta, para pozíció CH 3 CH 3 CH 3 CH 3 E E E orto (1,2) meta (1,3) para (1,4) Szubsztituensek
Szénhidrogének II: Alkének. 2. előadás
 Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Heterociklusos vegyületek
 Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
Tantárgycím: Szerves kémia
 Eötvös Loránd Tudományegyetem Természettudományi Kar Biológia Szak Kötelező tantárgy TANTÁRGY ADATLAP és tantárgykövetelmények 2005. Tantárgycím: Szerves kémia 2. Tantárgy kódja félév Követelmény Kredit
Eötvös Loránd Tudományegyetem Természettudományi Kar Biológia Szak Kötelező tantárgy TANTÁRGY ADATLAP és tantárgykövetelmények 2005. Tantárgycím: Szerves kémia 2. Tantárgy kódja félév Követelmény Kredit
10. Előadás. Heterociklusos vegyületek.
 0. Előadás eterociklusos vegyületek. ETECIKLUSS VEGYÜLETEK Felosztás:. telített telítetlen. heteroatomok száma 3. gyűrűk száma. heteroatomok milyensége (,, S, P, As, Si) oxa- S tia- aza- I. Monociklusos,
0. Előadás eterociklusos vegyületek. ETECIKLUSS VEGYÜLETEK Felosztás:. telített telítetlen. heteroatomok száma 3. gyűrűk száma. heteroatomok milyensége (,, S, P, As, Si) oxa- S tia- aza- I. Monociklusos,
ALKOHOLOK ÉS SZÁRMAZÉKAIK
 ALKLK ÉS SZÁRMAZÉKAIK Levezetés R R alkohol R R R éter Elnevezés Nyíltláncú, telített alkoholok általános név: alkanol alkil-alkohol 2 2 2 metanol etanol propán-1-ol metil-alkohol etil-alkohol propil-alkohol
ALKLK ÉS SZÁRMAZÉKAIK Levezetés R R alkohol R R R éter Elnevezés Nyíltláncú, telített alkoholok általános név: alkanol alkil-alkohol 2 2 2 metanol etanol propán-1-ol metil-alkohol etil-alkohol propil-alkohol
O 2 R-H 2 C-OH R-H 2 C-O-CH 2 -R R-HC=O
 Funkciós csoportok, reakcióik II C 4 C 3 C 2 C 2 R- 2 C- R- 2 C--C 2 -R C 2 R-C= ALKLK, ÉTEREK Faszesz C 3 Toxikus 30ml vakság LD 50 értékek alkoholokra patkányokban LD 50 = A populáció 50%-ának elhullásához
Funkciós csoportok, reakcióik II C 4 C 3 C 2 C 2 R- 2 C- R- 2 C--C 2 -R C 2 R-C= ALKLK, ÉTEREK Faszesz C 3 Toxikus 30ml vakság LD 50 értékek alkoholokra patkányokban LD 50 = A populáció 50%-ának elhullásához
Szerves Kémia. Farmakológus szakasszisztens képzés 2012/2013 ősz
 Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) kelep@elte.hu sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) kelep@elte.hu sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
HALOGÉNEZETT SZÉNHIDROGÉNEK
 ALOGÉNEZETT SZÉNIDOGÉNEK Elnevezés Nyíltláncú, telített általános név: halogénalkán alkilhalogenid l 2 l 2 2 l klórmetán klóretán 1klórpropán l metilklorid etilklorid propilklorid 2klórpropán izopropilklorid
ALOGÉNEZETT SZÉNIDOGÉNEK Elnevezés Nyíltláncú, telített általános név: halogénalkán alkilhalogenid l 2 l 2 2 l klórmetán klóretán 1klórpropán l metilklorid etilklorid propilklorid 2klórpropán izopropilklorid
3. A kémiai kötés. Kémiai kölcsönhatás
 3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
Részletes tematika: I. Félév: 1. Hét (4 óra): 2. hét (4 óra): 3. hét (4 óra): 4. hét (4 óra):
 Részletes tematika: I. Félév: 1. Hét (4 óra): Szerves Vegyületek Szerkezete. Kötéselmélet Lewis kötéselmélet; atompálya, molekulapálya; molekulapálya elmélet; átlapolódás, orbitálok hibridizációja; molekulák
Részletes tematika: I. Félév: 1. Hét (4 óra): Szerves Vegyületek Szerkezete. Kötéselmélet Lewis kötéselmélet; atompálya, molekulapálya; molekulapálya elmélet; átlapolódás, orbitálok hibridizációja; molekulák
szabad bázis a szerves fázisban oldódik
 1. feladat Oldhatóság 1 2 vízben tel. Na 2 CO 3 oldatban EtOAc/víz elegyben O-védett protonált sóként oldódik a sóból felszabadult a nem oldódó O-védett szabad bázis a felszabadult O-védett szabad bázis
1. feladat Oldhatóság 1 2 vízben tel. Na 2 CO 3 oldatban EtOAc/víz elegyben O-védett protonált sóként oldódik a sóból felszabadult a nem oldódó O-védett szabad bázis a felszabadult O-védett szabad bázis
Fémorganikus kémia 1
 Fémorganikus kémia 1 A fémorganikus kémia tárgya a szerves fémvegyületek előállítása, szerkezetvizsgálata és kémiai reakcióik tanulmányozása A fémorganikus kémia fejlődése 1760 Cadet bisz(dimetil-arzén(iii))-oxid
Fémorganikus kémia 1 A fémorganikus kémia tárgya a szerves fémvegyületek előállítása, szerkezetvizsgálata és kémiai reakcióik tanulmányozása A fémorganikus kémia fejlődése 1760 Cadet bisz(dimetil-arzén(iii))-oxid
Szerves Kémia II. 2016/17
 Szerves Kémia II. 2016/17 TKBE0301 és TKBE0312 4 kr Előfeltétel: TKBE0301 Szerves kémia I. Előadás: 2 óra/hét Dr. Juhász László egyetemi docens E 409 Tel: 22464 juhasz.laszlo@science.unideb.hu A 2016/17.
Szerves Kémia II. 2016/17 TKBE0301 és TKBE0312 4 kr Előfeltétel: TKBE0301 Szerves kémia I. Előadás: 2 óra/hét Dr. Juhász László egyetemi docens E 409 Tel: 22464 juhasz.laszlo@science.unideb.hu A 2016/17.
SZERVES KÉMIAI REAKCIÓEGYENLETEK
 SZERVES KÉMIAI REAKCIÓEGYENLETEK Budapesti Reáltanoda Fontos! Sok reakcióegyenlet több témakörhöz is hozzátartozik. Szögletes zárójel jelzi a reakciót, ami más témakörnél található meg. Alkánok, cikloalkánok
SZERVES KÉMIAI REAKCIÓEGYENLETEK Budapesti Reáltanoda Fontos! Sok reakcióegyenlet több témakörhöz is hozzátartozik. Szögletes zárójel jelzi a reakciót, ami más témakörnél található meg. Alkánok, cikloalkánok
1. KARBONILCSOPORTOT TARTALMAZÓ VEGYÜLETEK
 1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul
1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul
Helyettesített karbonsavak
 elyettesített karbonsavak 1 elyettesített savak alogénezett savak idroxisavak xosavak Dikarbonsavak Aminosavak (és fehérjék, l. Természetes szerves vegyületek) 2 alogénezett savak R az R halogént tartalmaz
elyettesített karbonsavak 1 elyettesített savak alogénezett savak idroxisavak xosavak Dikarbonsavak Aminosavak (és fehérjék, l. Természetes szerves vegyületek) 2 alogénezett savak R az R halogént tartalmaz
Összefoglaló előadás. Sav-bázis elmélet
 Összefoglaló előadás Sav-bázis elmélet SAV-BÁZIS TULAJDNSÁGKAT BEFLYÁSLÓ TÉNYEZŐK Elméletek: 1. Brönsted Lowry elmélet: sav - + donor; bázis - + akceptor; Konjugálódó (vagy korrespondáló) sav-bázis pár:
Összefoglaló előadás Sav-bázis elmélet SAV-BÁZIS TULAJDNSÁGKAT BEFLYÁSLÓ TÉNYEZŐK Elméletek: 1. Brönsted Lowry elmélet: sav - + donor; bázis - + akceptor; Konjugálódó (vagy korrespondáló) sav-bázis pár:
Javító vizsga követelményei kémia tantárgyból augusztus osztály
 Javító vizsga követelményei kémia tantárgyból 2019. augusztus 29. 10. osztály I. Szerves kémia-bevezetés 1. A szerves kémia kialakulása, tárgya (Tk. 64-65 old.) - Lavoisier: organogén elemek (C, H, O,
Javító vizsga követelményei kémia tantárgyból 2019. augusztus 29. 10. osztály I. Szerves kémia-bevezetés 1. A szerves kémia kialakulása, tárgya (Tk. 64-65 old.) - Lavoisier: organogén elemek (C, H, O,
Szerves Kémia II. Dr. Patonay Tamás egyetemi tanár E 405 Tel:
 Szerves Kémia II. TKBE0312 Előfeltétel: TKBE03 1 Szerves kémia I. Előadás: 2 óra/hét Dr. Patonay Tamás egyetemi tanár E 405 Tel: 22464 tpatonay@puma.unideb.hu A 2010/11. tanév tavaszi félévében az előadás
Szerves Kémia II. TKBE0312 Előfeltétel: TKBE03 1 Szerves kémia I. Előadás: 2 óra/hét Dr. Patonay Tamás egyetemi tanár E 405 Tel: 22464 tpatonay@puma.unideb.hu A 2010/11. tanév tavaszi félévében az előadás
Fémorganikus vegyületek
 Fémorganikus vegyületek A fémorganikus vegyületek fém-szén kötést tartalmaznak. Ennek polaritása a fém elektropozitivitásának mértékétől függ: az alkálifém-szén kötések erősen polárosak, jelentős százalékban
Fémorganikus vegyületek A fémorganikus vegyületek fém-szén kötést tartalmaznak. Ennek polaritása a fém elektropozitivitásának mértékétől függ: az alkálifém-szén kötések erősen polárosak, jelentős százalékban
H 3 C H + H 3 C C CH 3 -HX X 2
 1 Gyökös szubsztitúciók (láncreakciók gázfázisban) - 3 2 2 3 2 3-3 3 Szekunder gyök 3 2 2 2 3 2 2 3 3 2 3 3 Szekunder gyök A propánban az azonos strukturális helyzetű hidrogének és a szekunder hidrogének
1 Gyökös szubsztitúciók (láncreakciók gázfázisban) - 3 2 2 3 2 3-3 3 Szekunder gyök 3 2 2 2 3 2 2 3 3 2 3 3 Szekunder gyök A propánban az azonos strukturális helyzetű hidrogének és a szekunder hidrogének
Beszélgetés a szerves kémia elméleti alapjairól III.
 Beszélgetés a szerves kémia elméleti alapjairól III. Csökkentett vagy fokozott reakciókészségű halogénszármazékok? A középiskolai szerves kémiai tananyag alapján, a telített alkil-halogenidek reakcióképes
Beszélgetés a szerves kémia elméleti alapjairól III. Csökkentett vagy fokozott reakciókészségű halogénszármazékok? A középiskolai szerves kémiai tananyag alapján, a telített alkil-halogenidek reakcióképes
Osztályozó vizsgatételek. Kémia - 9. évfolyam - I. félév
 Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Intra- és intermolekuláris reakciók összehasonlítása
 Intra- és intermolekuláris reakciók összehasonlítása Intr a- és inter molekulár is r eakciok összehasonlítása molekulán belüli reakciók molekulák közötti reakciók 5- és 6-tagú gyűrűk könnyen kialakulnak.
Intra- és intermolekuláris reakciók összehasonlítása Intr a- és inter molekulár is r eakciok összehasonlítása molekulán belüli reakciók molekulák közötti reakciók 5- és 6-tagú gyűrűk könnyen kialakulnak.
1. KARBONILCSOPORTOT TARTALMAZÓ VEGYÜLETEK
 1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul
1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
R R C X C X R R X + C H R CH CH R H + BH 2 + Eliminációs reakciók
 Eliminációs reakciók Amennyiben egy szénatomhoz távozó csoport kapcsolódik és ugyanazon a szénatomon egy (az ábrákon vel jelölt) bázis által protonként leszakítható hidrogén is található, a nukleofil szubsztitúció
Eliminációs reakciók Amennyiben egy szénatomhoz távozó csoport kapcsolódik és ugyanazon a szénatomon egy (az ábrákon vel jelölt) bázis által protonként leszakítható hidrogén is található, a nukleofil szubsztitúció
KARBONSAVAK. A) Nyílt láncú telített monokarbonsavak (zsírsavak) O OH. karboxilcsoport. Példák. pl. metánsav, etánsav, propánsav...
 KABNSAVAK karboxilcsoport Példák A) Nyílt láncú telített monokarbonsavak (zsírsavak) "alkánsav" pl. metánsav, etánsav, propánsav... (nem használjuk) omológ sor hangyasav 3 2 2 2 valeriánsav 3 ecetsav 3
KABNSAVAK karboxilcsoport Példák A) Nyílt láncú telített monokarbonsavak (zsírsavak) "alkánsav" pl. metánsav, etánsav, propánsav... (nem használjuk) omológ sor hangyasav 3 2 2 2 valeriánsav 3 ecetsav 3
Összefoglalás. Telített Telítetlen Aromás Kötések Csak -kötések és -kötések és delokalizáció. Kötéshossz Nagyobb Kisebb Átmenet a kettő között
 Összefoglalás Telített Telítetlen Aromás Kötések Csak -kötések és -kötések és delokalizáció Kötéshossz Nagyobb Kisebb Átmenet a kettő között Reakciókészség Paraffin (legkevésbé) Nagy Átmenet a kettő között
Összefoglalás Telített Telítetlen Aromás Kötések Csak -kötések és -kötések és delokalizáció Kötéshossz Nagyobb Kisebb Átmenet a kettő között Reakciókészség Paraffin (legkevésbé) Nagy Átmenet a kettő között
Bevezetés. Szénvegyületek kémiája Organogén elemek (C, H, O, N) Életerő (vis vitalis)
 Szerves kémia Fontos tudnivalók Tárgy neve: Kémia alapjai I. Neptun kód: SBANKE1050 Előadó: Borzsák István C121 szerda 11-12 e-mail: iborzsak@ttk.nyme.hu http://www.bdf.hu/ttk/fldi/iborzsak/dokumentumok/
Szerves kémia Fontos tudnivalók Tárgy neve: Kémia alapjai I. Neptun kód: SBANKE1050 Előadó: Borzsák István C121 szerda 11-12 e-mail: iborzsak@ttk.nyme.hu http://www.bdf.hu/ttk/fldi/iborzsak/dokumentumok/
SZERVES KÉMIA. Szénvegyületek kémiája Lavoisier: az élő természetből származó anyagok elemi összetétele: Antoine Lavoisier 1743-1794
 SZERVES KÉMIA Szénvegyületek kémiája Lavoisier: az élő természetből származó anyagok elemi összetétele: szén, hidrogén, oxigén, nitrogén organogén elemek Antoine Lavoisier 1743-1794 Egy fejet levágni csak
SZERVES KÉMIA Szénvegyületek kémiája Lavoisier: az élő természetből származó anyagok elemi összetétele: szén, hidrogén, oxigén, nitrogén organogén elemek Antoine Lavoisier 1743-1794 Egy fejet levágni csak
4) 0,1 M koncentrációjú brómos oldat térfogata, amely elszínteleníthető 0,01 mól alkénnel: a) 0,05 L; b) 2 L; c) 0,2 L; d) 500 ml; e) 100 ml
 1) A (CH 3 ) 2 C=C(CH 3 ) 2 (I) és CH 3 -C C-CH 3 (II) szénhidrogének esetében helyesek a következő kijelentések: a) A vegyületek racionális (IUPAC) nevei: 2-butén (I) és 2-butin (II) b) Az I-es telített
1) A (CH 3 ) 2 C=C(CH 3 ) 2 (I) és CH 3 -C C-CH 3 (II) szénhidrogének esetében helyesek a következő kijelentések: a) A vegyületek racionális (IUPAC) nevei: 2-butén (I) és 2-butin (II) b) Az I-es telített
Halogénezett szénhidrogének
 Halogénezett szénhidrogének - Jellemző kötés (funkciós csoport): X X = halogén, F, l, Br, I - soportosítás: - halogénatom(ok) minősége szerint (X = F, l, Br, I) - halogénatom(ok) száma szerint (egy-, két-
Halogénezett szénhidrogének - Jellemző kötés (funkciós csoport): X X = halogén, F, l, Br, I - soportosítás: - halogénatom(ok) minősége szerint (X = F, l, Br, I) - halogénatom(ok) száma szerint (egy-, két-
Helyettesített Szénhidrogének
 elyettesített Szénhidrogének 1 alogénezett szénhidrogének 2 3 Alifás halogénvegyületek Szerkezet Kötéstávolság ( ) omolitikus disszociációs energia (kcal/mol) Alkil-F 1,38 116 Alkil-l 1,77 81 Alkil-Br
elyettesített Szénhidrogének 1 alogénezett szénhidrogének 2 3 Alifás halogénvegyületek Szerkezet Kötéstávolság ( ) omolitikus disszociációs energia (kcal/mol) Alkil-F 1,38 116 Alkil-l 1,77 81 Alkil-Br
Szerves kémiai reakciók csoportosítása Kinetikus és termodinamikus kontroll Szubsztituens hatások Sav-bázis tulajdonságokat befolyásoló tényezők
 Alapismeretek 4. Szerves kémiai reakciók csoportosítása Kinetikus és termodinamikus kontroll Szubsztituens hatások Sav-bázis tulajdonságokat befolyásoló tényezők Reaktivitás és stabilitás Kísérlettervezés
Alapismeretek 4. Szerves kémiai reakciók csoportosítása Kinetikus és termodinamikus kontroll Szubsztituens hatások Sav-bázis tulajdonságokat befolyásoló tényezők Reaktivitás és stabilitás Kísérlettervezés
11. Előadás. Heterociklusos vegyületek
 11. Előadás eterociklusos vegyületek ETECIKLUSS VEGYÜLETEK Felosztás: 1. telített telítetlen. heteroatomok száma 3. gyűrűk száma. heteroatomok milyensége (,, S, P, As, Si) oxa- S tia- aza- I. Monociklusos,
11. Előadás eterociklusos vegyületek ETECIKLUSS VEGYÜLETEK Felosztás: 1. telített telítetlen. heteroatomok száma 3. gyűrűk száma. heteroatomok milyensége (,, S, P, As, Si) oxa- S tia- aza- I. Monociklusos,
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések
 Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
AMINOK. Aminok rendűsége és típusai. Levezetés. Elnevezés. Alkaloidok (fiziológiailag aktív vegyületek) A. k a. primer RNH 2. szekunder R 2 NH NH 3
 Levezetés AMIK 2 primer 2 2 3 2 3 3 2 3 2 3 3 2 3 2 2 3 3 1 amin 1 amin 2 amin 3 amin 1aminobután butánamin nbutilamin Aminok rendűsége és típusai 2amino2metilpropán 2metil2propánamin tercierbutilamin
Levezetés AMIK 2 primer 2 2 3 2 3 3 2 3 2 3 3 2 3 2 2 3 3 1 amin 1 amin 2 amin 3 amin 1aminobután butánamin nbutilamin Aminok rendűsége és típusai 2amino2metilpropán 2metil2propánamin tercierbutilamin
Szerves kémia Fontosabb vegyülettípusok
 Fontosabb vegyülettípusok Szénhidrogének: alifás telített (metán, etán, propán, bután, ) alifás telítetlen (etén, etin, ) aromás (benzol, toluol, naftalin) Oxigéntartalmú vegyületek: hidroxivegyületek
Fontosabb vegyülettípusok Szénhidrogének: alifás telített (metán, etán, propán, bután, ) alifás telítetlen (etén, etin, ) aromás (benzol, toluol, naftalin) Oxigéntartalmú vegyületek: hidroxivegyületek
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
A hidrogénmolekula. Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve!
 Energia A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík
Energia A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík
CH 2 =CH-CH 2 -S-S-CH 2 -CH=CH 2
 10. Előadás zerves vegyületek kénatommal Példák: ZEVE VEGYÜLETEK KÉATMMAL CH 2 =CH-CH 2 ---CH 2 -CH=CH 2 diallil-diszulfid (fokhagyma olaj) H H H szacharin merkapto-purin tiofén C H2 H szulfonamid (Ultraseptyl)
10. Előadás zerves vegyületek kénatommal Példák: ZEVE VEGYÜLETEK KÉATMMAL CH 2 =CH-CH 2 ---CH 2 -CH=CH 2 diallil-diszulfid (fokhagyma olaj) H H H szacharin merkapto-purin tiofén C H2 H szulfonamid (Ultraseptyl)
szerotonin idegi mûködésben szerpet játszó vegyület
 3 2 2 3 2 3 2 3 2 2 3 3 1 amin 1 amin 2 amin 3 amin 2 3 3 2 3 1-aminobután butánamin n-butilamin 2-amino-2-metil-propán 2-metil-2-propánamin tercier-butilamin 1-metilamino-propán -metil-propánamin metil-propilamin
3 2 2 3 2 3 2 3 2 2 3 3 1 amin 1 amin 2 amin 3 amin 2 3 3 2 3 1-aminobután butánamin n-butilamin 2-amino-2-metil-propán 2-metil-2-propánamin tercier-butilamin 1-metilamino-propán -metil-propánamin metil-propilamin
IV. Elektrofil addíció
 IV. Elektrofil addíció Szerves molekulákban a kettős kötés kimutatására ismert analitikai módszer a 2 -os vagy a KMnO 4 -os reakció. 2 2 Mi történik tehát a brómmolekula addíciója során? 2 2 ciklusos bromónium
IV. Elektrofil addíció Szerves molekulákban a kettős kötés kimutatására ismert analitikai módszer a 2 -os vagy a KMnO 4 -os reakció. 2 2 Mi történik tehát a brómmolekula addíciója során? 2 2 ciklusos bromónium
6. Monoklór származékok száma, amelyek a propán klórozásával keletkeznek: A. kettő B. három C. négy D. öt E. egy
 1. Szerves vegyület, amely kovalens és ionos kötéseket is tartalmaz: A. terc-butil-jodid B. nátrium-palmitát C. dioleo-palmitin D. szalicilsav E. benzil-klorid 2. Szénhidrogén elegy, amely nem színteleníti
1. Szerves vegyület, amely kovalens és ionos kötéseket is tartalmaz: A. terc-butil-jodid B. nátrium-palmitát C. dioleo-palmitin D. szalicilsav E. benzil-klorid 2. Szénhidrogén elegy, amely nem színteleníti
KARBONIL-VEGY. aldehidek. ketonok O C O. muszkon (pézsmaszarvas)
 KABNIL-VEGY VEGYÜLETEK (XVEGYÜLETEK) aldehidek ketonok ' muszkon (pézsmaszarvas) oxocsoport: karbonilcsoport: Elnevezés Aldehidek szénhidrogén neve + al funkciós csoport neve: formil + triviális nevek
KABNIL-VEGY VEGYÜLETEK (XVEGYÜLETEK) aldehidek ketonok ' muszkon (pézsmaszarvas) oxocsoport: karbonilcsoport: Elnevezés Aldehidek szénhidrogén neve + al funkciós csoport neve: formil + triviális nevek
Alkánok összefoglalás
 Alkánok összefoglalás Nem vagyok különösebben tehetséges, csak szenvedélyesen kíváncsi. Albert Einstein Rausch Péter kémia-környezettan tanár Szénhidrogének Szénhidrogének Telített Telítetlen Nyílt láncú
Alkánok összefoglalás Nem vagyok különösebben tehetséges, csak szenvedélyesen kíváncsi. Albert Einstein Rausch Péter kémia-környezettan tanár Szénhidrogének Szénhidrogének Telített Telítetlen Nyílt láncú
Budapest, szeptember 5. Dr. Tóth Tünde egyetemi docens
 SZERVES KÉMIA I. levelező B.Sc. képzés, kód: BMEVESZAL17 Tantárgy követelményei 2016/2017. tanév I. félév Az alaptárgy heti 2,5 óra (páratlan héten 2 óra, páros héten 3 óra) előadásból és ezzel integrált
SZERVES KÉMIA I. levelező B.Sc. képzés, kód: BMEVESZAL17 Tantárgy követelményei 2016/2017. tanév I. félév Az alaptárgy heti 2,5 óra (páratlan héten 2 óra, páros héten 3 óra) előadásból és ezzel integrált
A kémiatanári zárószigorlat tételsora
 1. A. tétel A kémiatanári zárószigorlat tételsora Kémiai alapfogalmak: Atom- és molekulatömeg, anyagmennyiség, elemek és vegyületek elnevezése, jelölése. Kémiai egyenlet, sztöchiometria. A víz jelentősége
1. A. tétel A kémiatanári zárószigorlat tételsora Kémiai alapfogalmak: Atom- és molekulatömeg, anyagmennyiség, elemek és vegyületek elnevezése, jelölése. Kémiai egyenlet, sztöchiometria. A víz jelentősége
A szén molekulaképző sajátságai. Kémia 1 Szerves kémia. A szerves kémiai reakciók jellege. Szerves kémiai reakciók felosztása
 Kémia 1 Szerves kémia Tárgya: a szénvegyületek szerkezetének, tulajdonságainak és átalakulásainak a vizsgálata. A szerves vegyületek összetételükben és kémiai viselkedésükben jelentősen eltérnek a szervetlen
Kémia 1 Szerves kémia Tárgya: a szénvegyületek szerkezetének, tulajdonságainak és átalakulásainak a vizsgálata. A szerves vegyületek összetételükben és kémiai viselkedésükben jelentősen eltérnek a szervetlen
A hidrogénmolekula. Energia
 A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík Energia
A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík Energia
β-dikarbonil-vegyületek szintetikus alkalmazásai
 β-dikarbonil-vegyületek szintetikus alkalmazásai A β-dikarbonil vegyületek tipikus szerkezeti egysége a két karbonilcsoport, melyeket egy metilén híd köt össze. Ezek a származékok két fontos tulajdonsággal
β-dikarbonil-vegyületek szintetikus alkalmazásai A β-dikarbonil vegyületek tipikus szerkezeti egysége a két karbonilcsoport, melyeket egy metilén híd köt össze. Ezek a származékok két fontos tulajdonsággal
Cikloalkánok és származékaik konformációja
 1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
HETEROCIKLUSOS VEGYÜLETEK
 ETERCIKLU VEGYÜLETEK ETERCIKLU VEGYÜLETEK Csoportosítás eteroatom minősége:,, Gyűrű tagszáma: 3, 4, 5, 6, 7 stb. Telítettség mértéke szerint: - heteroaromás - heteroalkén - heteroalkán - Elnevezés: elsősorban
ETERCIKLU VEGYÜLETEK ETERCIKLU VEGYÜLETEK Csoportosítás eteroatom minősége:,, Gyűrű tagszáma: 3, 4, 5, 6, 7 stb. Telítettség mértéke szerint: - heteroaromás - heteroalkén - heteroalkán - Elnevezés: elsősorban
KARBONSAV-SZÁRMAZÉKOK
 KABNSAV-SZÁMAZÉKK Karbonsavszármazékok Karbonsavak H X Karbonsavszármazékok X Halogén Savhalogenid l Alkoxi Észter ' Amino Amid N '' ' Karboxilát Anhidrid Karbonsavhalogenidek Tulajdonságok: - színtelen,
KABNSAV-SZÁMAZÉKK Karbonsavszármazékok Karbonsavak H X Karbonsavszármazékok X Halogén Savhalogenid l Alkoxi Észter ' Amino Amid N '' ' Karboxilát Anhidrid Karbonsavhalogenidek Tulajdonságok: - színtelen,
Tartalomjegyzék Szénhidrogének
 Tartalomjegyzék Szénhidrogének... 1 20 Alkánok (Parafinok)... 1 7 A gyökök megnevezése...2 Az elágazó szénláncú alkánok megnevezése...3 Az alkánok izomériája...3 Előállítás...4 1) Szerves magnéziumvegyületekből...4
Tartalomjegyzék Szénhidrogének... 1 20 Alkánok (Parafinok)... 1 7 A gyökök megnevezése...2 Az elágazó szénláncú alkánok megnevezése...3 Az alkánok izomériája...3 Előállítás...4 1) Szerves magnéziumvegyületekből...4
Energiaminimum- elve
 Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
A kovalens kötés elmélete. Kovalens kötésű molekulák geometriája. Molekula geometria. Vegyértékelektronpár taszítási elmélet (VSEPR)
 4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
Szerves kémia 2014/2015
 Szerves kémia 2014/2015 Szerves vegyületek csoportjai Egyéb tématerületek Szerves vegyületek csoportjai Alifás szénhidrogének Alkánok Alkének Alkinek Aromás vegyületek Karboaromás vegyületek eteroaromás
Szerves kémia 2014/2015 Szerves vegyületek csoportjai Egyéb tématerületek Szerves vegyületek csoportjai Alifás szénhidrogének Alkánok Alkének Alkinek Aromás vegyületek Karboaromás vegyületek eteroaromás
7. POLICIKLUSOS AROMÁS VEGYÜLETEK
 . PLIIKLUSS ARMÁS VEGYÜLETEK.. Az aromaticitás Az aromaticitás fogalma az aromás vegyületek létrejöttének szerkezeti feltételeit és ezek fizikai következményeit foglalja össze. Az aromás-rendszer kialakulásának
. PLIIKLUSS ARMÁS VEGYÜLETEK.. Az aromaticitás Az aromaticitás fogalma az aromás vegyületek létrejöttének szerkezeti feltételeit és ezek fizikai következményeit foglalja össze. Az aromás-rendszer kialakulásának
1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban
 1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban a, diszulfidhíd (1 példa), b, hidrogénkötés (2 példa), c, töltés-töltés kölcsönhatás (2 példa)!
1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban a, diszulfidhíd (1 példa), b, hidrogénkötés (2 példa), c, töltés-töltés kölcsönhatás (2 példa)!
A tételek: Elméleti témakörök. Általános kémia
 A tételek: Elméleti témakörök Általános kémia 1. Az atomok szerkezete az atom alkotórészei, az elemi részecskék és jellemzésük a rendszám és a tömegszám, az izotópok, példával az elektronszerkezet kiépülésének
A tételek: Elméleti témakörök Általános kémia 1. Az atomok szerkezete az atom alkotórészei, az elemi részecskék és jellemzésük a rendszám és a tömegszám, az izotópok, példával az elektronszerkezet kiépülésének
A kémiai kötés. Kémiai kölcsönhatás
 A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
Beszélgetés a szerves kémia eméleti alapjairól IV.
 Beszélgetés a szerves kémia eméleti alapjairól IV. Az alkének elektrofil addiciós reakciói Az alkénekben levő kettős kötés pi-elekronrendszerének jellegzetes térbeli orientáltsága kifejezetten nukleofil
Beszélgetés a szerves kémia eméleti alapjairól IV. Az alkének elektrofil addiciós reakciói Az alkénekben levő kettős kötés pi-elekronrendszerének jellegzetes térbeli orientáltsága kifejezetten nukleofil
Toluol (Bruckner II/1 476) µ= 0.33 Debye
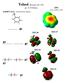 E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
A kovalens kötés polaritása
 Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
Tartalomjegyzék. Szénhidrogének... 1
 Tartalomjegyzék Szénhidrogének... 1 Alkánok (Parafinok)... 1 A gyökök megnevezése... 2 Az elágazó szénláncú alkánok megnevezése... 3 Az alkánok izomériája... 4 Előállítás... 4 1) Szerves magnéziumvegyületekből...
Tartalomjegyzék Szénhidrogének... 1 Alkánok (Parafinok)... 1 A gyökök megnevezése... 2 Az elágazó szénláncú alkánok megnevezése... 3 Az alkánok izomériája... 4 Előállítás... 4 1) Szerves magnéziumvegyületekből...
Reakciók osztályozása
 Reakciók osztályozása 1. Sav-bázis reakciók 2. Funkciós csoport átalakítása 3. Szén-szén kötés képződése A támadó ágens szerint nukleofil N (Nukleofil) elektrofil E (Elektrofil) gyök R (Radikális) 1. Szubsztitúciós
Reakciók osztályozása 1. Sav-bázis reakciók 2. Funkciós csoport átalakítása 3. Szén-szén kötés képződése A támadó ágens szerint nukleofil N (Nukleofil) elektrofil E (Elektrofil) gyök R (Radikális) 1. Szubsztitúciós
2. SZÉNSAVSZÁRMAZÉKOK. Szénsav: H 2 CO 3 Vízvesztéssel szén-dioxiddá alakul, a szén-dioxid a szénsav valódi anhidridje.
 2. ZÉAVZÁMAZÉKK 2.1. zénsavszármazékok szerkezete, elnevezése zénsav: 2 3 Vízvesztéssel szén-dioxiddá alakul, a szén-dioxid a szénsav valódi anhidridje. 2 + 1. ábra: A szénsav szén-dioxid egyensúly A szén-dioxid
2. ZÉAVZÁMAZÉKK 2.1. zénsavszármazékok szerkezete, elnevezése zénsav: 2 3 Vízvesztéssel szén-dioxiddá alakul, a szén-dioxid a szénsav valódi anhidridje. 2 + 1. ábra: A szénsav szén-dioxid egyensúly A szén-dioxid
OXOVEGYÜLETEK. Levezetés. Elnevezés O CH 2. O R C R' keton. O R C H aldehid. funkciós csoportok O. O CH oxocsoport karbonilcsoport formilcsoport
 XVEGYÜLETEK Levezetés 2 aldehid ' keton funkciós csoportok oxocsoport karbonilcsoport formilcsoport Elnevezés Aldehidek nyíltláncú (racionális név: alkánal) 3 2 2 butánal butiraldehid gyűrűs (cikloalkánkarbaldehid)
XVEGYÜLETEK Levezetés 2 aldehid ' keton funkciós csoportok oxocsoport karbonilcsoport formilcsoport Elnevezés Aldehidek nyíltláncú (racionális név: alkánal) 3 2 2 butánal butiraldehid gyűrűs (cikloalkánkarbaldehid)
SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit
 SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit b) Tárgyalják összehasonlító módon a csoport első elemének
SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit b) Tárgyalják összehasonlító módon a csoport első elemének
MECHANIZMUSGYŰJTEMÉNY a Szerves kémia I. előadáshoz
 Budapesti Műszaki és Gazdaságtudományi Egyetem Vegyészmérnöki és Biomérnöki Kar Szerves Kémia és Technológia Tanszék MECHANIZMUSGYŰJTEMÉNY a Szerves kémia I. előadáshoz Készítette: Kormos Attila Lektorálta:
Budapesti Műszaki és Gazdaságtudományi Egyetem Vegyészmérnöki és Biomérnöki Kar Szerves Kémia és Technológia Tanszék MECHANIZMUSGYŰJTEMÉNY a Szerves kémia I. előadáshoz Készítette: Kormos Attila Lektorálta:
OXOVEGYÜLETEK. Levezetés. Elnevezés O CH 2. O R C H aldehid. O R C R' keton. Aldehidek. propán. karbaldehid CH 3 CH 2 CH 2 CH O. butánal butiraldehid
 XVEGYÜLETEK Levezetés 2 aldehid ' keton Elnevezés Aldehidek propán karbaldehid 3 2 2 butánal butiraldehid oxo karbonil formil Példák 3 3 2 metanal etanal propanal formaldehid acetaldehid propionaldehid
XVEGYÜLETEK Levezetés 2 aldehid ' keton Elnevezés Aldehidek propán karbaldehid 3 2 2 butánal butiraldehid oxo karbonil formil Példák 3 3 2 metanal etanal propanal formaldehid acetaldehid propionaldehid
Szerves kémiai nevezéktan IV.
 zerves kémiai nevezéktan IV. A magyar kémiai elnevezés és helyesírás szabályai, az IUPAC (International Union of Pure and Applied Chemistry) zerves Kémiai ómenklatúrabizottságának 99-as ajánlása alapján.
zerves kémiai nevezéktan IV. A magyar kémiai elnevezés és helyesírás szabályai, az IUPAC (International Union of Pure and Applied Chemistry) zerves Kémiai ómenklatúrabizottságának 99-as ajánlása alapján.
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
Szerves kémia kommunikációs dosszié SZERVES KÉMIA ANYAGMÉRNÖK ALAPKÉPZÉS TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ
 SZERVES KÉMIA ANYAGMÉRNÖK ALAPKÉPZÉS TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŐSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI TANSZÉK Miskolc, 2008 Tartalomjegyzék 1. Tantárgyleírás, tárgyjegyzı, óraszám, kreditérték
SZERVES KÉMIA ANYAGMÉRNÖK ALAPKÉPZÉS TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŐSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI TANSZÉK Miskolc, 2008 Tartalomjegyzék 1. Tantárgyleírás, tárgyjegyzı, óraszám, kreditérték
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
Budapest, június 15. Dr. Hornyánszky Gábor egyetemi docens
 SZERVES KÉMIA BIOMÉRNÖKÖKNEK B.Sc. képzés, kód: BMEVESZA204 Tantárgy követelményei 2016/2017 tanév I. félév A tárgy heti előadásból és 2 óra tantermi gyakorlatból áll. A tárgy szóbeli vizsgával zárul.
SZERVES KÉMIA BIOMÉRNÖKÖKNEK B.Sc. képzés, kód: BMEVESZA204 Tantárgy követelményei 2016/2017 tanév I. félév A tárgy heti előadásból és 2 óra tantermi gyakorlatból áll. A tárgy szóbeli vizsgával zárul.
SZERVES KÉMIA biomérnököknek B.Sc. képzés, kód: BMEVESZA204 Tantárgy követelményei 2017/2018 tanév II. félév
 SZERVES KÉMIA biomérnököknek B.Sc. képzés, kód: BMEVESZA204 Tantárgy követelményei 2017/2018 tanév II. félév A tárgy heti előadásból és 2 óra tantermi gyakorlatból áll. A tárgy szóbeli vizsgával zárul.
SZERVES KÉMIA biomérnököknek B.Sc. képzés, kód: BMEVESZA204 Tantárgy követelményei 2017/2018 tanév II. félév A tárgy heti előadásból és 2 óra tantermi gyakorlatból áll. A tárgy szóbeli vizsgával zárul.
SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Tantárgy követelményei 2018/2019tanév II. félév
 SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Tantárgy követelményei 2018/2019tanév II. félév Az alaptárgy heti 3 óra előadásból és heti tantermi gyakorlatból áll. A tárgy szóbeli vizsgával zárul. A
SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Tantárgy követelményei 2018/2019tanév II. félév Az alaptárgy heti 3 óra előadásból és heti tantermi gyakorlatból áll. A tárgy szóbeli vizsgával zárul. A
III. Telítetlen szénhidrogének (alkének, alkinek)
 III. Telítetlen szénhidrogének (alkének, alkinek) Szerkezeti szempontból legjellegzetesebb sajátságuk az, hogy a molekula egy vagy több szénatompárja kettős (σπ, alkének), vagy hármas (σ2π, alkinek) kötéssel
III. Telítetlen szénhidrogének (alkének, alkinek) Szerkezeti szempontból legjellegzetesebb sajátságuk az, hogy a molekula egy vagy több szénatompárja kettős (σπ, alkének), vagy hármas (σ2π, alkinek) kötéssel
Kémiai kötések. Kémiai kötések. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Tantárgy követelményei 2016/2017tanév II. félév
 SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Tantárgy követelményei 2016/2017tanév II. félév Az alaptárgy heti 3 óra előadásból és heti tantermi gyakorlatból áll. A tárgy szóbeli vizsgával zárul. A
SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Tantárgy követelményei 2016/2017tanév II. félév Az alaptárgy heti 3 óra előadásból és heti tantermi gyakorlatból áll. A tárgy szóbeli vizsgával zárul. A
Budapest, szeptember 6. Dr. Huszthy Péter egyetemi tanár
 SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESKA202 és BMEVESZA301 Válogatott fejezetek a szerves kémiából I., kód: BMEVESKA002 Tantárgy követelményei 2016/2017 tanév I. félév Az alaptárgy heti 3 óra előadásból
SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESKA202 és BMEVESZA301 Válogatott fejezetek a szerves kémiából I., kód: BMEVESKA002 Tantárgy követelményei 2016/2017 tanév I. félév Az alaptárgy heti 3 óra előadásból
H H 2. ábra: A diazometán kötésszerkezete σ-kötések: fekete; π z -kötés: kék, π y -kötés: piros sp-hibrid magányos elektronpár: rózsaszín
 3. DIAZ- ÉS DIAZÓIUMSPRTT TARTALMAZÓ VEGYÜLETEK 3.1. A diazometán A diazometán ( 2 2 ) egy erősen mérgező (rákkeltő), robbanékony gázhalmazállapotú anyag. 1. ábra: A diazometán határszerkezetei A diazometán
3. DIAZ- ÉS DIAZÓIUMSPRTT TARTALMAZÓ VEGYÜLETEK 3.1. A diazometán A diazometán ( 2 2 ) egy erősen mérgező (rákkeltő), robbanékony gázhalmazállapotú anyag. 1. ábra: A diazometán határszerkezetei A diazometán
8. HETEROCIKLUSOS VEGYÜLETEK
 8. ETERIKLU VEGYÜLETEK 8.1. A heterociklusos vegyületek csoportosítása és elnevezése eterociklusos vegyületeknek nevezzük azokat a gyűrűs vegyületeket, amelyek gyűrűjében az egy vagy több szénatom mellett
8. ETERIKLU VEGYÜLETEK 8.1. A heterociklusos vegyületek csoportosítása és elnevezése eterociklusos vegyületeknek nevezzük azokat a gyűrűs vegyületeket, amelyek gyűrűjében az egy vagy több szénatom mellett
Eredményes vizsga esetén a tárggyal 5 kreditpont szerezhető. A félév csak aláírással zárul, ha
 SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Válogatott fejezetek a szerves kémiából I., kód: BMEVESKA002 Tantárgy követelményei 2017/2018 tanév I. félév Az alaptárgy heti 3 óra előadásból és heti 2
SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Válogatott fejezetek a szerves kémiából I., kód: BMEVESKA002 Tantárgy követelményei 2017/2018 tanév I. félév Az alaptárgy heti 3 óra előadásból és heti 2
SZERVES KÉMIAI TECHNOLÓGIÁK
 SZERVES KÉMIAI TECHNOLÓGIÁK ANYAGMÉRNÖK BSC, MSC KÉPZÉS VEGYIPARI TECHNOLÓGIA SZAKIRÁNY TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŰSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI INTÉZET Miskolc, 2013/2014 Tartalomjegyzék
SZERVES KÉMIAI TECHNOLÓGIÁK ANYAGMÉRNÖK BSC, MSC KÉPZÉS VEGYIPARI TECHNOLÓGIA SZAKIRÁNY TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŰSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI INTÉZET Miskolc, 2013/2014 Tartalomjegyzék
Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS
 Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS Milyen képlet adódik a következő atomok kapcsolódásából? Fe - Fe H - O P - H O - O Na O Al - O Ca - S Cl - Cl C - O Ne N - N C - H Li - Br Pb - Pb N
Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS Milyen képlet adódik a következő atomok kapcsolódásából? Fe - Fe H - O P - H O - O Na O Al - O Ca - S Cl - Cl C - O Ne N - N C - H Li - Br Pb - Pb N
Eredményes vizsga esetén a tárggyal 5 kreditpont szerezhető. A félév csak aláírással zárul, ha
 SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Válogatott fejezetek a szerves kémiából I., kód: BMEVESKA002 Tantárgy követelményei 2018/2019 tanév I. félév Az alaptárgy heti 3 óra előadásból és heti 2
SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Válogatott fejezetek a szerves kémiából I., kód: BMEVESKA002 Tantárgy követelményei 2018/2019 tanév I. félév Az alaptárgy heti 3 óra előadásból és heti 2
Tartalom. Szénhidrogének... 1
 Tartalom Szénhidrogének... 1 Alkánok (Parafinok)... 1 A gyökök megnevezése... 2 Az elágazó szénláncú alkánok megnevezése... 2 Az alkánok izomériája... 3 Előállítás... 3 1) Szerves magnéziumvegyületekből...
Tartalom Szénhidrogének... 1 Alkánok (Parafinok)... 1 A gyökök megnevezése... 2 Az elágazó szénláncú alkánok megnevezése... 2 Az alkánok izomériája... 3 Előállítás... 3 1) Szerves magnéziumvegyületekből...
Tartalmi követelmények kémia tantárgyból az érettségin K Ö Z É P S Z I N T
 1. Általános kémia Atomok és a belőlük származtatható ionok Molekulák és összetett ionok Halmazok A kémiai reakciók A kémiai reakciók jelölése Termokémia Reakciókinetika Kémiai egyensúly Reakciótípusok
1. Általános kémia Atomok és a belőlük származtatható ionok Molekulák és összetett ionok Halmazok A kémiai reakciók A kémiai reakciók jelölése Termokémia Reakciókinetika Kémiai egyensúly Reakciótípusok
