Tartalomjegyzék FOCUS MEDICINAE
|
|
|
- Sarolta Biró
- 8 évvel ezelőtt
- Látták:
Átírás
1 FOCUS MEDICINAE Felelõs szerkesztõ: Dr. Szolnoky Miklós Fõszerkesztõ: Dr. Karabélyos Csaba Szerkesztõbizottság: Dr. Bencsik Krisztina Prof. Czirják László Dr. Futó Judit Prof. Horváth Örs Péter Dr. Kalmár Ágnes Dr. Mátrai Zoltán Dr. Nemes László Dr. Paál Mária Dr. Pál Katalin Prof. Zeher Margit Szerkesztõbizottság tanácsadó testülete: Prof. Fekete György Prof. Kiss Attila Dr. Kiss István Prof. Komoly Sámuel Prof. Lipták József Prof. Mándi Yvette Prof. Maródi László Prof. Medgyesi György Dr. Mészner Zsófia Dr. M. Tóth Antal Dr. Nagy Kálmán Prof. Pálóczi Katalin Prof. Perner Ferenc Prof. Pénzes István Prof. Péter Ferenc Prof. Romics Imre Prof. Rozgonyi Ferenc Prof. Sas Géza Prof. Schuler Dezsõ Dr. Siklós Pál Prof. Szegedi Gyula Dr. Szita János Prof. Tekeres Miklós Prof. Tímár László Dr. Trestyánszky Zoltán Prof. Tulassay Tivadar Alapító: Biotest Hungaria Kft. Kiadja és a nyomdai munkáért felelõs: Dursusz Bt. Szerkesztõség és levelezési cím: 2045 Törökbálint, Torbágy u. 15/A ISSN: Megjelenik: évente négyszer Elõfizetési díj: évre 2010,- Ft + 5% áfa Tartalomjegyzék Focus Medicinae Bevezetés 2 /Introduction/ Prof. Maródi László Autoinflammációs szindrómák visszatérõ lázszindrómák 3 /Autoinflammatory syndromes recurrent fever syndromes/ Dr. Erdõs Melinda, Prof. Maródi László Autoimmun betegségek és infekciók 17 /Autoimmune diseases and infections/ Prof. Zeher Margit Az atópiás betegségek és a fertõzések kapcsolata 23 /Correlation between atopic diseases and infections/ Prof. Szegedi Andrea Fertõzések immunglobulin hiányállapotokban 28 /Infections in immunoglobuline-deficiency status/ Dr. Dérfalvi Beáta Fertõzések a komplementrendszer defektusaiban 31 /Infections in complement deficiencies/ Dr. Szolnoky Miklós Infekciók krónikus granulomatosisban 36 /Infections in chronic granulomatous disease/ Dr. Mészner Zsófia, Dr. Kalocsai Krisztina Védõoltások immunhiányos állapotban 42 /Immunisations in immunodeficiencies/ Dr. Kulcsár Andrea Gondolatok az A/H1N1 vírusfertõzésrõl 45 /Thoughts about the A/H1N1 virus infection/ Prof. Szegedi Gyula 1
2 FOCUS MEDICINAE Interdiszciplináris tudományos folyóirat Focus Medicinae Tisztelt Olvasó! A FOCUS MEDICINAE megújult külsõvel köszönti 12. évfolyamát, melynek idei elsõ száma a fertõzés és immunitás témakörével foglalkozik. A bevezetõ közlemény a hazai orvosi irodalomból kevéssé ismert lázszindrómák immunpatológiájáról, molekuláris genetikai hátterérõl és azok kezelésének lehetõségeirõl szól (Dr. Erdõs Melinda és Prof. Maródi László). A fejezetben részletesen kitérünk a klinikusok számára nem mindennapi kihívást jelentõ elkülönítõ diagnosztikára, hiszen az idetartozó betegségek száma meghaladja a 20-at. A lázszindrómák ismerete a fölösleges és költséges labordiagnosztikai vizsgálatok és antibiotikum terápia elkerülése miatt is különösen fontos. A fertõzések, mint az autoimmun betegségek lehetséges okai és gyakori következményei szemléletileg és a gyógyító munka szempontjából egyaránt fontosak (Prof. Zeher Margit). A közelmúlt kutatásai nyomán több autoimmun betegség hátterében vált ismertté az immunrendszer intrinsic, veleszületett zavara, ami önmagában is hajlamosít fertõzésekre, de a jelenleg alkalmazott gyógyszerek (szteroidok, immunszuppresszív szerek, monoklonális antitestek) a szervezetben jutó mikroorganizmusok gyors felismerését és eliminálását tovább csökkentik. Az allergiás betegségek fertõzésekkel való összefüggését tárgyaló fejezet ismerteti a csak részben tisztázott mechanizmusú atópia kialakulását befolyásoló biológiai és környezeti tényezõket, a fejlõdés korai szakaszában bekövetkezõ fertõzések (pl. RSV infekció) lehetséges patogenetikai szerepét, és az allergia kialakulásában egyfajta dogmává vált higiénés hipotézis változását (Prof. Szegedi Andrea). A primer immundefektusok vezetõ klinikai manifesztációi a fertõzések. Az ide tartozó több mint kétszáz betegség kb. 60%-a az antitestképzés zavarával összefüggõ hiányállapot; a jellemzõ fertõzések etiológiáját, azok megelõzésének és kezelésének lehetõségét külön fejezet tárgyalja (Dr. Dérfalvi Beáta). A komplement rendszer defektusai a primer immunhiányoknak csak mintegy 4%-át alkotják. Az ebbe a csoportba tartozó kórképek is erõsen aluldiagnosztizáltak, becslések szerint a betegeknek csak kb. 10%-a ismert (Dr. Szolnoky Miklós). A természetes immunitás primer defektusainak egyik prototípusa a krónikus granulomás betegség, amelyben a fagocytasejtek baktériumölõ funkciója a toxikus oxigén gyökök termelésének zavarára vezethetõ vissza (Dr. Mészner Zsófia és Dr. Kalocsai Krisztina). A betegségre jellemzõ bakteriális és gombás fertõzések spektrumát, azok diagnosztikáját és kezelését tárgyaló fejezetben a szerzõk tanulságos eseteket is bemutatnak. Az infekciós immunológiai gyakorlat mindennapi problémája a sérült immunitású betege immunizációja (Dr. Kulcsár Andrea). Ennél fogva a védõoltási szakrendeléseket gyakran keresik fel az érintett betegegek és szüleik. Az immunhiányos betegek védõoltására vonatkozóan csak néhány, inkább elméletben használható általános szabály van. A klinikai gyakorlatban a védõoltások elhagyása, elhalasztása, vagy az elmaradt oltások pótlása csak egyedileg véleményezhetõ és alapos immunológiai, infektológiai és epidemiológiai jártasságot igényel. A hivatalból kijelölt és nem szakmai kompetencia alapján megbízott védõoltási tanácsadó munkájával kapcsolatban gyakran észlelhetõk hiányosságok, ezért fontos, hogy a betegek az infektológiában és az immunológiában egyaránt jártas szakorvoshoz forduljanak tanácsért. Végezetül, külön fejezet foglalkozik a H1N1 pandémia néhány elméleti és gyakorlati kérdésével, az ezzel kapcsolatos hitekkel és tévhitekkel, külön kitérve az influenza-oltás és az immunhiányos betegségek immunológiai vonatkozásaira (Prof. Szegedi Gyula). A szerzõk nevében is megköszönöm, hogy a FOCUS MEDICINAE szerkesztõsége külön számot szentelt a fenti, infektológusok, immunológusok, rheumatológusok, háziorvosok, gyermekgyógyászok és belgyógyászok számára egyaránt hasznos információt nyújtó publikációk megírására. Prof. Maródi László 2
3 Autoinflammációs szindrómák visszatérõ lázszindrómák Dr. Erdõs Melinda, Prof. Maródi László Debreceni Egyetem Orvos- és Egészségtudományi Centrum Infektológiai és Gyermekimmunológiai Tanszék, Debrecen Autoinflammációs szindrómák visszatérõ lázszindrómák Összefoglalás: Az autoinflammációs szindrómára rendszerint már gyermekkorban kezdõdõ és egész életen át tartó, visszatérõen, krízisszerûen jelentkezõ, látszólag ok nélküli szisztémás gyulladással és többnyire lázzal kísért epizódok és tünetmentes idõszakok váltakozása jellemzõ. Bár az esetek többségében az elsõ tünet már tíz éves kor elõtt jelentkezik, a betegséget sok esetben csak felnõttkorban ismerik fel. Fontos, hogy a láz nem minden autoinflammációs szindrómának obligát tünete és a betegség serdülõ- illetve fiatal felnõttkorban is manifesztálódhat. A szisztémás gyulladás elsõsorban a bõr, a csontízületi rendszer, a szem, a gastrointestinalis traktus és a központi idegrendszer érintettségében nyilvánul meg. A fejezetben általános megállapításokat követõen a leggyakoribb lázszindrómákat mutatjuk be, különös hangsúlyt fektetve az elkülönítõ diagnosztika nehézségeire. Kulcsszavak: láz, autoinflammációs szindróma, lázszindróma Summary: Autoinflammatory syndromes are characterized by recurrent episodes of fever, that do not appear to have an etiologic background nor do they present with systemic manifestations. The fever episodes are intervened by symptomfree periods. The first symptoms usually present in childhood, however diagnosis is often made in adulthood. Fever is not an essential sign of these syndromes. Systemic inflammation usually affects the skin, joints, eyes, gastrointestinal tract and the central nervous system. In this chapter we describe the most common fever syndromes, with special emphasis on the differential-diagnosis. Key words: fever, autoinflammatory syndromes, fever syndromes Rövidítések ASC BS BS CAPS CARD CC CD CIAS CINCA CoA CRMO CRP DIRA EOS ER FAIS apoptosis-asszociált CARD domén tartalmú foltszerû protein (Apoptosisassociated Speck-like protein with a CARD domain) Behçet szindróma (Behçet Syndrome) Blau-szindróma (Blau Syndrome) cryopyrin-asszociált szindróma (Cryopyrin-Associated Periodic Syndromes) caspase-toborzó domén (CAspase Recruitment Domain) coiled coil Crohn-betegség (Crohn Disease) hideg-indukált autoinflammációs szindróma (Cold-Induced Autoinflammatory Syndrome) krónikus infantilis neurológiai-bõr-ízületi betegség (Chronic Infantile Neurological Cutaneous Articular) koenzim A krónikus multifocalis osteomyelitis (ChRonic Multifocal Osteomyelitis) C reaktív protein interleukin-1-receptor antagonista deficiencia (Deficiency of Interleukin-1- Receptor Antagonist) korai kezdetû sarcoidosis (Early Onset Sarcoidosis) endoplazmás retikulum familiáris autoinflammációs szindróma (Familiar AutoInflammatory Syndrome) FCAS FCU FGA FMF FUO HIDS HMG-CoA IL IL-1Ra JIA LRR MA MEFV MK MKD MS MVK MWS NALP familiáris hideg autoinflammációs szindróma (Familiar Cold Autoinflammatory Syndrome) familiáris hideg urticaria (Familiar Cold Urticaria) familiáris granulomatosus arthritis (Familiar Granulomatous Arthritis) familiáris mediterrán láz (Familiar Mediterranean Fever) ismeretlen eredetû láz (Fever of Unknown Origin) hyper-igd szindróma (Hyper-IgD Syndrome) 3-hidroxi-3-metilglutaril-CoA interleukin IL-1-Receptor-antagonista juvenilis idiopathiás arthritis (Juvenile Idiopathic Arthritis) leucinban gazdag ismétlõdés (Leucin Rich Repeat) mevalonát aciduria (Mevalonic Aciduria) mediterrán láz (MEditerranean FeVer) mevalonát-kináz (Mevalonate Kinase) MK deficiencia (MK Deficiency) Majeed-szindróma (Majeed Syndrome) mevalonát-kináz gén Muckle Wells szindróma (Muckle Wells Syndrome) NACHT domén, leucinben gazdag ismétlõdések, PYD domén tartalmú fehérje (NACHT domain, Leucine rich repeat- and PYD-containing protein) 3
4 NOD-LRR NF-κB NSAID NOMID PAMP PAPA PFAPA PG PYD SAA SD So-JIA SS stnfr TNF nukleotid-kötõ oligomerizációs doménleucinben gazdag ismétlõdések (Nucleotide-binding Oligomerization Domain-Leucine Rich Repeat) nukleáris faktor κb (Nuclear Factor κb) nem szteroid gyulladáscsökkentõ szer (Non-Steroid AntiInflammatory Drug) újszülöttkorban kezdõdõ multiszisztémás gyulladásos betegség (Neonatal Onset Multisystem Inflammatory Disorder) patogén-asszociált molekuláris mintázat (Pathogen-Associated Molecular Pattern) pyogen steril arthritis, pyoderma gangrenosum és acne (syndrome of Pyogenic Arthritis, Pyoderma gangrenosum and Acne) periodikus láz, adenitis, pharyngitis és apthosus stomatitis (Periodic Fever, Adenitis, Pharyngitis and Aphthous stomatitis) prosztaglandin pyrin domén (PYrin Domain) szérum amyloid A Still betegség (Still Disease) szisztémás kezdetû juvenilis idiopathiás arthritis (Systemic-Onset Juvenile Idiopathic Arthritis) Schnitzler-szindróma (Schnitzler Syndrome) szolúbilis TNFR (Soluble TNFR) tumor nekrózis faktor (Tumor Necrosis Factor) TNF Receptor TNFR TNFRSF1A TNFR szupercsalád 1A (TNFR SuperFamily 1A) TRAPS TNF-receptor-asszociált periodikus szindróma (TNF-Receptor-Associated Periodic Syndrome) XLP Bevezetés X-kromoszómához kötött lymphoproliferatív betegség (X-linked LymphoProliferative disorder) Autoinflammációs szindrómák visszatérõ lázszindrómák A láz az egyik leggyakoribb tünet, amellyel a gyakorló orvos találkozik. A lázas állapot rendszerint rövid ideig tart, a kiváltó ok többnyire akut fertõzés és a kórismézés nem okoz nehézséget. Elõfordul azonban, hogy a láz kiváltó oka a hosszadalmas kivizsgálás ellenére rejtve marad. Különösen igaz ez akkor, ha a láz infekcióra utaló tünetek nélkül, visszatérõen, tünetmentes epizódokkal váltakozva jelentkezik. Ilyen esetekben merül fel a láz háttérében a ritka, örökletes betegségcsoport az ún. familiáris autoinflammációs szindróma (FAIS) valamelyik típusának lehetõsége. A gyulladásos epizódot rendszerint prodromális tünetek, leggyakrabban fejfájás, fáradékonyság és rossz közérzet vezetik be. A lázas periódusban az akutfázisfehérjék (C reaktív protein /CRP/, szérum amyloid A /SAA/) szérum koncentrációjának kifejezett emelkedése és a vérsejtsüllyedés gyorsulása mellett szisztémás gyulladásra utaló polyserositis, arthritis, hasmenés, bõrés szemtünetek észlelhetõk, amelyek hátterében infekció, malignitás vagy autoimmun folyamat egyértelmûen kizárható, autoantitest- illetve autoreaktív T-sejtképzõdés nem mutatható ki. A progresszió nélküli, hosszú kórlefolyás malignitás illetve infekció ellen szól. A tünetmentes idõszakban a CINCA/NOMID (chronic infantile neurological cutaneous articular/neonatal onset multisystem inflammatory disorder) szindrómától eltekintve a gyermekek teljesen egészségesnek tûnnek, de a gyulladásos paraméterek ekkor is pozitívak lehetnek, amely arra utal, hogy a gyulladásos kaszkád aktivációja nem minden esetben elég nagymértékû ahhoz, hogy észrevehetõ tünetekben manifesztálódjon. Az éveken át visszatérõ gyulladásos epizódok szövõdményeként a betegség típusától függõen látás- és hallászavar, ízületi destrukció, vasculitis, illetve elsõsorban a veséket érintõ amyloidosis alakulhat ki. Az amyloidosis veszélye miatt, amely különösen familiaris mediterrán láz (FMF) esetében fenyeget, a rendszeres vizelet ellenõrzés nélkülözhetetlen! A szérum SAA szint megfelelõ prediktív marker az amyloidosis kialakulásának nyomonkövetésére. A negatív családi anamnézis nem zárja ki lázszindróma lehetõségét, hiszen recesszíven öröklõdõ kórképek és sporadikus esetek is ismertek, és a penetrancia sem 100%-os. A hyper-igd szindróma (HIDS) kivételével mérsékelt férfi dominancia észlelhetõ. Az alábbiakban az autoinflammációs szindrómák leggyakoribb típusainak klinikumát, patomechanizmusát, genetikai hátterét és elkülönítõ diagnosztikáját, valamint a terápia lehetõségeit mutatjuk be. A szöveg egészében a szindrómák nemzetközi irodalomban elterjedt angol rövidítéseit használjuk. Történeti áttekintés klasszifikáció Az elsõ leírás, amelyben periodikusan visszatérõ lázzal járó betegségrõl (eredeti néven: periodic disease ) tesznek említést Heberdentõl származik, aki 1802-ben egy visszatérõ hasi, mellkasi és végtagi fájdalomban szenvedõ betegrõl számolt be (11). A múlt században egyre több periodikus lázzal járó szindróma pontos klinikai leírására került sor, majd 1997 és 2002 között szinte valamennyi nagyobb szindróma molekuláris genetikai háttere tisztázódott. Ez a fejlõdés új terápiás perspektívákat nyitott, így a mediterrán lázban hatásos colchicin és a HIDS-ben alkalmazott simvastatin helyett, illetve mellett egyre inkább elõtérbe kerültek a biológiai terápiás szerek, mint pl. az etanercept és az anakinra. A FAIS elnevezés McDermott és munkatársai nevéhez fûzõdik, akik 1999-ben genetikailag meghatározott, új gyulladásos betegségcsoportot ismertek fel (25). Korábban a herediter periodikus lázszindróma elnevezést használták, amely tévesen azt a látszatot keltette, hogy ezekre a kórképekre szabályos idõközönként ismétlõdõ lázas epizódok jellemzõk. Késõbb, a félrevezetõ név helyett a herediter visszatérõ lázszindróma elnevezés terjedt el, utalva arra, hogy FAIS-ban a lázas epi- 4
5 Autoinflammációs szindrómák visszatérõ lázszindrómák I. Öröklõdõ visszatérõ lázszindrómák: 1. Familiáris mediterrán láz (Familiar Mediterranean Fever, FMF) 2. Tumor nekrózis faktor receptor-asszociált periodikus szindróma (TNF-Receptor-Associated Periodic Syndrome, TRAPS) 3. Mevalonát-kináz deficiencia (Mevalonate Kinase Deficiency, MKD) A) Hyper-IgD szindróma (Hyper-IgD Syndrome, HIDS) B) Mevalonát aciduria (Mevalonic Aciduria, MA) 4. Cryopyrin-asszociált periodikus lázszindróma /Cryopyrinopathiák/ (Cryopyrin-Associated Periodic Syndromes /Cryopyrinopathies/, CAPS) A) Familiáris hideg urticaria/familiáris hideg autoinflammációs szindróma (Familial Cold Urticaria, FCU/Familiar Cold Autoinflammatory Syndrome, FCAS) B) Muckle Wells szindróma (Muckle Wells Syndrome, MWS) C) Krónikus infantilis neurológiai-bõr-ízületi betegség/újszülöttkorban kezdõdõ multiszisztémás gyulladásos betegség (Chronic Infantile Neurological Cutaneous Articular, CINCA/Neonatal Onset Multisystem Inflammatory Disorder, NOMID) 5. NAPS12 deficiencia II. Idiopathiás lázszindrómák: 1. Periodikus láz, adenitis, pharyngitis és aphthosus stomatitis (Periodic Fever, Adenitis, Pharyngitis and Aphthous Stomatitis, PFAPA) 2. Juvenilis idiopathiás arthritis (Juvenile Idiopathic Arthritis, JIA) 3. Behçet szindróma (Behçet Syndrome, BS) 4. Schnitzler-szindróma (Schnitzler Syndrome, SS) 5. Still betegség (Still Disease, SD) 6. Köszvény (Gout) III. Immunmediált granulómás betegségek: 1. Blau-szindróma/Korai kezdetû sarcoidosis (Blau Syndrome, BS/Early Onset Sarcoidosis, EOS) 2. Familiáris granulomatosus arthritis (Familiar Granulomatous Arthritis, FGA) 3. Crohn-betegség (Crohn Disease, CD) IV. Pyogen megbetegedések: 1. Pyogen steril arthritis, pyoderma gangrenosum acne (Pyogenic Sterile Arthritis, Pyoderma Gangrenosum, PAPA) 2. Familiaris visszatérõ arthritis (Familiar Recurrent Arthritis, FRA) 3. Krónikus multifocalis osteomyelitis (ChRonic Multifocal Osteomyelitis, CRMO) 4. Majeed-szindróma (Majeed Syndrome, MS) 5. Interleukin-1-receptor antagonista deficiencia (Deficiency of Interleukin-1-Receptor Antagonist, DIRA) 1. táblázat: Familiáris autoinflammációs szindrómák zódok ismétlõdésében szabályos ciklusosság nem fedezhetõ fel (22,32). Az autoinflammációs szindrómák kezdetben csak a visszatérõ lázszindrómákat foglalták magukba, napjainkra azonban a FAIS köre jelentõsen kibõvült és jelenleg négy nagy betegségcsoportot illetve konkrét szindrómákat sorolunk ide (1. táblázat). Ritkaságuk és a hasonló, gyakran átfedõ klinikai tünetek miatt az autoinflammációs szindrómák elkülönítõ diagnosztikája nem könnyû feladat (2. táblázat). A génszintû diagnosztika nyújtotta lehetõségekkel az egyes kórképek jobban elkülöníthetõk, de sok esetben az egyértelmû klinikai kép ellenére a megfelelõ génen mutáció nem mutatható ki. Ilyenkor a vizsgálni kívánt gén kiválasztásában a klinikai tünetek helyes értékelésének van óriási jelentõsége. Az elkülönítésben leginkább az életkori kezdet, a lázas epizódok idõtartama és gyakorisága, a földrajzi eloszlás és az ún. egyedi, általában csak az adott szindrómában észlelhetõ tünetek ismerete nyújthat vezérfonalat (2. táblázat). Patomechanizmus Az IL-1β és az inflammasoma rendszer Az autoinflammációs folyamat kialakulása, szemben a klasszikus autoimmun kórképekkel, nem az adaptív, hanem elsõsorban a veleszületett immunitás zavarával magyarázható, így a FAIS különbözõ formáiban a gyulladásos válaszreakció fenntartásában, a citokintermelésben és az apoptosisban szerepet játszó molekulákat kódoló gének defektusa mutatható ki. A veleszületett immunitás zavara miatt az immunrendszer minor stimulusokra is túlzottan reagál és a kialakuló gyulladásos válaszreakció lecsengése elhúzódó. Az autoinflammációs szindróma elnevezés is erre, a szervezet saját biológiai adottságából fakadó, látszólag provokáció nélküli gyulladására utal. A mediterrán láz és a NOMID szindróma esetében a típusos klinikai kép ellenére csak a betegek 50-60%-ában mutatható ki mutáció a betegségi génen, a többi szindrómát is figyelembe véve pedig a diagnosztikus arány még rosszabb, mindösszesen 35 % (2). Ezek az adatok is mutatják, hogy ma még nem ismerjük az összes autoinflammációs szindrómát és az érintett gének spektruma sem teljes. Az autoinflammációs szindrómák egyik mediátora az IL-1β, amelynek nemcsak a láz kialakulásában, hanem a leukocyták extravasatiojában, a csontreszorpcióban és az endothelsejtek felszínén az adhéziós molekulák expressziójában is szerepe van. Az IL-1β 33 kda molekulasúlyú inaktív prekurzor protein formában (pro- IL-1β) szintetizálódik, és IL-1β konvertáló enzim hasítására 17 kda molekulasúlyú érett citokin molekulaként válik aktívvá (1. ábra). Az NH 2 -terminalis részükön NOD-LRR (Nucleotide-binding Oligomerization Domain- Leucine Rich Repeat) konfigurációt mutató NOD-LRR 5
6 Autoinflammációs szindrómák visszatérõ lázszindrómák FMF TRAPS MKD CAPS HIDS MA FCU/FCAS MWS CINCA/NOMID Általános jellemzõk Öröklõdésmenet AR AD AR AD Gén MEFV TNFRSF1A MVK NLRP3 (CIAS1) Protein Pyrin TNFR1, TNFR Mevalonát-kináz (MK) Cryopyrin (NALP3, PYPAF1) (marenostrin) p55 v. CD120a Génlokalizáció 16p p q24 1q44 Etnicitás Nem szefárd zsidó, Skót, ír Holland, Észak-Európa Nyugat-Európa örmény, arab, (Észak-Európa) francia olasz, török (Észak-Európa) Betegség kezdete <20 (<10: 25-60%) 3-20 <1 <1 <1 <20 <1 (életév) A lázas epizód 1-3 >14 (3-4 hét) ½ Folyamatos idõtartama (nap) (fellángolások) A lázas epizód Hetente x/év 3-8 hetente 1-2x/két- <1x/nap 1x/hó Folyamatos gyakorisága havonta, 1-2x/hó (Változó, havonta folyamatos (fellángolások) (ritkán évenként) hetente-évente) Lehetséges Infekció,? Vakcináció, Vakcináció Generalizált Generalizált? trigger faktor menstruáció, minimális hideghatás hideghatás fizikai vagy emo- trauma fáradtság, cionális stressz éhségérzet Tünettan Domináns tünet/ Hasi fájdalom, Migráló myalgia Generalizált Dysmorph Generalizált fájdalmas urticariform, manifesztáció arthritis és kiütés, lymphadeno- jelek, maculopapularis kiütés (a láz mellett) hasi fájdalom, pathia, neurológiai szemtünetek splenomegalia tünetek A differenciálást Erysipelas-szerû Migráló myalgia Cervicalis Dysmorph Hideg-indukált Sensoneuralis Krónikus segítõ tünet erythema, és exanthema, lymphadeno- jelek, epizódok, hallásvesztés asepticus orchitis, hosszú lázperiódus, pathia, aphta, neurológiai diurnalis meningitis, heretorsio conjunctivitis, splenomegalia, tünetek megjelenés sensoneuralis periorbitalis seigd-, hallásvesztés, oedema vakcináció, deformáló mint trigger arthropathia Érintett szervek, szervrendszerek Mozgásszervek Mono-, Súlyos migráló Arthralgia, Arthralgia, Arthralgia, Hasogató Deformáló, oligoarthritis (avt), myalgia, arthralgia, esetenként (poly)arthritis esetenként végtagi erosiv polyarthralgia, non-erosiv oligo- hypotonia, myalgia fájdalom, arthritis, myalgia, monoarthritis, (poly)arthritis myopathia arthralgia, epiphysealis myopathia monocytás fasciitis, arthritis, csontformatio epiphysealis myalgia kiszélesedés Gyomor- Fájdalom, Súlyos fájdalom, Súlyos hasi Hasi fájdalom, Nem jellemzõ, Hasi fájdalom Hepatobélrendszer székrekedés, székrekedés, fájdalom, diarrhoea, nausea megalia, splenomegalia diarrhoea, diarrhoea, hányás, elõfordulhat splenomegalia splenomegalia hányás, splenomegalia splenomegalia Légzõszervek Nem jellemzõ Nem jellemzõ Nem jellemzõ Nem jellemzõ Ritkán pleuritis Ritkán pleuritis Nem ízületi Steril peritonitis, Peritonitis, Pleuritis Nem jellemzõ Nem jellemzõ Arthritis, Erosiv serositis unilateralis pleuritis, pericar- ritkán pleuritis arthritis, pleuritis, scrotalis ditis, scrotalis ritkán duzzanat duzzanat pleuritis Idegrendszer Aszeptikus Vita tárgya Fejfájás Fejfájás, Fejfájás Perceptív Krónikus meningitis cerebellaris hallásvesztés, asepticus ataxia fejfájás meningitis, fejfájás emelkedett ICP, perceptív hallásvesztés 6
7 Autoinflammációs szindrómák visszatérõ lázszindrómák FMF TRAPS MKD CAPS HIDS MA FCU/FCAS MWS CINCA/NOMID Vérképzõrendszer Nem jellemzõ Anaemia, Emelkedett szérum IgD és Nem jellemzõ Anaemia Anaemia néhány betegben IgA szint csökkent solubilis (fiatal gyermekben nem) TNFR1 p55 szint Fejlõdés Bunkószerûen Normális Normális Növekedési Normális Normális Mentális és megvastagodott retardáció, növekedési ujjak mentális retardáció, retardáció, nyeregorr, dysmorph elõdomborodó jelek homlok, széles ujjak Bõr, Erysipelas-szerû Centrifugalisan Polymorph Polymorph Generalizált Generalizált Generalizált nyálkahártyák erythema migráló cellulitis- exanthema, exanthema, urtica urtica, urtica (lábszár, lábhát) szerû subcutan stomatitis stomatitis szájnyálkagyulladás, migráló aphtosa, aphtosa, hártya erythema, urtica- genitalis genitalis aphtosis, riform kiütés, ulcusok ulcusok genitalis fekély oedemás plakkok, periorbitalis oedema Vasculitis Henoch-Schönlein Henoch-Schönlein Bõr vasculitis, Nem jellemzõ Nem jellemzõ Ritka purpura, purpura, Henoch-Schönlein purpura polyarteritis lymphocytás nodosa vasculitis Szem Nem jellemzõ Conjunctivitis, Nem jellemzõ, Nem jellemzõ, Conjunctivitis Conjunctivitis, Papillaoedema, (ritkán uveitis, iritis, esetleg esetleg n. opticus látásvesztés, conjunctivitis) periorbitalis conjunctivitis conjunctivitis, elevatio, uveitis, oedema uveitis, episcleritis, conjunctivitis cataracta uveitis Nyirokcsomók Nem jellemzõ Nem jellemzõ, Generalizált, de Cervicalis Nem jellemzõ Ritkán Esetenként (ritka generalizált) ritkán fõleg cervicalis fájdalmas fájdalmas lymphadenolymphadeno- pathia pathia Amyloidosis 50-75% 10-25% Ritka (<10%) Nem ismert Ritka (<10%) ~25%-33% Ritka incidencia (precolchicine éra) (pontosan nem ismert) Terápia 1. választás Colchicin Kortikoszteroid?? Anakinra, Anakinra, Anakinra Rilonacept Rilonacept Egyéb IL-1 blokkoló Etanercept, Anakinra,? Canakinumab Canakinumab Canakinumab TNF inhibitor Anakinra TNF inhibitor, Simvastatin 2. táblázat: Örökletes visszatérõ lázszindrómák proteinek (pl. cryopyrinek) aktivációját követõen a citoszolban egy inflammasomának nevezett multiprotein komplex jön létre, amelynek aktiválódása IL-1β szekréciót eredményez (23) (1. ábra). Örökletes lázszindrómák 1) Familiáris mediterrán láz (FMF) A leggyakoribb autoinflammációs szindrómáról az elsõ esetközlések 1945-bõl és 1958-ból származnak (12,29). A betegség kb. 60%-ban férfiakat érint. A kór- kép elsõsorban a mediterrán övezetben fordul elõ, és különösen az örmény, az arab és a török populációban gyakori; ez utóbbira utal a kórkép másik elnevezése, a török vasculitis. Klinikai tünetek - Az elsõ lázas epizódok a betegek többségében 20 éves kor elõtt jelentkeznek, 25-60%-ban 10 éves kor elõtt, 10-20%-ban már 2 éves korban. A láz rendszerint 1-3 napig tart és általában spontán jelentkezik, de kiváltó tényezõ lehet infekció, menstruáció vagy emocionális stressz is. A tünetek hetente-3-4 havonta jelentkeznek, de a tünetmentes idõszak több évig is eltarthat. Az FMF legjellemzõbb klinikai tünete a hasi fáj- 7
8 Autoinflammációs szindrómák visszatérõ lázszindrómák 1. ábra: Az inflammasoma rendszer és a CAPS patomechanizmusa: autoinhibitor hurok hipotézis A pro-il-1β az IL-1β konvertáló enzim hasítására válik aktívvá. A NOD-LRR proteinek aktivációját követõen a citoszolban cryopyrin inflammasoma képzõdik, amelyben a felismerõ funkciót a NOD-LRR fehérje, az adaptor funkciót az ASC és a Cardinal fehérjék, az effektor funkciót caspase enzimek töltik be. A NOD a fehérjék közötti interakciókban, míg az LRR a különbözõ patogének PAMP mintázatának felismerésében fontos. Az ASC két doménbõl épül fel: a PYD hasonló domént tartalmazó fehérjékhez (pl. cryopyrin) kapcsolódik, a CARD domén pedig a caspase-okhoz való kötõdésben fontos. Az autoinhibitor hurok hipotézis szerint inaktív állapotban a cryopyrinek NOD és LRR doménjei egy autoinhibitor hatású hurokká kapcsolódnak, amely megakadályozza a további adapterek kötõdését. A NOD domént érintõ mutációk az inhibitor hatású hurokszerkezet kialakulását teszik lehetetlenné, emiatt a rendszer felpörög, amely túlzott mértékû IL-1β secretiót eredményez. Rövidítések: ASC: apoptosis-asszociált CARD domén tartalmú foltszerû protein (Apoptosis-associated Speck-like protein with a CARD domain); CARD: caspase-toborzó domén (CAspase Recruitment Domain); CAPS: cryopyrin-asszociált szindróma (Cryopyrin-Associated Periodic Syndromes); IL: interleukin; NOD-LRR: nukleotid-kötõ oligomerizációs domén-leucin gazdag ismétlõdések (Nucleotide-binding Oligomerization Domain-Leucine Rich Repeat); PAMP: patogén-asszociált molekuláris mintázat (Pathogen-Associated Molecular Pattern), PYD: pyrin domén (PYrin Domain) dalom, amely steril peritonitis következménye és adhesiók kialakulása révén a késõbbiekben sterilitáshoz vezethet. Az appendicitist utánzó hasi tünetek a feleslegesen végzett mûtéti beavatkozások veszélyét is magukban rejtik. Ritkábban más lokalizációjú serositisek (pleuritis, pericarditis) is elõfordulhatnak. Gyakori a splenomegalia, a nyirokcsomók duzzanata azonban nem jellemzõ. A végtagok distalis részén gyakori a fájdalmas erysipeloid erythema. A lázas epizódot gyakran kíséri alsó végtagi, a nagyízületeket érintõ, aszimmetrikus, nem destruktív, oligo- vagy monoarthritis és fizikai megterhelést követõen jelentkezõ izomfájdalom. Mediterrán lázban szemérintettség nincs. Ritkán fejfájás és aszeptikus meningitis is elõfordulhat (20). Nem kezelt esetekben a legsúlyosabb szövõdmény a veséket érintõ, subacut lefolyású amyloidosis, amely 2:1 arányban a férfiakat érinti. A pre-colchicine érában ez a szövõdmény kb %-ban volt észlelhetõ, átlagosan a tünetek indulása után 6,4 évvel (10). A betegség ritka szövõdménye az orchitis és a heretorzió. Az FMF diagnosztikus kritériumait 1997-ben Livneh és mtsai írták le (21). A fõ kritériumok között a serositisszel vagy synovitisszel kísért visszatérõ láz mellett, az amyloidosis és a colchicine terápiára mutatott klinikai javulás szerepel. A minor kritériumok között említik az erysipelas-szerû erythemát és az elsõfokú rokonok között elõforduló mediterrán lázat. Ennek a kritériumrendszernek megfelelõ és a mediterrán régióból származó beteg esetében a genetikai vizsgálatok az esetek kb. 60%-ban igazolnak mutációt a MEFV (Mediterranean fever) génen. Más területrõl származó betegek esetében ez az arány kb. 10% (8). 8
9 Autoinflammációs szindrómák visszatérõ lázszindrómák Laboratóriumi eltérések - A laboratóriumi vizsgálatok során a We gyorsult, az akutfázis-fehérjék (CRP, SAA, fibrinogén) szérumkoncentrációja emelkedett és leukocytosis mutatható ki, amelyek a tünetmentes idõszakban is perzisztálhatnak. A 0,5 g napi fehérjeürítést meghaladó proteinuria esetén fokozott a veséket érintõ amyloidosis veszélye. A betegek kb. 15%-ában emelkedett a szérum IgD szint, kb. 25%-ukban pedig a szérum IgA szint (28). Patomechanizmus - Az autoszomális recesszíven öröklõdõ kórkép hátterében a MEFV gén mutációja áll, amely a 16-os kromoszóma 16p13.3 régiójában található (9, 17). A mutációk többsége missense, amelyek hot spot régiója a 10. exonban van. A V726A és az M694V mutációk az ún. alapító mutációk, amelyek kb évvel ezelõtt élt õsben jöhettek létre a Közel-Keleten. A betegek kb %-ában a MEFV génen mutáció nem mutatható ki (2). A 10 exonból álló gén egy 781 aminosavból álló, elsõsorban a granulocytákban, monocytákban, eosinophilokban, a dentritikus sejtekben és a synovialis fibroblastokban kifejezõdõ pyrin vagy más néven marenostrin nevû fehérjét kódol, amely a DEATH (halál) domén fehérjecsaládhoz tartozik. A pyrin autoinflammációs folyamatban betöltött szerepével kapcsolatban két hipotézis is elfogadott. Az ún. szekvesztrációs hipotézis szerint a pyrin a cryopyrin inflammasoma felépítésében szerepet játszó fehérjék kompetitív kötése révén megakadályozza az inflammasoma kialakulását (6,7) (2.a ábra). Mutáns fehérje esetén ez a kompetitív kötés károsodik, amely kóros mértékû inflammasoma képzõdéshez és caspase-1-mediált IL-1β-aktivációhoz vezet. A pyrin inflammasoma hipotézis szerint a pyrin proinflammatorikus hatású és a cryopyrinhez hasonlóan képes inflammasoma kialakítására (38) (2.b ábra). Ebben az esetben a mutáns fehérje patogénfelismerõ képessége és kötése kórosan fokozó- 2.a ábra: A FMF patomechanizmusa Szekvesztrációs hipotézis. Fiziológiás állapotban a pyrin a PYD doménen keresztül ASC-vel és kaszpáz-1 enzimekkel kapcsolódik, amely kompetitív kötõdés révén gátolja ezen molekulák részvételét a cryopyrin inflammasoma kialakításában, így féken tartja az IL-1β aktivációt. A pyrint kódoló gén mutációja esetén a pyrin fehérje-fehérje interakciói károsodnak, így az ASC és a caspase-ok szabadon maradnak, amely fokozott inflammasoma képzõdéshez és IL-1β aktivációhoz vezet. Rövidítések: ASC: apoptosis-asszociált CARD domén tartalmú foltszerû protein (Apoptosis-associated Speck-like protein with a CARD domain); CARD: caspase-toborzó domén (CAspase Recruitment Domain); CC: coiled coil; FMF: Familiáris mediterrán láz (Familiar Mediterranean Fever); IL: interleukin; NOD-LRR: nukleotid-kötõ oligomerizációs domén-leucin gazdag ismétlõdések (Nucleotide-binding Oligomerization Domain-Leucine Rich Repeat); PAMP: patogén-asszociált molekuláris mintázat (Pathogen-Associated Molecular Pattern); PYD: pyrin domén (PYrin Domain) 9
10 Autoinflammációs szindrómák visszatérõ lázszindrómák 2) TNF receptor-asszociált periodikus szindróma (TRAPS) 2.b ábra: A FMF patomechanizmusa Pyrin inflammasoma hipotézis. A pyrin a cryopyrinhez hasonlóan ASC és caspase-1 fehérjével kapcsolódva képes inflammasoma kialakítására. Ebben az esetben a mutáns fehérje patogénfelismerõ képessége és kötése kórosan fokozódik, és ez vezet túlzott mértékû IL-1β felszabaduláshoz. dik, amely túlzott mértékû gyulladáshoz vezet (38). Ez az elképzelés magyarázatot adna a meditterán régióban az FMF mutációk tekintetében tapasztalt magas hordozó frekvenciára (1:3-1:6), hiszen a mutációt hordozókban a patogének egy bizonyos csoportjával szemben mutatott jobb immunválaszkészség pozitív szelekciós elõnyt jelent a mutációt nem hordozókkal szemben (33). Terápia - Az FMF kezelésében az elsõként választandó szer a colchicin, amelyet 20 kg alatt napi 0,5 mg, 20 kg felett 1,0 mg dózisban alkalmazunk, 2 mg napi maximális adagban. A colchicin terápia akkor is alkalmazandó, ha a lázas epizódok számában csökkenés nem észlelhetõ, mert az amyloidosis és az adhéziók kialakulásának megelõzésében nélkülözhetetlen! A terápia hatástalansága rendszerint a gastrointestinalis mellékhatások (nausea, diarrhea) miatti compliance hiányára vezethetõ vissza, a valódi colchicin rezisztencia ugyanis ritka, kb. 5-10%-ban fordul elõ. Arthritis esetén nemszteroid gyulladáscsökkentõkkel (NSAID) egészíthetjük ki a kezelést; a szteroid terápia hatástalan. A colchicin terápiát interferon-α kezeléssel is kombinálhatjuk, amellyel kapcsolatban változóak a tapasztalatok (4,35). A biológiai terápiás szerek közül több (infliximab, etanercept, illetve anakinra) eredményesen volt alkalmazható monoterápiában vagy colchicin terápiával kombinálva (5,27,39). A vasculitis okozta perzisztáló lázas myalgia szisztémás kortikoszteroid kezelésre jól reagál. A TRAPS a leggyakoribb autoszomális domináns lázszindróma. A kórképet 1982-ben egy népes ír-skót családban írták le, akikben a visszatérõ láz mellett myalgia és fájdalmas erythema volt észlelhetõ (37). Az FMF-tõl való elkülönítésben segít az autoszomális domináns öröklõdésmenet és a kortikoszteroid terápia hatásossága. Jelentõs földrajzi dominancia nem észlelhetõ. Klinikai tünetek - A betegség rendszerint 20 éves kor elõtt manifesztálódik, a lázszindrómák között egyedülállóan elhúzódó, 2-3 hetet is meghaladó, megszakítás nélküli lázas állapot formájában. A gyulladásos epizódok évente 2-6 alkalommal jelentkeznek. Jellegzetes a szemérintettség, amely a kifejezett periorbitalis oedema miatt a betegség legszembetûnõbb tünete lehet, de elõfordulhat conjunctivitis, uveitis és iritis is. A hosszú lázperiódusok és a periorbitalis oedema mellett a kórképre típusos a monocytás fasciitis miatt megjelenõ centrifugálisan migráló fájdalmas erythema, amelyhez myalgia is társulhat (16). A törzsön és a végtagokon mutatkozó bõrtünet streptococcus vagy staphylococcus bõrfertõzést utánozhat. Gyakori panasz a steril peritonitis okozta hasi fájdalom, amely a betegek 92%-ában észlelhetõ és nem egy esetben tévesen mûtéti beavatkozáshoz vezet. A hasi fájdalomhoz hasmenés vagy obstipatio, hányinger, hányás és fejfájás is társulhat. A pleuritis miatt mellkasi fájdalom és dyspnoe jelentkezhet. Az ízületi fájdalom elsõsorban a nagyízületeket (csípõ, térd, boka) érinti, az arthritis ritka. A tunica vaginalis testis gyulladása miatt fellépõ hereduzzanat epididymitist és heretorziót utánozhat. A betegek 2 / 3 -ában kell számítanunk amyloidosis kialakulására. Klinikailag a többi lázszindrómától való elkülönítést elsõsorban a prolongált lázperiódus, a conjunctivitis és a myalgia segíti. Laboratóriumi eltérések - A laboratóriumi vizsgálatok rendszerint neutrophiliát, thrombocytosist, anaemiát és mérsékelt komplement aktivációt mutatnak. Gyakori a polyclonalis immunglobulin szaporulat, amelyben különösen az IgA reprezentált, de IgD szaporulat is jelentkezhet. A gyulladásos paraméterek gyakran a tünetmentes periódusban is pozitívak. A differenciálást segítõ laboratóriumi eltérés a csökkent szolúbilis tumor nekrózis faktor receptor (TNFR) szint a szérumban. A koncentráció rendszerint 1 ng/ml alatti, bár lázas idõszakokban gyakran a normál tartományban mérhetõ. Furcsa paradoxon, hogy a veseérintettség kialakulásával a betegek állapota javulhat, mert csökken a szolúbilis TNFR kiválasztása, vagyis nõ a TNFR szérum koncentrációja, amely fokozza a TNFα kötést, így csökkenti a gyulladást. Patomechanizmus - Az autoszomális dominánsan öröklõdõ kórkép a TNFα1 sejtmembrán-receptor (TNFR1) mûködési zavarának következménye. A receptort a TNFRSF1A (TNF receptor superfamily 1A) gén kódolja a 12-es kromoszómán (12p13) (25). Nyugalmi állapotban a TNFR1 nagy része a Golgi apparátusban tárolódik, és csak kisszámú receptor expresszálódik a 10
11 sejtfelszínen (3.a ábra). A TNFα-kötõdését követõen a receptor trimerizálódik, amely NF-κB (nuclearis faktor κb) aktivációhoz vagy apoptosishoz vezet. Az NF-κBmediált útvonal gátolja a sejthalált, így a TNFR1 aktiváció a körülményektõl függõen különbözõ kimenetelû lehet. A receptor aktiváció rendszerint lázat, citokinek szekrécióját, leukocytaaktivációt és a receptort hasító proteáz enzim aktivációját eredményezi. A mutációk funkcionális következményeinek értelmezése vita tárgya, hiszen a csökkent sejtfelszíni expresszió és ligandkötés miatt a mutáns TNFR1 funkcionális következménye sokkal inkább anti-inflammatórikus hatásúnak tûnik, mert csökken a TNFα-indukált NF-κB aktiváció. Autoinflammációs szindrómák visszatérõ lázszindrómák Fontos azonban, hogy a mutáns receptor következtében a TNFα-indukált apoptosis is károsodik, amely az aktivált gyulladásos sejtek, elsõsorban neutrofilek prolongált túléléséhez vezet. A fenti ellentmondást is figyelembe véve jelenleg két hipotézis tûnik elfogadottnak. Az ún. shedding hipotézis az aktivált receptorok sejtfelszínrõl történõ leválására utal (3.b ábra). Fiziológiásan a receptoraktivációt követõen egy metalloproteináz enzim a transmembrán régióhoz közel lehasítja a receptor extracellularis részét, amely szolúbilis formában (stnfr1) a keringésbe jut. A szolúbilis forma képes TNFα-t kötni, amely megakadályozza, hogy a citokin az intakt sejtfel- 3. ábra: A TRAPS patomechanizmusa. A shedding hipotézis és a receptor aggregációs hipotézis. a) Nyugalmi állapotban a TNFR1 nagy része a Golgi apparátusban tárolódik, és csak kisszámú receptor expresszálódik a sejtfelszínen. A TNFR1- hez való kötõdését követõen a receptor trimerizálódik, amely NF-κB aktivációhoz vagy apoptózishoz vezet. A kötõdés a receptort extracellularis részét lehasító proteáz enzimet is aktiválja, amely szolúbilis formában (stnfr1) a keringésbe jut, így csökken a TNFα-jelátvitel és a gyulladásos reakció. b) Az shedding hipotézis szerint a mutáns sejtfelszíni receptorok hasítása elmarad, így a TNFα extracellularis semlegesítésének defektusa fokozza a TNFα-jelátvitelt és lázat, gyulladást provokál. c) A receptor aggregációs hipotézis szerint a mutáns receptorok az endoplazmatikus reticulumban és a citoplazmában halmozódnak fel, ahol aggregátumokat képeznek. Az aggregátum képzõdés csökkenti a receptor sejtfelszíni expresszióját és az NF-κB rendszeren keresztül az IL-1βindukcióhoz vezet. Rövidítések: ER: Endoplazmás retikulum; IL: interleukin; NF-κB: Nuclearis faktor κb (Nuclear Factor κb); TNF: Tumor nekrózis faktor (Tumor Necrosis Factor); TNFR: TNF Receptor; TRAPS: TNF-receptor-asszociált periodikus szindróma (TNF-Receptor-Associated Periodic Syndrome) 11
12 színi receptorokhoz kapcsolódjon. Az extracellularis TNFα megkötésével csökken a TNFα-jelátvitel és a gyulladásos reakció. Mutáns fehérje esetén a sejtfelszíni receptorok hasítása elmarad, amit a TRAPS-ban szenvedõ betegek csökkent stnfr1 plazmaszintje is jelez (3.b ábra). A TNFα extracellularis semlegesítésének defektusa fokozza a TNFα-jelátvitelt, amely a caspase-8 rendszeren keresztül apoptotikus hatású, az NF-κB aktiváción keresztül pedig lázat és gyulladást provokál. A másik ún. receptor aggregációs hipotézis szerint a gyulladás független a TNF-szignalizációs útvonaltól (3.c ábra). A mutáns receptor sejtfelszíni expressziója csökken és a receptorok az endoplazmás retikulumban és a citoplazmában halmozódnak fel, ahol egymással kapcsolódva IL-1β-képzõdést indukáló aggregátumokat képeznek. Ez a hipotézis magyarázatot szolgáltat arra a megfigyelésre is, hogy a TRAPS-ban szenvedõ betegek egy részében az IL-1β-blokkolók a terápiában sokkal hatékonyabbnak tûnnek, mint a TNF-blokkolók (30). Terápia - A kórképben hatásosak a rövid ideig alkalmazott nagydózisú kortikoszteroidok és a NSAID készítmények. Ha mellékhatásaik miatt ezek a szerek nem tolerálhatók, etanercept kezeléssel lehet próbálkozni, amely a betegek többségében csökkenti a lázfrekvenciát és az amyloidosisra nézve is kedvezõ hatású. Az etanercept a humán TNFR2 extracellularis ligandkötõ doménjébõl és a humán IgG1 Fc doménjébõl kialakított kiméra dimerizált terméke, amely képes a szolúbilis és a sejtfelszínhez kötött TNFα-val is kapcsolódni és gátolni annak biológiai hatását. Egy másik anti-tnf szer az infliximab hatástalannak bizonyult, sõt nem egy esetben a gyulladásos reakció kiújulásához vezetett (18). Etanercept rezisztens esetekben is látványos javulást eredményezhet a rekombináns humán IL-1-receptorantagonista (IL-1Ra) anakinra. Az anakinra gátolja az IL-1β IL-1R-hoz való kötõdését, proinflammatorikus hatását és megszünteti a gyulladást. Alkalmazása 1 mg/ ttkg dózisban subcutan inkekció formájában történik, amely szükség esetén 0,5 mg/ttkg dózissal emelhetõ. Fontos a rendszeres vizelet ellenõrzés, mert a proteinuria az amyloidosis elsõ jele lehet. 3) Mevalonát-kináz deficiencia (MKD) Autoinflammációs szindrómák visszatérõ lázszindrómák A HIDS és a mevalonát aciduria (MA) a mevalonsavürítés zavarával jellemezhetõ autoszomális recesszíven öröklõdõ kórképek. Valójában ugyanazon metabolikus útvonalat érintõ anyagcsere betegség két különbözõ súlyosságú formájáról van szó, amelyek hátterében a koleszterin szintézisben szerepet játszó mevalonátkináz (MVK) enzim defektusa áll (31). Az elsõként 1984-ben leírt autoszomális recesszív öröklõdésmenetû HIDS több szempontból is különleges a lázszindrómák között (36). A szindrómát a koleszterin bioszintézisben fontos szerepet játszó MVK enzim defektusa okozza, tehát úgy tûnik, hogy egy anyagcsere betegség manifesztálódik autoinflammációs tünetekben. Érdekes a kórkép abból a szempontból is, hogy máig nem ismert az emelkedett szérum IgD szint oka és összefüggése a klinikai tünetekkel. A mutációt hordozó aránya kb. 1:350 és a betegek több, mint 60%-a a holland és a francia populációban található. Klinikai tünetek HIDS esetében az elsõ tünetek rendszerint 2 éves kor elõtt jelentkeznek. Jellemzõ a 3-8 hetente visszatérõ, 3-7 napig tartó, 40 o C körüli láz, hidegrázás, izzadás, fejfájás, a gastrointestinalis panaszok (hányás, hasmenés, hasi fájdalom) valamint a többi autoinflammációs kórképtõl való elkülönítését segítõ splenomegalia, esetleg hepatomegalia és generalizált, különösen a nyaki, az axillaris és a hasi régiókat érintõ fájdalmas nyirokcsomó duzzanat. Emellett erythemás maculopapulosus, esetleg urticariform exanthema, nagyízületeket érintõ szimmetrikus oligoarticularis arthritis és arthralgia, illetve pleuritis is jelentkezhet, ritkán petechiák és purpurák is láthatók. A betegek kb. felében szájnyálkahártya, illetve genitalis fekély is kialakul. Provokáló tényezõ lehet vakcináció, stressz, sebészeti beavatkozás vagy trauma. A tünetmentes idõszak akár hónapokig, évekig is eltarthat, a gyakori fellángolások elsõsorban a gyermekkort és a fiatal felnõttkort jellemzik. Az MA sokkal inkább tûnik egy klasszikus anyagcsere betegségnek, mint lázszindrómának, amelyre a HIDS-vel szemben súlyos idegrendszeri érintettség és korai halálozás jellemzõ. Az MA-ra már születéskor figyelmeztet a dysmorph fej és arckarakter, amelyre háromszög alakú arc, elõdomborodó homlok, alacsonyan ülõ fülek, ferde vágású, mongoloid szemrések, hosszú szempillák, fejletlen orrszárnyak és micro-dolichocephalia (hosszúfejûség) jellemzõ. Késõbb egyre nyilvánvalóbbá válik a mentális és növekedési retardáció, a meglassult pszichomotoros fejlõdés, a táplálási nehezítettség, az ataxia és az izomgyengeség. A központi idegrendszeri képalkotó vizsgálatok cerebellaris atrophiát igazolnak. A MA krízisekre 4-5 napig tartó, 4-6 napos idõközzel jelentkezõ láz, hányás, hasmenés, morbilliform kiütések, nyirokcsomó megnagyobbodás, ízületi fájdalom és subcutan oedema jellemzõ. A szomatikus és mentális fejlõdés visszamaradása mellett gyakori a hepatosplenomegalia, a cataracta, az anaemia és a thrombocytopenia. A neurológiai tünetek hiányozhatnak is. Laboratóriumi eltérések - A granulocytosis, a gyulladásos paraméterek pozitivitása és a mérsékelten emelkedett szérum cholesterol szint mellett rendszerint emelkedett szérum IgD szint és a betegek több mint 80%- ában emelkedett szérum IgA szint észlelhetõ. Az emelkedett szérum IgD szint a rohammentes idõszakokban is kimutatható. Fontos, hogy a kórkép neve ellenére az emelkedett szérum IgD szint nem obligát laboratóriumi eltérés, különösen a 3 évesnél fiatalabb gyermekekben hiányozhat is! Elkülönítõ diagnosztikai nehézséget okozhat, hogy a szérum IgD szint más lázszindrómákban és gyulladásos állapotokban is emelkedett lehet, bár a HIDS esetében észlelt értéket (legalább a normál érték háromszorosa) nem éri el. A rohamok idején MA esetében a vizelet mevalonsav-tartalma százszor-ezerszer nagyobb lehet, mint HIDS-ben, illetve MA-ban tünetmentes idõszakban is fokozott az ürítés. Jelentõs mérté- 12
13 4. ábra: A HIDS és a MA patomechanizmusa A MVK gén mutációja következtében a HMG-CoA-ból képzõdõ mevalonsav nem tud tovább alakulni 5-foszfomevalonsavvá, amely a mevalonsav felszaporodásához vezet. Rövidítések: CoA: koenzim A; HIDS: Hyper-IgD szindróma (Hyper-IgD Syndrome); HMG-CoA: 3-hidroxi-3-metilglutaril-CoA; MVK: Mevalonát-kináz gén Autoinflammációs szindrómák visszatérõ lázszindrómák kû mevalonsav-ürítésre tehát csak MA esetében számíthatunk, amely betegséget sok esetben már születéskor a jellegzetes dysmorph küllem, vagy kisdedkorban az idegrendszeri tünetek megjelenése alapján diagnosztizálhatjuk. HIDS esetében a mevalonsav-ürítés csak mérsékelten fokozódik, amely laboratóriumi módszerrel rendszerint nem is mutatható ki, ezért HIDS gyanúja esetén a vizsgálat diagnosztikus célú végzése megkérdõjelezhetõ. A vizelet neopterin koncentráció az aktivált cellularis immunválasz markereként, a betegségi aktivitás megitélésére alkalmas. MA esetében a szérum koleszterin szint fiziológiás vagy enyhén csökkent lehet. A szerves savak anyagcserezavarára jellemzõ eltérések, mint pl. a hypoglykaemia, a metabolikus acidosis vagy a laktátacidosis nem észlelhetõk. A heterozigóta hordozók, illetve beteg magzatok az enzimaktivitásmeghatározás, illetve az amnionfolyadék kórosan emelkedett mevalonsav-tartalma alapján kiszûrhetõek. Patomechanizmus A MVK gén mutációja következtében a 3-hidroxi-3-metilglutaril-CoA-ból (HMG- CoA) képzõdõ mevalonsav nem tud tovább alakulni 5- foszfomevalonsavvá, amely a mevalonsav felszaporodásához, illetve a sejtfunkcióhoz szükséges izoprenoidok hiányához vezet (4. ábra). Nem tisztázott, hogy a MVK deficiencia klinikai következményei a kórosan felszaporodott mevalonsav toxicitásával vagy az izoprenoidok hiányával magyarázhatók-e. A 12-es kromoszómán (12q24) kódolt enzim mûködésének zavara pirogén hatású IL-1β-felszaporodással is jár, ugyanakkor nem tisztázott a mevalonsav proinflammatorikus hatásának folyamata és a kórkép nevét adó szérum IgD emelkedés oka sem. HIDS esetében az MVK aktivitás a normális 1 15%-a, míg MA esetében rendszerint 1% alatti vagy mérhetetlen. A többi autoinflammációs kórképhez képest, HIDS esetében egyértelmû a limfatikus szövetek fokozott reaktivitása (lymphadeno- és splenomegalia), amely valószínûleg a lymphocyta apoptosis zavarával magyarázható. Terápia - Oki terápia nem áll rendelkezésre, a betegség kezelése tüneti (lázcsillapítás, haematológiai rendellenességek kezelése stb.). Eddig NSAID, szteroid, intravénás immunglobulin, cholchicin, cyclosporin, thalidomid, simvastatin és etanercept kezeléssel történtek próbálkozások. Az elsõsorban hypercholesterinaemiában alkalmazott statinok (pl. simvastatin) gátolják a HMG- CoA-reduktáz enzimet, amely a mevalonsav-képzõdés csökkentésével kedvezõ hatású lehet. A terápiával kapcsolatos tapasztalatok azonban ellentmondóak. Az NSAID, a cyclosporine és a thalidomide terápia hatástalan, illetve a nagydózisú kortikoszteroid terápiára sem reagál minden beteg kedvezõen. Az etanercept terápiával kapcsolatban ellentmondásosak a tapasztalatok (3). Az IL-1β patogenezisben játszott szerepét igazolja az anakinra terápia hatékonysága (3). 4) Cryopyrin-asszociált periódikus lázszindróma, CAPS Az autoszomális domináns öröklõdésmenetet mutató CAPS három szindrómát foglal magába (Familiáris hideg urticaria/familiáris hideg autoinflammációs szindróma, FCU/FCAS; Muckle Wells szindróma, MWS; Krónikus infantilis neurológiai-bõr-ízületi betegség/újszülöttkorban kezdõdõ multiszisztémás gyulladásos betegség, CINCA/NOMID), amelyeket hideg indukálta autoinflammatorikus szindrómáknak, illetve cryopyrinopathiáknak is nevezünk. Valójában egy betegség különbözõ súlyosságú formáiról van szó, a legenyhébb FCAS-tól a legsúlyosabb NOMID szindrómáig terjedõen, amelyekre a visszatérõ láz mellett hasi fájdalom, arthralgia, myalgia és urticariform exanthemák jellemzõek. Mindhárom kórkép hátterében a granulocytákban és a monocytákban kifejezõdõ cryopyrin vagy más néven NALP3 fehérjét kódoló, az 1-es kromoszóma 1q44 régiójára lokalizált CIAS1 (Cold-Induced Autoinflammatory Syndrome) gén (vagy NALP3) mutációja áll, ezért a három kórképet összefoglalóan CIAS1 (NALP3)-asszociált betegségnek is szokták nevezni (13). Patomechanizmus - A cryopyrin fehérjék a NOD- LRR proteincsalád tagjai, amelyek a veleszületett immunitás intracellularis szenzoraiként elsõsorban a monocytákban és a neutrofil granulocytákban expresszálódnak. A patogének és egyéb a sejtre veszélyt jelentõ szignálok felismerése a TLR analógiájára valószínûleg közvetlenül a PAMP (Pathogen-Associated Molecular Pattern) mintázat érzékelésével az LRR régióval történik. A fehérje a pyrin doménen (PYD) keresztül adaptor proteinekkel (ASC, Cardinal) kapcsolódik, amely az ún. cryopyrin inflammasoma kialakulásához vezet. A komplex a pro-caspase-1 enzimet aktiválja, amely az inaktív IL-1β prekurzort (pro-il-1β) a proinflammatorikus hatású aktív IL-1β citokinné hasítja (1. ábra). A cryopyrin a 13
14 caspase-1 rendszeren keresztül tehát IL-1β aktivációt és hiperszekréciót eredményez. A betegekben eddig leírt mutációk a NOD domént érintik, amelyek következménye funkciónyerés, vagyis a mutáns cryopyrinek fokozott caspase-1 aktivitáshoz és IL-1β hiperszekrécióhoz vezetnek (34). A jelenleg elfogadott hipotézis szerint a cryopyrinek egy autoinhibitor hatású hurokkal rendelkeznek, vagyis inaktív állapotban a saját NOD és LRR domének kapcsolódnak, amely megakadályozza a további adapterek kötõdését, így a rendszer spontán aktiválódását (1). A NOD domént érintõ mutációk valószínûleg ennek az inhibitor hatású hurokszerkezetnek a kialakulását teszik lehetetlenné, emiatt a rendszer felpörög és a szervezet mérsékelt stimulusokra is túlzott mértékû IL-1β szekrécióval válaszol (1. ábra) (1). Klinikai tünetek laboratóriumi eltérések FCU/FCAS esetén a betegek többségében az elsõ tünet már hat hónapos kort megelõzõen jelentkezik. A gyulladásos tünetek a generalizált hideghatást követõen percek alatt vagy maximum 8 órán belül jelentkeznek, tüneti kezelésre rendszerint jól reagálnak és ½ 2 nap alatt megszûnnek, bár idõnként 3 napig is elhúzódhatnak (14). Lokalizált hideghatás nem provokálja a tüneteket, amely megkülönbözteti a kórképet a szerzett hideg urticariától. A leggyakoribb tünet a viszketõ, égõ érzéssel járó urticaszerû kiütés, amely idõnként a végtagokon lokalizált oedemával is társul. A legtöbb betegben elsõsorban a kéz-, a boka- és a térdízületeket érintõ polyarthralgia illetve myalgia is észlelhetõ, arthritis viszont nem jellemzõ. Gyakori tünet még a conjunctivitis, profúz izzadás, álmosság, fejfájás és hányinger. A tünetek súlyossága és a lázas epizód idõtartama a hidegexpozíció erõsségétõl függ. FCAS esetében enyhébb hideghatás is provokálhatja a tüneteket, amelyek gyakran diurnálisan váltakozó súlyossággal jelentkeznek. A laboratóriumi vizsgálatok az akut fázis fehérjék pozitivitását mutatják, a hízósejt mediátorok (hisztamin, triptáz) és a cryoglobulinok szintje fiziológiás, amellyel a mastocytosis és a cryoglobulinaemia kizárható. Az MWS-t eredetileg az urticaria, a siketség és az amyloidosis triászaként írták le. A betegség általában serdülõkorban jelentkezik, rövid, órán tartó lázas állapottal, amelyhez a törzsön és a végtagokon jelentkezõ urticariform exanthemák, uveitis, conjunctivitis, szájnyálkahártya- és esetleg genitalis aphthosis, valamint fogeltérések társulhatnak. Az elõbbi kórképtõl elkülöníti, hogy a tüneteket hideg nem provokálja. Arthralgia, myalgia és szúró végtagi fájdalom elõfordulhat, az arthritis nem jellemzõ. A nyirokcsomók érintettsége rendszerint generalizált. Évek múltán perceptív halláscsökkenés (a betegek 70%-ában), majd siketség és amyloidosis alakulhat ki. A tünetmentes idõszakok hossza igen változó, néhány betegben folyamatosan fennálló tünetekrõl számoltak be (26). Az akut fázis fehérjék pozitivitása a lázmentes periódusokban is perzisztál. A nyirokcsomó szövettani vizsgálatok aspecifikus, reaktív gyulladást mutatnak. A CINCA/NOMID a CAPS legsúlyosabb formája, amelyre rendszerint már újszülöttkortól, de legkésõbb Autoinflammációs szindrómák visszatérõ lázszindrómák 6 hónapos kortól jelentkezõ generalizált urticariform kiütések, deformáló arthropathia és idegrendszeri tünetek, elsõsorban krónikus aszeptikus meningitis jellemzõ. A dysmorph jelektõl eltekintve az elsõ tünet jellemzõ módon az urticaszerû exanthema. Késõi szövõdményként vasculitis, daganat és amyloidosis alakulhat ki. A neurológiai tünetek (fejfájás, epilepsziás rohamok, spaszticitás, mentális retardáció) a krónikus aszeptikus meningitis és az agynyomás fokozódás következményei. A betegséget visszatérõ láz, lymphadenopathia, hepatosplenomegalia és conjunctivitis kísérheti. A perceptív hallásveszés gyakori, de ebben a kórképben a szem érintettsége dominál. A látásvesztés papillaoedema, optikus atrophia és uveitis következménye lehet. Az erozív arthritis gyakori fellángolása súlyos arthropathiához, ízületi deformitáshoz és korai epiphysealis csontosodáshoz vezet. A gyulladásos paraméterek pozitivitása szinte folyamatos. A liquor vizsgálat emelkedett intracranialis nyomást, enyhe pleiocytosist és emelkedett protein koncentrációt mutathat. A képalkotó vizsgálatok általában agykamra tágulatot és centralis atrophiát igazolnak. Az ízületi folyadék vizsgálata neutrophil sejtes infiltrációt mutat, de kórokozó baktérium nem tenyészthetõ ki. A betegek rendszerint nem élik meg a felnõttkort, bár az utóbbi idõben az anakinra terápiás hatása ebben a lázszindrómában is biztatónak tûnik. Terápia - A betegség mindhárom formájában az elsõként választandó szer az anakinra, amely az amyloidosisra illetve a látás- és hallásvesztésre is kedvezõ hatású (26). Nem ismert, hogy tartós anakinra kezeléssel a fenti szövõdmények kialakulása megelõzhetõ-e. További IL-1 támadáspontú készítményekkel, így rilonacepttel és canakinumabbal is történtek próbálkozások (15). Az etanercept esetében ellentmondóak a tapasztalatok, míg a thalidomid terápia hatásosnak bizonyult (19, 24). A nagydózisú, tartós kortikoszteroid terápia hatásos, de a toxikus mellékhatások miatt nem elsõként választandó szer. FCAS esetében fontos a hideghatás kerülése. Összefoglalás A veleszületett autoinflammációs szindrómák egy gyakori és könnyen felismerhetõ tünetben, a lázban manifesztálódnak, ritkaságuk miatt mégis gyakran okoznak komoly diagnosztikai nehézséget. A háttérben kimutatható konstans genetikai defektus ellenére a klinikai tünetekre az epizodikusság jellemzõ. Ezt az ellentmondást azzal tudjuk feloldani, hogy feltételezzük a klinikai tünetek bizonyos trigger faktorok hatására történõ manifesztálódását. Hasonló a helyzet, mint amelyet az X-kromoszómához kötött lymphoproliferatív (XLP) betegségben is látunk. XLP-ben a gyakran fatális kimenetelû infekciós mononucleosis a születés óta meglévõ génhiba ellenére, csak az Epstein-Barr vírussal történõ találkozást követõen alakul ki; addig az érintettek teljesen egészségesek lehetnek. Az autoinflammációs szindrómák esetében részben már ismertek a provokáló tényezõk, gondoljunk FMF esetén az infekció, a menstruáció, illetve az emóció trigger hatására, de példaként 14
15 említhetjük a megelõzõ vakcináció és minimális trauma szerepét a hyper-igd szindróma esetében, illetve a generalizált hideghatás jelentõségét a CAPS bizonyos típusaiban. Ugyanakkor a kiváltó tényezõk sokszor nem nyilvánvalóak és a gondos observáció során sem kerülnek felszínre. Ilyen esetekben tanácsos a tüneti napló vezetése és a lázat megelõzõ idõszak eseményeinek pontos feljegyzése. Az idejekorán felállított diagnózis fontos, hiszen a ma már egyre szélesebb körben hozzáférhetõ biológiai terápiás szerekkel a prognózis jelentõsen javítható és a súlyos szövõdmények kialakulása megelõzhetõ. Sajnálatos tapasztalat, hogy egyre több tisztázatlan eredetû lázas állapotban szenvedõ gyermekre próbálják ezen ritka szindrómák valamelyikét rábizonyítani és a FUO (fever of unknown origin) esetében elõírt kivizsgálási protokoll gondos követése helyett a molekuláris genetikai vizsgálatoktól remélik a diagnózist. Az autoinflammációs szindrómák ritka kórképek, amelyek patomechanizmusa és genetikai háttere még nem ismert minden részletében, ezért sem fogadható el, hogy tisztázatlan hátterû lázas állapotokban a munka-, idõés költségigényes génszintû vizsgálatok jelentsék a kivizsgálás elsõ lépcsõfokát. Törekedni kell arra, hogy a mutáció-analízis vizsgálatok ezekben a kórképekben is a már biztos klinikai diagnózis megerõsítését szolgálják. A jelenlegi ajánlás szerint autoinflammációs szindróma irányába történõ kivizsgálás akkor indokolt, ha a visszatérõ láz okát két éven át nem lehet megállapítani és infekció, malignitás illetve autoimmun folyamat egyértelmûen kizárható! Eltekintve tehát az autoinflammációs szindrómák már újszülöttkorban egyértelmûen (pl. a dysmorphológiai jelek alapján) diagnosztizálható néhány típusától, visszatérõ láz miatt observált két éves kor alatti gyermek autoinflammációs szindróma irányú kivizsgálása nem indokolt! Köszönetnyilvánítás A munka az OTKA PD (EM) és a TÁMOP ( / ) támogatásával készült. Irodalomjegyzék 1. Agostini L., Martinon F., Burns K. et al.: NALP3 forms an IL-1beta-processing inflammasome with increased activity in Muckle-Wells autoinflammatory disorder. Immunity, 20, , Bodar E.J., Drenth J.P., van der Meer J.W. et al: Dysregulation of innate immunity: hereditary periodic fever syndromes. Br. J. Haematol., 144, , Bodar E.J., van der Hilst J.C.H., Drenth J.P. et al.: Effect of etanercept and anakinra on inflammatory attacks in the hyper-igd syndrome: introducing a vaccination provocation model. N. Engl. J. Med., 63, , Calgueri M., Apras S., Ozbalkan Z. et al.: The efficacy of continuous interferon alpha administration as an adjunctive agent to colchicine-resistant familial Autoinflammációs szindrómák visszatérõ lázszindrómák Mediterranean fever patients. Clin. Exp. Rheumatol., 22, S41-S44, Calligaris L., Marchetti F., Tommasini A. et al.: The efficacy of anakinra in an adolescent with colchicineresistant familiar Mediterranean fever. Eur. J. Pediatr., 167, , Chae J.J., Komarow H.D., Cheng J. et al.: Targeted disruption of pyrin, the FMF protein, causes heightened sensitivity to endotoxin and a defect in macrophage apoptosis. Mol. Cell., 11, , Chae J.J., Wood G., Masters S.L. et al.: The B30.2 domain of pyrin, the familial Mediterranean fever protein, interacts directly with caspase-1 to modulate IL- 1beta production. Proc. Natl. Acad. Sci., 103, , Federici L., Rittore-Domingo C., Koné-Paut I. et al.: A decision tree for genetic diagnosis of hereditary periodic fever in unselected patients. Ann. Rheum. Dis., 65, , French FMF Consortium: A candidate gene for familial Mediterranean fever. Nat. Genet., 17, 25-31, Gattorno M., Federici S., Pelagatti M.A. et al.: Diagnosis and management of autoinflammatory diseases in childhood. J. Clin. Immunol., 28, S73-S83, Heberden W.: Commentaries on history and care of disesase. London: T. Payne, 151, Heller H., Sohar E., Sherf L.: Familial Mediterrancan fever. Arch. Intern. Med., 102, 50-71, Hoffman H.M., Mueller J.L., Broide D.H. et al.: Mutation of a new gene encoding a putative pyrin-like protein causes familial cold autoinflammatory syndrome and Muckle-Wells syndrome. Nat. Genet., 29, , Hoffman H.M., Wanderer A.A., Brodie D.H.: Familial cold autoinflammatory syndrome: phenotype and genotype of an autosomal dominant periodic fever. J. Allergy Clin. Immunol., 108, , Hoffman H.M., Throne M.L., Amar N.J. et al.: Efficacy and safety of rilonacept (interleukin-1 Trap) in patients with cryopyrin-associated periodic syndromes: results from two sequential placebocontrolled studies. Arthr. Rheum., 58, , Hull K.M., Wong K., Wood G.M. et al.: Monocytic fasciitis: a newly recognized clinical feature of tumor necrosis factor receptor dysfunction. Arthr. Rheum., 6, , International FMF Consortium: Ancient missense mutations in a new member of the RoRet gene family are likely to cause familiar Mediterranean fever. Cell, 90, , Jacobelli S., Andre M., Alexandra J.F. et al.: Failure of anti-tnf therapy in TNF Receptor 1-Associated Periodic Syndrome (TRAPS). Rheumatology (Oxford), 46, , Kallinich T., Hoffman H.M., Roth J. et al.: The clinical course of a child with CINCA/NOMID syndrome improved during and after treatment with thalidomide. Scand. J. Rheumatol., 34, ,
16 20. Karachaliou I., Karachalios G., Charalabopoulos A. et al.: Meningitis associated with familiar Mediterranean fever. Intern. J. Clin. Pract., 59, 60-61, Livneh A., Langevitz P., Zemer D. et al.: Criteria for the diagnosis of familiar Mediterranean fever. Arthr. Rheum., 40, , Majeed H.A.: Differential diagnosis of fever of unknown origin in children. Curr. Opin. Rheumatol., 12, , Martinon F., Tschopp J.: Inflammatory caspases: linking an intracellular innate immune system to autoinflammatory disease. Cell, 117, , Matsubara T., Hasegawa M., Shiraishi M. et al.: Severe case of chronic infantile neurologic, cutaneous, articular syndrome treated with biologic agents. Arthr. Rheum., 54, , McDermott M.F., Aksentijevich I., Galon J.: Germline mutations in the extracellular domains of the 55 kda TNF receptor, TNFR1, define a family of dominantly inherited autoinflammatory syndromes. Cell, 97, , Mirault T., Launay D., Cuisset L. et al.: Recovery from deafness in a patient with Muckle-Wells syndrome treated with anakinra. Arthr. Rheum., 54, , Mor A., Pillinger M.H., Kishimoto M. et al.: Familial Mediterranean fever successfully treated with etanercept. J. Clin. Rheumatol., 13, 38-40, Rigante D.: Autoinflammatory syndromes behind the scenes of recurrent fevers in children. Med. Sci. Monit., 15, RA , Siegal S.: Benign paroxysmal peritonitis. Ann. Intern. Med., 23, 1-21, 1945 Autoinflammációs szindrómák visszatérõ lázszindrómák 30. Simon A., Bodar E.J., van der Hilst J.C. et al.: Beneficial response to interleukin 1 receptor antagonist in traps. Am. J. Med., 117, , Simon A., Kremer H.P., Wevers R.A. et al.: Mevalonate kinase deficiency: Evidence for a phenotypic continuum. Neurology, 62, , Stok C.J., van der Meer J.W.M., Kruseman A.C.: Statistical analysis of fever interval data. Eur. J. Clin. Invest., 19, , Ting J.P., Kastner D.L., Hoffman H.M.: CATERPIL- LERs, pyrin and hereditary immunological disorders. Nat. Rev. Immunol., 6, , Touitou I., Lesage S., McDermott M. et al.: Infevers: an evolving mutation database for auto-inflammatory syndromes. Hum. Mutat., 24, , Tunca M., Akar S., Soytürk M. et al.: The effect of interferon alpha administration on acute attacks of familiar Mediterranean fever: A double-blind, placebo-controlled trial. Clin. Exp. Rheumatol., 22, S37- S40, Van der Meer J.W., Vossen J.M., Radl J. et al.: Hyperimmunoglobulinaemia D and periodic fever: a new syndrome. Lancet, 1, , Williamson L.M., Hull D., Mehta R. et al.: Familian Hibernian fever. Q. J. Med., 51, , Yu J.W., Wu J., Zhang Z. et al.: Cryopyrin and pyrin activate caspase-1, but not NF-kappaB, via ASC oligomerization. Cell Death Differ., 13, , Yuksel S., Yalcinkaya F., Acar B. et al.: Clinical improvement with infliximab in a child with amyloidosis secondary to familiar Mediterranean fever. Rheumatology (Oxford), 45, ,
17 Autoimmun betegségek és infekciók Prof. Zeher Margit Debreceni Egyetem Orvos- és Egészségtudományi Centrum, Belgyógyászati Intézet, III. sz. Belgyógyászati Klinika, Debrecen Autoimmun betegségek és infekciók Összefoglalás: Az autoimmun betegségek patogenezise komplex folyamat, melyben provokáló tényezõk, autoantigének, genetikai fogékonyság és immunológiai szabályozó tényezõk interakciói vesznek részt. A potenciális környezeti tényezõk közül a vírusok szerepe a legfontosabb. A mikrobiális antigének olyan keresztreagáló immunválaszt váltanak ki, mely képes a saját antigénekkel reagálni, így az infekciók nem specifikus úton fokozzák a saját antigének bemutatását az immunrendszer számára. Az immunszisztéma a fail-safe mechanizmussal gátolja a fertõzéshez társult szöveti károsodást és így gátolja az autoimmun választ. Az autoimmun betegségek és a fertõzések közötti kapcsolat alapján merül fel az a kérdés, hogy a vakcinák is képesek-e autoimmun jelenségeket, autoimmun betegségeket provokálni. A közleményben bemutatjuk azokat a mechanizmusokat, melyek az autoimmunitás indukálásában szerepet játszanak. Az autoimmun betegségekben fokozott a fertõzésekre való fogékonyság, melynek két fontos tényezõje van. Az egyik az immunválasz intrinsic zavara, a másik az alkalmazott immunszuppresszív kezelés, ami nagyon fontos a betegségek aktivitásának kontrollálásában. Az autoimmun betegeken kialakuló fertõzések néhány speciális kérdését is tárgyaljuk. Kulcsszavak: autoimmunitás, fertõzések, autoimmun betegségek, vakcináció Summary: The pathogenesis of autoimmune diseases entail complex interactions between triggering factors, autoantigens, genetic predisposition and immunoregulatory networks. Of the many potential environmental factors, infections are the most likely cause. Microbial antigens can induce cross-reactive immune responses against self-antigens, whereas infection can non-specifically enhance their presentation to the immune system. The immune system uses fail-safe mechanisms to suppress infection-associated tissue damage and thus limits autoimmune responses. The association between infection and autoimmune disease has, however, stimulated a debate as to whether such diseases might also be triggered by vaccines. Here we review the mechanisms involved in the induction of autoimmunity. An increased risk of infection in autoimmune disease group is related to both intrinsic disturbances of immune responses and use of immunosuppressive drugs, which are often needed to control disease activity. Some special aspects of the treatment of infections and autoimmune diseases are also discussed. Key words: autoimmunity, infections, autoimmune diseases, vaccination Bevezetés Az autoimmun betegségek a fejlett országokban a lakosság kb. 5%-át érintik (18). Bár bizonyos autoimmun kórképek ritkák, mások incidenciája fokozatosan nõ (pl. I. típusú diabetes mellitus, sclerosis multiplex) (12,29). Az autoimmun betegségek genetikailag fogékony egyénekben különbözõ környezeti hatások következében alakulnak ki, melyek közül kiemelkedõ jelentõségûek a vírus infekciók (39). Gyakran az autoimmun választ nem követi klinikai tünetek kialakulása, a lokális gyulladás szöveti szinten marad. Azoknak a mechanizmusoknak a megismerése, illetve megértése, melyekkel a vírusok résztvesznek, résztvehetnek az autoimmun betegségek provokálásában azért is jelentõs mert a betegségek aktiválása, illetve a vakcinációk során kialakuló autoimmun jelenségek magyarázatául is szolgálnak. A közlemény részletesen foglalkozik azzal, hogy az autoimmun betegségek kialakulásában milyen szerepe van a vírusoknak. Ismertetésre kerül, hogy a vakcináció során milyen a relatív rizikója az autoimmun betegségek kialakulásának (2). Bemutatásra kerülnek azok a tényezõk, melyekkel az autoimmun betegek fertõzésekre való fogékonyságát magyarázni lehet. Autoimmun betegségek és fertõzések A humán immunszisztéma nagyon komplex rendszer. Az innate (természetes) immunrendszer nem-specifikusan reagál a fertõzésekre és nem alakul ki memória. Az adaptív (szerzett) immunszisztéma specifikusan reagál, memóriával rendelkezik és szinte minden fertõzés ellen képes védekezést kialakítani. Az immunrendszer szabályozását végzõ gének polimorfizmusának köszönhetõ, hogy hatékony immunválasz alakul ki az új fertõzésekkel szemben. A széleskörû védekezési képesség hátránya az, hogy a genetikailag fogékony egyénekben az immunrendszer a saját antigénjeit megtámadva autoimmun betegségeket válthat ki (43). Az infekciók két mechanizmussal provokálhatnak autoimmun betegséget, nem specifikus és antigénspecifikus úton, melyek függetlenül vagy együttesen is kialakulhatnak. A molekuláris mimikri A molekuláris mimikri jelensége a klasszikus magyarázat arra, hogy a fertõzõ ágensek hogyan provokálnak autoimmunitást antigénspecifikus módon (44). 17
18 Autoimmun betegségek és infekciók A B 1. ábra: A molekuláris mimikri mechanizmusa A: A mikrobákra reaktív B-sejtek a mikrobialis antigén direkt felismerésekor aktiválódnak. Az aktivált B-sejtek keresztreagálnak a saját szöveti antigénekkel, így autoimmun reakció alakul ki. B: A mikrobákra reaktív T-sejtek aktivációját az antigénprezentáló sejtek (APCs) MHC molekulái által bemutatott mikrobiális antigének felismerése váltja ki. Ezek a sejtek keresztreakciót mutatnak a saját szöveti antigénekkel vagy az APCs által bemutatott antigénekkel. Az immunrendszer által felismerhetõ antigén determinánsok hasonlóak a mikroorganizmusokban és a szervezet egyes részeiben, így lehetõség nyílik a saját antigének elleni, támadó immunválasz kialakulására (1. ábra A). A cukorstruktúrák közötti molekuláris mimikri gyakori, infekciókhoz-asszociált és antitest mediált neuropathiákhoz vezethet (5,32). A Guillain-Barré-szindrómás esetek kb. harmada Campylobacter jejuni fertõzés után alakul ki (3). Ez a baktérium lipopoliszacharidokat expresszál, melyek különbözõ gangliozidokat utánoznak és magas a koncentrációjuk a perifériás idegekben. Különbözõ vírusok a gazdasejt plazmamembránját használják gangliozid forrásként. Ezekkel a jelenségekkel magyarázhatók, hogy a vírusinfekciók gyakran asszociálódnak Guillain-Barré-szindrómával, és a bakteriális és vírus fertõzések kapcsolódhatnak a betegség indukciójához (25). A molekuláris mimikri jelenség komplexebb, ha a T-lymphocyták involváltak. Ezek a sejtek a saját antigénjeiket az MHC molekulához kötötten ismerik fel. Az autoreaktív T-sejtek számára úgy szolgálhatnak molekuláris utánzóként, hogy a saját antigén epitóp méretét lemásolják és úgy kötõdnek az MHC molekulához. Ezt a jelenséget elsõként a sclerosis muliplex experimentális modelljében írták le (1. ábra B). Infekció indukálta autoimmunitás A mikroorganizmusok autoimmun betegséget indukálhatnak bystander aktivációval, mely nem-antigén specifikus mechanizmus. A mikrobiális fertõzések az immunrendszer elõl korábban elzárt saját antigének kiszabadulását eredményezik vagy stimulálják az innate (természetes) immunválaszt, mely a saját antigéneket bemutató, antigén prezentáló sejtek aktivációját váltja ki (2. ábra). Az autoimmun betegségek indukálódhatnak fertõzött szövetekben. Állatkísérletben igazolták, hogy a pancreas szigetsejtek Coxsackie B4 fertõzése után antigén specifikus T-sejtes gyulladás és diabetes alakult ki (15). A vírusfertõzés tehát a pancreas szigetsejtben okozott károsítással a sequestrált saját antigének kiszabadulását és prezentációját eredményezte. A T-lympho- 2. ábra: Az infekció indukálta autoimmunitás mechanizmusa A gazdaszervezet szöveteinek mikrobiális fertõzése szöveti károsodást okoz (1) és saját antigének kiszabadulását eredményezi (2). A mikrobiális molekulák az antigénprezentáló sejtek (APCs) Toll-like receptoraihoz kötõdnek, melynek következtében az MHC és a costimulator molekulák upregulációja és citokinek termelõdése jön létre (3). Az APCs-ken a saját antigének expresszálódnak, melyek az autoreaktív T-sejtek aktivációjához vezetnek, fokozódik a citokinek termelõdése, helyi gyulladás alakul ki és más autoreaktív lymphocyták gyülekeznek a helyszínre (4). 18
19 cyták az antigénprezentáló sejtek által bemutatott antigénekre válaszolnak. Ezek a sejtek a vírusinfekciókra adott válasz során a naív T-sejtek aktivációjához szükséges antigénbemutató mechanizmust up-regulálják. A microbiális termékek (származékok) a dendritikus és más antigénprezentáló sejteken lévõ Toll-like receptorokhoz kötõdnek, melynek következtében fokozódik az MHC és co-stimulátor molekulák membránon történõ expressziója és a különbözõ citokinek termelõdése, melyek a T-sejtek aktivációját fokozzák (24). A fail-safe mechanizmus Az autoimmun betegségek provokálásában fontos szerepet játszanak a saját antigének és a mikrobiális antigének közötti keresztreakciók. Egyre több adat szól amellett, hogy a kórokozók által provokált természetes immunitás is szerepet játszhat az autoimmun kórképek kiváltásában. Az immunrendszer homeosztatikus szabályozás alatt áll, az aktiváció indukálta sejthalál folyamata az antigénekre adott T-sejtes válasz függvénye. Ez a mechanizmus arra szolgál, hogy a lymphocyta poolt optimálisan meghatározott szinten tartsa, így a homeostatikus kontroll képes a saját -ra reagáló (self-reaktív) lymphocytákat ellenõrizni (38). A perifériás tolerancia zavara esetén a selfreaktív lymphocyták proliferációja következik be, mely autoimmun betegségek kialakulásához vezethet. Az antigének által kiváltott immunválasz szabályozásában fontos szerepet játszanak a regulatorikus T-sejtek (CD4 + CD25 + ) (6,23). Az antigének által kiváltott T-sejtes proliferáció gátlásának hiánya állatkísérletben autoimmun betegséget idéz elõ (33). Az 1-es típusú regulatorikus sejtek szerepet játszanak az infekciók által kiváltott immunválasz szabályozásában, így a következményes gyulladás csökkentésében (41). A felsoroltak bizonyítják, hogy az infekciókra adott immunválasz homeosztatikus és regulatorikus úton szabályozott, ezek a fail-safe mechanizmusok képesek megvédeni a szervezetet az infekciók során attól, hogy autoimmun betegségek alakuljanak ki. A failsafe mechanizmusok határozzák meg a szervezet vakcinációra bekövetkezõ válaszát. A hatásos vakcina képes védõ immunitást kiváltani úgy, hogy megõrzõdik egy minimális molekuláris mimikri és bystander aktiváció. Vakcináció és autoimmun betegségek A szakirodalomban több közlemény foglalkozik azzal, hogy a vakcinációk során valóban nõ-e a rizikója az autoimmun betegségek kialakulásának. Néhány esetben az autoimmun betegségekre jellemzõ pathológiai elváltozásokat figyeltek meg az adott vakcinával kapcsolatosan. Az es sertés influenza elleni védõoltási kampányban az A/New Jersey/8/76 típusú vakcina használatakor Guillain-Barré-szindróma kialakulását figyelték meg (36), az oltott populációt figyelembe véve 1 eset/ vakcinációnak felelt meg a gyakoriság. Lasky és mtsai vizsgálatai szerint ez az arány 1 eset/ 1 millió vakcináltnak felel meg, mely kisebb kockázatot jelent, mint az influenza okozta súlyos szövõdmények kialakulása (7,21). A vakcináció másik igazolt autoimmun mellékhatása az idiopathiás thrombocytopenia megjelenése, mely kanyaró-mumps-rubeola vakcinálás után alakulhat ki (3,7,19,26,30,42). A vakcinációval kapcsolatos esetszám 1/30000 vakcinált gyermek, míg a rubeola természetes lefolyásakor 1 eset/3000 vakcinált és a kanyarónál 1 eset/6000 vakcinált (7). Mindezek alapján megállapítható, hogy lehetnek olyan esetek, akikben a vakcinációhoz autoimmun betegségek kialakulása köthetõ, de azok gyakorisága elenyészõ. Hepatitis B és a sclerosis multiplex A hepatitis B vakcináció után kialakult sclerosis multiplexes (SM) esetekrõl francia tanulmányok számoltak be elõször az közötti periódusban (14,40). A klinikailag gyanús esetek közül 50%-ban valódi SM alakult ki. Az esetek nagy száma miatt számos tanulmányt végeztek és a statisztikailag jól konfigurált tanulmányok alapján szignifikáns ok-okozati összefüggést nem sikerült kimutatni (1,8). Diabetes és vakcináció Az utolsó néhány évtizedben az I. típusú diabetes mellitus (DM) elõfordulási gyakorisága jelentõsen nõtt, így nem meglepõ, hogy trigger tényezõként felmerültek a gyermekkorban alkalmazott vakcinák. Már az as években elvégzett vizsgálatok igazolták, hogy tuberculosis, bárányhimlõ, tetanus, pertussis és rubeola vakcinák provokáló szerepe elvethetõ a diabetes rizikójának fokozódásában (4). A B típusú Haemophylus influenzae és a Hepatitis B vakcináció diabetest provokáló szerepét cohort tanulmány nem erõsítette meg (9). Az új generációs vakcinák Autoimmun betegségek és infekciók Speciális figyelmet érdemelnek azok az új generációs vakcinák, melyek hatásukat az innate immunitás stimulációján keresztül fejtik ki. Azok a tumor ellenes vakcinák, melyekben a dendritikus sejteket tumor antigénekkel stimulálják, fokozzák a rizikóját az autoimmun betegségek kialakulásának (22). Ezért az új vakcinák kifejlesztésekor az alábbi szempontokat figyelembe kell venni. Egyrészt el kell kerülni, hogy a vakcina természetes patogén epitópot tartalmazzon (pl. Streptococcus A csoport antigének), másrészt meg kell gyõzõdni arról, hogy a vakcina-antigén és a gazdaszervezet között immunológiai mimikri nem fog kialakulni. A molekuláris mimikri önmagában nem triggereli az autoimmun patológiai folyamatokat, de a zajló infekció okozta szöveti pusztulással és a hosszú ideig fennálló gyulladásos reakcióval együtt már kiváltó tényezõ lehet. Ezzel magyarázható, hogy a Lyme-betegség ellen kifejlesztett új vakcina ugyan tartalmazza a Borrelia burgdorferi immundominans epitópját, mely homológiát mutat a human lymphocytaasszociált antigén-1-el, ami a β2 integrin családba tartozó adhéziós molekula, a vakcináció során mégsem alakult ki arthritis a beoltott betegekben (1,8). 19
20 Az autoimmun betegek fertõzésekre való fogékonysága Az infekciók gyakori haláloki tényezõk az autoimmun betegségekben. A fertõzésekre való fogékonyság az immunválasz intrinsic zavaraival és az immunmodulans kezeléssel magyarázható, mely utóbbi elengedhetetlen a betegségek aktivitásának ellenõrzésében (17). Több tanulmány is igazolta, hogy az autoimmun betegek immunválaszának innate zavara akár nyolcszorosára is fokozhatja annak veszélyét, hogy a fertõzés haláloki tényezõ legyen (20,36). Kinder és mtsai. szisztémás lupus erythematosusos (SLE) betegekben kimutatták, hogy a tumornecrosis-faktor-alfa specifikus variánsai mutathatók ki azokon a betegeken, akiknek magasabb a rizikója pneumonia kialakulására (20). Más kutatócsoportok egyéb genetikai rizikófaktorokat is leírtak (pl. Fcγ receptor IIA), melyek a pneumonia kialakulását fokozzák és az alapbetegség patogenezisében is szerepet játszanak (10,16,34,45). A genetikai rizikó mellett demografiai és klinikai rizikófaktorok is ismertek, mint az életkor, a rassz, a képzettségi szint, az alapbetegség súlyossága, az immunszuppresszív terápia fajtája és a leukopenia (11,13,28,31). Az immunmoduláns kezelés mellékhatása Az autoimmun betegségek kezelésében mérföldkõnek számít a glukokortikoidok megjelenése, melyek az akut, életet veszélyeztetõ szervi tünetek kezelésében, de sok esetben az inaktív klinikai állapot fenntartásában nélkülözhetetlen szerek. Ezt követõen kerültek be a klinikai gyakorlatba azok a citosztatikus hatású gyógyszerek, melyek kis dózisban immunszuppresszív hatásúak. Napjainkban egyre inkább a biológiai készítmények vannak elterjedõben. Az alapbetegségre kifejtett kedvezõ hatásuk mellett felhívjuk a figyelmet az autoimmun jelenségeket okozó mellékhatásukra és a fokozott infekció hajlamra. A biológiai terápiák elsõ vonalát ma a TNFα-gátló kezelések jelentik. A proinflammatorikus hatású TNF fontos szerepet játszik a fertõzésekkel szembeni immunválaszban. A TNFα blokkolása során kimutatták, hogy gátlódik a dendritikus sejteken a Toll-like receptor 4 expresszió, mely a fertõzésekre való fogékonyság növekedésével jár (27). A gyakorlatban az opportunista fertõzések szaporodásával kell számolni, így a Tuberculosis, a Hepatitis B és C reaktivációjával, és ritkábban egyéb lappangó kórképekkel. Mindezek miatt a gyógyszerek alkalmazása elõtt megfelelõ szûrõvizsgálatok elvégzése indokolt és kötelezõ. Az autoimmun alapbetegség aktivációja vagy infekció? A gyakorló klinikus számára nehézséget okozhat annak eldöntése, hogy egy ismert szisztémás autoimmun betegségben jelentkezõ láz és/vagy szervi tünet az alapbetegség romlása és/vagy fertõzés következtében alakulte ki (37). Általánosságban elmondható, hogy a fertõzések az alapbetegség romlását idézik elõ és több szervben is gyulladás tapasztalható. Ilyenkor a szervezet ún. stressz állapotba kerül, megnövekszik a glukokortikoid igény, tehát a beteg által szedett szteroid adagot a tünetek súlyosságának arányában emelni kell, de legalább a szedett adag duplázása szükséges. A citosztatikus hatású immunmoduláns szereket átmenetileg fel kell függeszteni és korai kalkulált antibiotikus kezelés szükséges. Egy szervi tünet megjelenése, például pneumonia esetén nehezebb a differenciál-diagnosztika de a kezelési eljárásra vonatkozó útmutató az elõzõekkel megegyezõ. Megbeszélés Az autoimmun betegségek szempontjából kiemelkedõ fontosságúak a fertõzések. Az egyes infekciók genetikailag fogékony egyénekben autoimmun betegségeket provokálhatnak. Az infekciók megelõzésére használt vakcinák alkalmazásakor autoimmun jelenségek, ritkán autoimmun kórképek alakulhatnak ki. A vakcinák egyes típusai (pl. élõ kórokozót tartalmazók, bizonyos vivõanyag összetételûek) az ismert autoimmun betegség tüneteinek fellángolását válthatják ki, így különös gondossággal kell õket alkalmazni. A vakcinációk során kialakuló autoimmun mellékhatások rendszeres figyelése, követése fontos új információkkal szolgálhat. A jelenleg alkalmazott biológiai terápiák során a vakcinációk hatékonysága bizonytalan, így a vakcináció idõpontjának megválasztása illetve a revakcináció szükségességének eldöntése nagyon fontos szempont. Az autoimmun betegségek vezetõ haláloki tényezõi a fertõzések. Hajlamosító tényezõik közé soroljuk az autoimmun betegség miatt megváltozott immunológiai védekezõképességet és az alkalmazott immunszuppresszív kezelések mellékhatásait. A korszerûbb és célzottabb biológia kezelési eljárások a betegségek egy részében hatékonyabb terápiás eljárásnak bizonyultak, ugyanakkor a gyulladásos folyamat fontos lépéseibe való beavatkozással bizonyos fertõzések gyakoriságának fokozódásával járnak. Irodalomjegyzék Autoimmun betegségek és infekciók 1. Ascherio A., Zhang S.M., Hernan M.A. et al.: Hepatitis B vaccination and the risk of multiple sclerosis. N. Engl. J. Med., 344, , Bach J.F.: The effect of infections on susceptibility to autoimmune and allergic diseases. N. Engl. J. Med., 347, , Beeler J., Varricchio F., Wise R.: Thrombocytopenia after immunization with measles vaccines: review of the vaccine adverse events reporting system (1990 to 1994). Pediatr. Infect. Dis. J., 15, 88 90, Blom L., Nystrom L., Dahlquist G.: The Swedish childhood diabetes study: vaccinations and infections as risk determinants for diabetes in childhood. Diabetologia, 34, , Carpo M., Pedotti R., Allaria S. et al.: Clinical presentation and outcome of Guillain-Barré and related syndromes in relation to antiganglioside antibodies. J. Neurol. Sci., 168, 78 84,
Autoinflammatorikus betegségek immunológiai alapjai
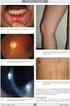 Autoinflammatorikus betegségek immunológiai alapjai Dr. Kovács László SZTE ÁOK Reumatológiai Klinika Immunológiai Alapok Tanfolyam Szeged, 2014. október 2-3. Autoinflammatorikus kórképek Rohamokban jelentkező
Autoinflammatorikus betegségek immunológiai alapjai Dr. Kovács László SZTE ÁOK Reumatológiai Klinika Immunológiai Alapok Tanfolyam Szeged, 2014. október 2-3. Autoinflammatorikus kórképek Rohamokban jelentkező
Autoinflammatorikus betegségek immunológiai alapjai
 Autoinflammatorikus betegségek immunológiai alapjai Dr. Kovács László SZTE ÁOK Reumatológiai Klinika Szakvizsgalőkészítő és Immunológiai Alapok Tanfolyam Szeged, 2018. november 6. Szisztémás gyulladásos
Autoinflammatorikus betegségek immunológiai alapjai Dr. Kovács László SZTE ÁOK Reumatológiai Klinika Szakvizsgalőkészítő és Immunológiai Alapok Tanfolyam Szeged, 2018. november 6. Szisztémás gyulladásos
Immunpatológia 1: Inflammaszóma, autoinflammatórikus szindrómák immunológiai alapjai
 Immunpatológia 1: Inflammaszóma, autoinflammatórikus szindrómák immunológiai alapjai Dr. Poór Gyula Országos Reumatológiai és Fizioterápiás Intézet Semmelweis Egyetem Reumatológiai és Fizioterápiás Tanszéki
Immunpatológia 1: Inflammaszóma, autoinflammatórikus szindrómák immunológiai alapjai Dr. Poór Gyula Országos Reumatológiai és Fizioterápiás Intézet Semmelweis Egyetem Reumatológiai és Fizioterápiás Tanszéki
Kriopirin-Asszociált Periodikus Szindróma (CAPS)
 www.printo.it/pediatric-rheumatology/hu/intro Kriopirin-Asszociált Periodikus Szindróma (CAPS) Verzió 2016 1. MI A CAPS 1.1 Mi ez? A kriopirin-asszociált periodikus szindrómák (Cryopyrin-Associated Periodic
www.printo.it/pediatric-rheumatology/hu/intro Kriopirin-Asszociált Periodikus Szindróma (CAPS) Verzió 2016 1. MI A CAPS 1.1 Mi ez? A kriopirin-asszociált periodikus szindrómák (Cryopyrin-Associated Periodic
Katasztrófális antifoszfolipid szindróma
 Katasztrófális antifoszfolipid szindróma Gadó Klára Semmelweis Egyetem, I.sz. Belgyógyászati Klinika Antifoszfolipid szindróma Artériás és vénás thrombosis Habituális vetélés apl antitest jelenléte Mi
Katasztrófális antifoszfolipid szindróma Gadó Klára Semmelweis Egyetem, I.sz. Belgyógyászati Klinika Antifoszfolipid szindróma Artériás és vénás thrombosis Habituális vetélés apl antitest jelenléte Mi
Immunológia alapjai. 10. előadás. Komplement rendszer
 Immunológia alapjai 10. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Miért fontos a komplement rendszer? A veleszületett (nem-specifikus) immunválasz része Azonnali válaszreakció A veleszületett
Immunológia alapjai 10. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Miért fontos a komplement rendszer? A veleszületett (nem-specifikus) immunválasz része Azonnali válaszreakció A veleszületett
Kryoglobulinaemia kezelése. Domján Gyula. Semmelweis Egyetem I. Belklinika. III. Terápiás Aferezis Konferencia, 2014. Debrecen
 Kryoglobulinaemia kezelése Domján Gyula Semmelweis Egyetem I. Belklinika Mi a kryoglobulin? Hidegben kicsapódó immunglobulin Melegben visszaoldódik (37 C-on) Klasszifikáció 3 csoport az Ig komponens
Kryoglobulinaemia kezelése Domján Gyula Semmelweis Egyetem I. Belklinika Mi a kryoglobulin? Hidegben kicsapódó immunglobulin Melegben visszaoldódik (37 C-on) Klasszifikáció 3 csoport az Ig komponens
Tumor Nekrózis Faktor Receptor-Asszociált Periodikus Szindróma (TRAPS)
 www.printo.it/pediatric-rheumatology/hu/intro Tumor Nekrózis Faktor Receptor-Asszociált Periodikus Szindróma (TRAPS) Verzió 2016 1. MI A TRAPS 1.1 Mi ez? A TRAPS egy gyulladásos betegség, amely visszatérő,
www.printo.it/pediatric-rheumatology/hu/intro Tumor Nekrózis Faktor Receptor-Asszociált Periodikus Szindróma (TRAPS) Verzió 2016 1. MI A TRAPS 1.1 Mi ez? A TRAPS egy gyulladásos betegség, amely visszatérő,
Kriopirin-Asszociált Periodikus Szindróma (CAPS)
 www.printo.it/pediatric-rheumatology/hu/intro Kriopirin-Asszociált Periodikus Szindróma (CAPS) Verzió 2016 1. MI A CAPS 1.1 Mi ez? A kriopirin-asszociált periodikus szindrómák (Cryopyrin-Associated Periodic
www.printo.it/pediatric-rheumatology/hu/intro Kriopirin-Asszociált Periodikus Szindróma (CAPS) Verzió 2016 1. MI A CAPS 1.1 Mi ez? A kriopirin-asszociált periodikus szindrómák (Cryopyrin-Associated Periodic
NALP-12-Höz Társult Visszatérő Láz
 www.printo.it/pediatric-rheumatology/hu/intro NALP-12-Höz Társult Visszatérő Láz Verzió 2016 1. MI A NALP-12-HÖZ TÁRSULT VISSZATÉRŐ LÁZ 1.1 Mi ez? A NALP-12-höz társult visszatérő láz egy genetikai betegség.
www.printo.it/pediatric-rheumatology/hu/intro NALP-12-Höz Társult Visszatérő Láz Verzió 2016 1. MI A NALP-12-HÖZ TÁRSULT VISSZATÉRŐ LÁZ 1.1 Mi ez? A NALP-12-höz társult visszatérő láz egy genetikai betegség.
Mevalonát-Kináz-Hiány (MKD) (vagy hiper-igd szindróma)
 www.printo.it/pediatric-rheumatology/hu/intro Mevalonát-Kináz-Hiány (MKD) (vagy hiper-igd szindróma) Verzió 2016 1. MI AZ MKD 1.1 Mi ez? A mevalonát-kináz-hiány genetikai betegség. A szervezet veleszületett
www.printo.it/pediatric-rheumatology/hu/intro Mevalonát-Kináz-Hiány (MKD) (vagy hiper-igd szindróma) Verzió 2016 1. MI AZ MKD 1.1 Mi ez? A mevalonát-kináz-hiány genetikai betegség. A szervezet veleszületett
Immunológia alapjai. 16. előadás. Komplement rendszer
 Immunológia alapjai 16. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Plazma enzim mediátorok: - Kinin rendszer - Véralvadási rendszer Lipid mediátorok Kemoattraktánsok: - Chemokinek:
Immunológia alapjai 16. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Plazma enzim mediátorok: - Kinin rendszer - Véralvadási rendszer Lipid mediátorok Kemoattraktánsok: - Chemokinek:
A DE KK Belgyógyászati Klinika Intenzív Osztályán és Terápiás Aferezis Részlegén évi közel 400 db plazmaferezis kezelést végzünk.
 A DE KK Belgyógyászati Klinika Intenzív Osztályán és Terápiás Aferezis Részlegén évi közel 400 db plazmaferezis kezelést végzünk. Az eseteink túlnyomó részét neuro-, immunológiai eredetű kórképek adják.
A DE KK Belgyógyászati Klinika Intenzív Osztályán és Terápiás Aferezis Részlegén évi közel 400 db plazmaferezis kezelést végzünk. Az eseteink túlnyomó részét neuro-, immunológiai eredetű kórképek adják.
Miben különbözik az autoinflammáció az autoimmunitástól?
 Miben különbözik az autoinflammáció az autoimmunitástól? Dr. Poór Gyula Országos Reumatológiai és Fizioterápiás Intézet Semmelweis Egyetem Reumatológiai és Fizioterápiás Tanszéki Csoport Haladás a reumatológia,
Miben különbözik az autoinflammáció az autoimmunitástól? Dr. Poór Gyula Országos Reumatológiai és Fizioterápiás Intézet Semmelweis Egyetem Reumatológiai és Fizioterápiás Tanszéki Csoport Haladás a reumatológia,
Klinikai Immunológiai Interdiszciplináris Fórum II. (KIIF)
 Klinikai Immunológiai Interdiszciplináris Fórum II. (KIIF) 2011.11.10 2011.11.12. Hotel Divinus, Debrecen Főszervező: Prof. Dr. Zeher Margit A Magyar Allergológiai és Klinikai Immunológiai Társaság és
Klinikai Immunológiai Interdiszciplináris Fórum II. (KIIF) 2011.11.10 2011.11.12. Hotel Divinus, Debrecen Főszervező: Prof. Dr. Zeher Margit A Magyar Allergológiai és Klinikai Immunológiai Társaság és
Immunológia I. 4. előadás. Kacskovics Imre
 Immunológia I. 4. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán 3.2. ábra A hemopoetikus őssejt aszimmetrikus osztódása 3.3. ábra
Immunológia I. 4. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán 3.2. ábra A hemopoetikus őssejt aszimmetrikus osztódása 3.3. ábra
www.printo.it/pediatric-rheumatology/hu/intro
 www.printo.it/pediatric-rheumatology/hu/intro PAPA Szindróma Verzió 2016 1. MI A PAPA SZINDRÓMA 1.1 Mi ez? A PAPA a pyogen arthritis, pyoderma gangrenosum és acne" (gennykeltő ízületi gyulladás, üszkös
www.printo.it/pediatric-rheumatology/hu/intro PAPA Szindróma Verzió 2016 1. MI A PAPA SZINDRÓMA 1.1 Mi ez? A PAPA a pyogen arthritis, pyoderma gangrenosum és acne" (gennykeltő ízületi gyulladás, üszkös
IMMUNOLÓGIA VILÁGNAP 2012. április 26 Prof. Dr. Dankó Katalin DEOEC III. Belklinika Klinikai Immunológiai Tanszék
 A reumatológiai/gyulladásos betegségek felismerése és szövődményei IMMUNOLÓGIA VILÁGNAP 2012. április 26 Prof. Dr. Dankó Katalin DEOEC III. Belklinika Klinikai Immunológiai Tanszék Gyulladásos betegségek
A reumatológiai/gyulladásos betegségek felismerése és szövődményei IMMUNOLÓGIA VILÁGNAP 2012. április 26 Prof. Dr. Dankó Katalin DEOEC III. Belklinika Klinikai Immunológiai Tanszék Gyulladásos betegségek
A psoriasis kezelése kórházunkban: eredményeink, céljaink. Dr. Hortobágyi Judit
 A psoriasis kezelése kórházunkban: eredményeink, céljaink Dr. Hortobágyi Judit Psoriasis vulgaris Öröklött hajlamon alapuló, krónikus, gyulladásos bőrbetegség Gyakorisága Európában 2-3% Magyarországon
A psoriasis kezelése kórházunkban: eredményeink, céljaink Dr. Hortobágyi Judit Psoriasis vulgaris Öröklött hajlamon alapuló, krónikus, gyulladásos bőrbetegség Gyakorisága Európában 2-3% Magyarországon
A T sejt receptor (TCR) heterodimer
 Immunbiológia - II A T sejt receptor (TCR) heterodimer 1 kötőhely lánc lánc 14. kromoszóma 7. kromoszóma V V C C EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL lánc: VJ régió lánc: VDJ régió Nincs szomatikus
Immunbiológia - II A T sejt receptor (TCR) heterodimer 1 kötőhely lánc lánc 14. kromoszóma 7. kromoszóma V V C C EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL lánc: VJ régió lánc: VDJ régió Nincs szomatikus
Allergia immunológiája 2012.
 Allergia immunológiája 2012. AZ IMMUNVÁLASZ SZEREPLŐI BIOLÓGIAI MEGKÖZELÍTÉS Az immunrendszer A fő ellenfelek /ellenségek/ Limfociták, makrofágok antitestek, stb külső és belső élősködők (fertőzés, daganat)
Allergia immunológiája 2012. AZ IMMUNVÁLASZ SZEREPLŐI BIOLÓGIAI MEGKÖZELÍTÉS Az immunrendszer A fő ellenfelek /ellenségek/ Limfociták, makrofágok antitestek, stb külső és belső élősködők (fertőzés, daganat)
www.pediatric-rheumathology.printo.it
 www.pediatric-rheumathology.printo.it GENETIKAI ANOMÁLIÁVAL (örökletes rendellenességgel) KAPCSOLATOS VISSZATÉRŐ LÁZAK Általános bevezetés A legújabb kutatási eredmények tisztán kimutatták, hogy néhány
www.pediatric-rheumathology.printo.it GENETIKAI ANOMÁLIÁVAL (örökletes rendellenességgel) KAPCSOLATOS VISSZATÉRŐ LÁZAK Általános bevezetés A legújabb kutatási eredmények tisztán kimutatták, hogy néhány
Kérdőív. Családban előforduló egyéb betegségek: A MAGYAR HASNYÁLMIRIGY MUNKACSOPORT ÉS AZ INTERNATIONAL ASSOCIATION OF PANCREATOLOGY KÖZÖS VIZSGÁLATA
 1. Személyes adatok Kérdőív Név:. Születési dátum:.. KÓRHÁZ TAJ szám:... Nem: Rassz: férfi / nő indiai / ázsiai / fehér / fekete (a megfelelő aláhúzandó) ORVOS Képes-e a gyermek válaszolni a panaszaira,
1. Személyes adatok Kérdőív Név:. Születési dátum:.. KÓRHÁZ TAJ szám:... Nem: Rassz: férfi / nő indiai / ázsiai / fehér / fekete (a megfelelő aláhúzandó) ORVOS Képes-e a gyermek válaszolni a panaszaira,
www.printo.it/pediatric-rheumatology/hu/intro
 www.printo.it/pediatric-rheumatology/hu/intro Blau-szindróma Verzió 2016 1. MI A BLAU-SZINDRÓMA/FIATALKORI SZARKOIDÓZIS 1.1 Mi ez? A Blau-szindróma genetikai betegség. A betegeknél egyszerre lép fel bőrkiütés,
www.printo.it/pediatric-rheumatology/hu/intro Blau-szindróma Verzió 2016 1. MI A BLAU-SZINDRÓMA/FIATALKORI SZARKOIDÓZIS 1.1 Mi ez? A Blau-szindróma genetikai betegség. A betegeknél egyszerre lép fel bőrkiütés,
A juvenilis idiopathias arthritis diagnosztikájának és kezelésének finanszírozási protokollja
 A juvenilis idiopathias arthritis diagnosztikájának és kezelésének finanszírozási protokollja (finanszírozási eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési
A juvenilis idiopathias arthritis diagnosztikájának és kezelésének finanszírozási protokollja (finanszírozási eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési
1. ESET DIAGNÓZIS: LYMPHADENITIS MESENTERIALIS. 16 éves nő: görcsös hasi fájdalom, hányinger, hányás, vizes hasmenés, collaptiform rosszullét
 1. ESET 16 éves nő: görcsös hasi fájdalom, hányinger, hányás, vizes hasmenés, collaptiform rosszullét Sebészeti osztály hasi UH: bélfal ödéma, ascites konzervatív kezelés DIAGNÓZIS: LYMPHADENITIS MESENTERIALIS
1. ESET 16 éves nő: görcsös hasi fájdalom, hányinger, hányás, vizes hasmenés, collaptiform rosszullét Sebészeti osztály hasi UH: bélfal ödéma, ascites konzervatív kezelés DIAGNÓZIS: LYMPHADENITIS MESENTERIALIS
(1) A T sejtek aktiválása (2) Az ön reaktív T sejtek toleranciája. α lánc. β lánc. V α. V β. C β. C α.
 Immunbiológia II A T sejt receptor () heterodimer α lánc kötőhely β lánc 14. kromoszóma 7. kromoszóma 1 V α V β C α C β EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL αlánc: VJ régió β lánc: VDJ régió Nincs
Immunbiológia II A T sejt receptor () heterodimer α lánc kötőhely β lánc 14. kromoszóma 7. kromoszóma 1 V α V β C α C β EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL αlánc: VJ régió β lánc: VDJ régió Nincs
Immunológia I. 2. előadás. Kacskovics Imre (imre.kacskovics@ttk.elte.hu)
 Immunológia I. 2. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) Az immunválasz kialakulása A veleszületett és az adaptív immunválasz összefonódása A veleszületett immunválasz mechanizmusai A veleszületett
Immunológia I. 2. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) Az immunválasz kialakulása A veleszületett és az adaptív immunválasz összefonódása A veleszületett immunválasz mechanizmusai A veleszületett
A rotavírus a gyomor és a belek fertőzését előidéző vírus, amely súlyos gyomor-bélhurutot okozhat.
 A rotavírus a gyomor és a belek fertőzését előidéző vírus, amely súlyos gyomor-bélhurutot okozhat. A rotavírus az egyik leggyakoribb okozója a súlyos hasmenésnek csecsemő és kisdedkorban. Évente világszerte
A rotavírus a gyomor és a belek fertőzését előidéző vírus, amely súlyos gyomor-bélhurutot okozhat. A rotavírus az egyik leggyakoribb okozója a súlyos hasmenésnek csecsemő és kisdedkorban. Évente világszerte
Periodikus láz Aftózus Faringitisszel és Adenitisszel (PFAPA)
 www.printo.it/pediatric-rheumatology/hu/intro Periodikus láz Aftózus Faringitisszel és Adenitisszel (PFAPA) Verzió 2016 1. MI A PFAPA 1.1 Mi ez? A PFAPA a periodikus láz adenitisszel, faringitisszel és
www.printo.it/pediatric-rheumatology/hu/intro Periodikus láz Aftózus Faringitisszel és Adenitisszel (PFAPA) Verzió 2016 1. MI A PFAPA 1.1 Mi ez? A PFAPA a periodikus láz adenitisszel, faringitisszel és
Gyermekkori autoinflammatorikus kórképek, szisztémás JIA
 HALADÁS A REUMATOLÓGIA, IMMUNOLÓGIA ÉS OSTEOLÓGIA TERÜLETÉN 2015-2017 Gyermekkori autoinflammatorikus kórképek, szisztémás JIA Dr. Orbán Ilonka ORFI Az előadást a Novartis Hungária Kft. támogatta. Az előadás
HALADÁS A REUMATOLÓGIA, IMMUNOLÓGIA ÉS OSTEOLÓGIA TERÜLETÉN 2015-2017 Gyermekkori autoinflammatorikus kórképek, szisztémás JIA Dr. Orbán Ilonka ORFI Az előadást a Novartis Hungária Kft. támogatta. Az előadás
Az agy betegségeinek molekuláris biológiája. 1. Prion betegség 2. Trinukleotid ripít betegségek 3. ALS 4. Parkinson kór 5.
 Az agy betegségeinek molekuláris biológiája 1. Prion betegség 2. Trinukleotid ripít betegségek 3. ALS 4. Parkinson kór 5. Alzheimer kór 28 Prion betegség A prion betegség fertőző formáját nem egy genetikai
Az agy betegségeinek molekuláris biológiája 1. Prion betegség 2. Trinukleotid ripít betegségek 3. ALS 4. Parkinson kór 5. Alzheimer kór 28 Prion betegség A prion betegség fertőző formáját nem egy genetikai
III./5. GIST. Bevezetés. A fejezet felépítése. A.) Panaszok. B.) Anamnézis. Pápai Zsuzsanna
 III./5. GIST Pápai Zsuzsanna A fejezet célja: a GIST daganatok epidemiológiájának, tüneteinek, diagnosztikájának valamint, kezelési lehetőségeinek áttekintése egy beteg esetének bemutatásán keresztül.
III./5. GIST Pápai Zsuzsanna A fejezet célja: a GIST daganatok epidemiológiájának, tüneteinek, diagnosztikájának valamint, kezelési lehetőségeinek áttekintése egy beteg esetének bemutatásán keresztül.
BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA I. RHEUMATOID ARTHRITIS. origamigroup. www.origami.co.hu
 BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA I. RHEUMATOID ARTHRITIS origamigroup www.origami.co.hu I. Rheumatoid arthritis Sokat hallunk napjainkban az immunrendszernek az egészség
BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA I. RHEUMATOID ARTHRITIS origamigroup www.origami.co.hu I. Rheumatoid arthritis Sokat hallunk napjainkban az immunrendszernek az egészség
III./3.2.3.3. Egyes dystonia szindrómák. III./3.2.3.3.1. Blepharospasmus
 III./3.2.3.3. Egyes dystonia szindrómák III./3.2.3.3.1. Blepharospasmus A blepharospasmus jellemzője a szemrést záró izomzat (m. orbicularis oculi) tartós vagy intermittáló, kétoldali akaratlan kontrakciója.
III./3.2.3.3. Egyes dystonia szindrómák III./3.2.3.3.1. Blepharospasmus A blepharospasmus jellemzője a szemrést záró izomzat (m. orbicularis oculi) tartós vagy intermittáló, kétoldali akaratlan kontrakciója.
Dengue-láz. Dr. Szabó György Pócsmegyer
 Dengue-láz Dr. Szabó György Pócsmegyer Történelem Az ókori Kínában leírták. 1906-ban igazolták, hogy szúnyog terjeszti a betegséget. 1907-ben igazolták, hogy vírus. A II. világháború után kezdett megvadulni
Dengue-láz Dr. Szabó György Pócsmegyer Történelem Az ókori Kínában leírták. 1906-ban igazolták, hogy szúnyog terjeszti a betegséget. 1907-ben igazolták, hogy vírus. A II. világháború után kezdett megvadulni
Henoch Schönlein Purpura
 www.printo.it/pediatric-rheumatology/hu/intro Henoch Schönlein Purpura Verzió 2016 1. MI A HENOCH SCHÖNLEIN PURPURA 1.1 Mi ez? A Henoch Schönlein purpura (HSP) a nagyon kis erek (hajszálerek) gyulladásával
www.printo.it/pediatric-rheumatology/hu/intro Henoch Schönlein Purpura Verzió 2016 1. MI A HENOCH SCHÖNLEIN PURPURA 1.1 Mi ez? A Henoch Schönlein purpura (HSP) a nagyon kis erek (hajszálerek) gyulladásával
Reumás láz és sztreptokokkusz-fertőzés utáni reaktív artritisz
 www.printo.it/pediatric-rheumatology/hu/intro Reumás láz és sztreptokokkusz-fertőzés utáni reaktív artritisz Verzió 2016 1. MI A REUMÁS LÁZ 1.1 Mi ez? A reumás láz nevű betegséget a sztreptokokkusz baktérium
www.printo.it/pediatric-rheumatology/hu/intro Reumás láz és sztreptokokkusz-fertőzés utáni reaktív artritisz Verzió 2016 1. MI A REUMÁS LÁZ 1.1 Mi ez? A reumás láz nevű betegséget a sztreptokokkusz baktérium
Gyermekkori Spondilartritisz/Entezitisszel Összefüggő Artritisz (SPA-ERA)
 www.printo.it/pediatric-rheumatology/hu/intro Gyermekkori Spondilartritisz/Entezitisszel Összefüggő Artritisz (SPA-ERA) Verzió 2016 1. MI A GYERMEKKORI SPONDILARTRITISZ/ENTEZITISSZEL ÖSSZEFÜGGŐ ARTRITISZ
www.printo.it/pediatric-rheumatology/hu/intro Gyermekkori Spondilartritisz/Entezitisszel Összefüggő Artritisz (SPA-ERA) Verzió 2016 1. MI A GYERMEKKORI SPONDILARTRITISZ/ENTEZITISSZEL ÖSSZEFÜGGŐ ARTRITISZ
Hepatitis C vírus és cryoglobulinaemia
 Hepatitis C vírus és cryoglobulinaemia Dr Petrovicz Edina 2012.11.10. ESZISZL Kh. és Rendelőintézet Hepatitis C vírus (HCV) Flaviviridae család Hepacivirus nemzetség egyszálú RNS vírus Choo és Kuo 1989.
Hepatitis C vírus és cryoglobulinaemia Dr Petrovicz Edina 2012.11.10. ESZISZL Kh. és Rendelőintézet Hepatitis C vírus (HCV) Flaviviridae család Hepacivirus nemzetség egyszálú RNS vírus Choo és Kuo 1989.
GYERMEK-TÜDŐGYÓGYÁSZAT
 GYERMEK-TÜDŐGYÓGYÁSZAT I. 1. Légutak és a tüdő fejlődése 2. Légzőrendszer élettani működése 3. Újszülöttkori légzészavarok 4. Bronchopulmonalis dysplasia 5. A gége veleszületett és szerzett rendellenességei
GYERMEK-TÜDŐGYÓGYÁSZAT I. 1. Légutak és a tüdő fejlődése 2. Légzőrendszer élettani működése 3. Újszülöttkori légzészavarok 4. Bronchopulmonalis dysplasia 5. A gége veleszületett és szerzett rendellenességei
II. Klinikai Immunológiai Interdiszciplináris Fórum (KIIF)
 II. Klinikai Immunológiai Interdiszciplináris Fórum (KIIF) 2011.11.10 2011.11.12. Hotel Divinus, Debrecen (Debrecen, Nagyerdei krt. 1.) Főszervező: A Magyar Allergológiai és Klinikai Immunológiai Társaság
II. Klinikai Immunológiai Interdiszciplináris Fórum (KIIF) 2011.11.10 2011.11.12. Hotel Divinus, Debrecen (Debrecen, Nagyerdei krt. 1.) Főszervező: A Magyar Allergológiai és Klinikai Immunológiai Társaság
Laktózfelszívódási zavar egy gyakori probléma gyakorlati vonatkozásai
 Laktózfelszívódási zavar egy gyakori probléma gyakorlati vonatkozásai Karoliny Anna dr., B.Kovács Judit dr. Gasztroenterológiai és Nephrológiai Osztály, Heim Pál Gyermekkórház, Budapest (Igazgató: Nagy
Laktózfelszívódási zavar egy gyakori probléma gyakorlati vonatkozásai Karoliny Anna dr., B.Kovács Judit dr. Gasztroenterológiai és Nephrológiai Osztály, Heim Pál Gyermekkórház, Budapest (Igazgató: Nagy
Súlyos infekciók differenciálása a rendelőben. Dr. Fekete Ferenc Heim Pál Gyermekkórház Madarász utcai Gyermekkórháza
 Súlyos infekciók differenciálása a rendelőben Dr. Fekete Ferenc Heim Pál Gyermekkórház Madarász utcai Gyermekkórháza Miért probléma a lázas gyermek a rendelőben? nem beteg - súlyos beteg otthon ellátható
Súlyos infekciók differenciálása a rendelőben Dr. Fekete Ferenc Heim Pál Gyermekkórház Madarász utcai Gyermekkórháza Miért probléma a lázas gyermek a rendelőben? nem beteg - súlyos beteg otthon ellátható
A genetikai lelet értelmezése monogénes betegségekben
 A genetikai lelet értelmezése monogénes betegségekben Tory Kálmán Semmelweis Egyetem, I. sz. Gyermekklinika A ~20 ezer fehérje-kódoló gén a 23 pár kromoszómán A kromoszómán található bázisok száma: 250M
A genetikai lelet értelmezése monogénes betegségekben Tory Kálmán Semmelweis Egyetem, I. sz. Gyermekklinika A ~20 ezer fehérje-kódoló gén a 23 pár kromoszómán A kromoszómán található bázisok száma: 250M
Szisztémás Lupusz Eritematózusz (SLE)
 www.printo.it/pediatric-rheumatology/hu/intro Szisztémás Lupusz Eritematózusz (SLE) Verzió 2016 2. DIAGNÓZIS ÉS TERÁPIA 2.1 Hogyan diagnosztizálható? Az SLE diagnózisa a panaszok (mint pl. fájdalom), a
www.printo.it/pediatric-rheumatology/hu/intro Szisztémás Lupusz Eritematózusz (SLE) Verzió 2016 2. DIAGNÓZIS ÉS TERÁPIA 2.1 Hogyan diagnosztizálható? Az SLE diagnózisa a panaszok (mint pl. fájdalom), a
Immunológia 4. A BCR diverzitás kialakulása
 Immunológia 4. A BCR diverzitás kialakulása 2017. október 4. Bajtay Zsuzsa A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja
Immunológia 4. A BCR diverzitás kialakulása 2017. október 4. Bajtay Zsuzsa A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja
Immunológia alapjai előadás. Az immunológiai felismerés molekuláris összetevői.
 Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B- sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B- sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
PDF Compressor Pro. Dr Petrovicz Edina.április.
 Dr Petrovicz Edina.április. Az immunrendszer feladata Saját és idegen felismerése Kórokozó mikroorganizmusok elleni védekezés A szervezet saját, megváltozott sejtjeinek a felismerése, eliminálása Az immunrendszer
Dr Petrovicz Edina.április. Az immunrendszer feladata Saját és idegen felismerése Kórokozó mikroorganizmusok elleni védekezés A szervezet saját, megváltozott sejtjeinek a felismerése, eliminálása Az immunrendszer
17.2. ábra Az immunválasz kialakulása és lezajlása patogén hatására
 11. 2016. nov 30. 17.2. ábra Az immunválasz kialakulása és lezajlása patogén hatására 17.3. ábra A sejtközötti térben és a sejten belül élő és szaporodó kórokozók ellen kialakuló védekezési mechanizmusok
11. 2016. nov 30. 17.2. ábra Az immunválasz kialakulása és lezajlása patogén hatására 17.3. ábra A sejtközötti térben és a sejten belül élő és szaporodó kórokozók ellen kialakuló védekezési mechanizmusok
MAGYOT évi Tudományos Szimpóziuma Május 5-6, Budapest
 MAGYOT 2017. évi Tudományos Szimpóziuma Május 5-6, Budapest A petefészekrákok kezelésében nem régen került bevezetésre egy újabb fenntartó kezelés BRCA mutációt hordozó (szomatikus vagy germinális) magas
MAGYOT 2017. évi Tudományos Szimpóziuma Május 5-6, Budapest A petefészekrákok kezelésében nem régen került bevezetésre egy újabb fenntartó kezelés BRCA mutációt hordozó (szomatikus vagy germinális) magas
Újszülöttkori görcsök. Dr Szabó Miklós PhD egyetemi docens Április 7. Bókay délután
 Újszülöttkori görcsök Dr Szabó Miklós PhD egyetemi docens 2016. Április 7. Bókay délután BNO-kód : P90H0 Hivatalos név: Újszülöttkori görcsök Csoport: Újszülöttkori görcsök, A perinatális szakban keletkező
Újszülöttkori görcsök Dr Szabó Miklós PhD egyetemi docens 2016. Április 7. Bókay délután BNO-kód : P90H0 Hivatalos név: Újszülöttkori görcsök Csoport: Újszülöttkori görcsök, A perinatális szakban keletkező
Immunológia alapjai előadás. Az immunológiai felismerés molekuláris összetevői
 Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői Az antigén fogalma. Antitestek, T- és B- sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői Az antigén fogalma. Antitestek, T- és B- sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Atopiás dermatitis Gáspár Krisztián
 Atopiás dermatitis Gáspár Krisztián DE OEC Bőrgyógyászati Klinika Bőrgyógyászati Allergológia Tanszék Atopiás dermatitis Krónikus gyulladással járó, relapsusokat mutató nem fertőző bőrbetegség. Bőrszárazság,
Atopiás dermatitis Gáspár Krisztián DE OEC Bőrgyógyászati Klinika Bőrgyógyászati Allergológia Tanszék Atopiás dermatitis Krónikus gyulladással járó, relapsusokat mutató nem fertőző bőrbetegség. Bőrszárazság,
Együttműködési lehetőségek spondyloarthritises betegek kezelésében
 Együttműködési lehetőségek spondyloarthritises betegek kezelésében A spondyloarthritis (SpA) fogalma Hasonló tünetek: spondyloarthritis, extraartikuláris manifesztációk (EAM), sacroileitis Nem differenciált
Együttműködési lehetőségek spondyloarthritises betegek kezelésében A spondyloarthritis (SpA) fogalma Hasonló tünetek: spondyloarthritis, extraartikuláris manifesztációk (EAM), sacroileitis Nem differenciált
Dr. SZEKANECZ Éva, dr. GONDA Andrea. DE OEC Onkológiai Intézet IV. Db. Bőrgyógyászati Napok, 2012. Október 13.
 Dr. SZEKANECZ Éva, dr. GONDA Andrea DE OEC Onkológiai Intézet IV. Db. Bőrgyógyászati Napok, 2012. Október 13. ma már a legtöbb intézetben elérhetőek a biológiai terápiák bár eredményesnek bizonyultak a
Dr. SZEKANECZ Éva, dr. GONDA Andrea DE OEC Onkológiai Intézet IV. Db. Bőrgyógyászati Napok, 2012. Október 13. ma már a legtöbb intézetben elérhetőek a biológiai terápiák bár eredményesnek bizonyultak a
www.printo.it/pediatric-rheumatology/hu/intro
 www.printo.it/pediatric-rheumatology/hu/intro MAJEED Verzió 2016 1. MI A MAJEED 1.1 Mi ez? A Majeed-szindróma egy ritka genetikai betegség. Az érintett gyermekek Krónikus Rekurrens Multifokális Oszteomielitiszben
www.printo.it/pediatric-rheumatology/hu/intro MAJEED Verzió 2016 1. MI A MAJEED 1.1 Mi ez? A Majeed-szindróma egy ritka genetikai betegség. Az érintett gyermekek Krónikus Rekurrens Multifokális Oszteomielitiszben
Gyermekkori Idiopátiás Artritisz
 www.printo.it/pediatric-rheumatology/hu/intro Gyermekkori Idiopátiás Artritisz Verzió 2016 3. DIAGNÓZIS ÉS TERÁPIA 3.1 Milyen laboratóriumi vizsgálatok szükségesek? A diagnóziskor bizonyos laboratóriumi
www.printo.it/pediatric-rheumatology/hu/intro Gyermekkori Idiopátiás Artritisz Verzió 2016 3. DIAGNÓZIS ÉS TERÁPIA 3.1 Milyen laboratóriumi vizsgálatok szükségesek? A diagnóziskor bizonyos laboratóriumi
INTRACELLULÁRIS PATOGÉNEK
 INTRACELLULÁRIS PATOGÉNEK Bácsi Attila, PhD, DSc etele@med.unideb.hu Debreceni Egyetem, ÁOK Immunológiai Intézet INTRACELLULÁRIS BAKTÉRIUMOK ELLENI IMMUNVÁLASZ Példák intracelluláris baktériumokra Intracelluláris
INTRACELLULÁRIS PATOGÉNEK Bácsi Attila, PhD, DSc etele@med.unideb.hu Debreceni Egyetem, ÁOK Immunológiai Intézet INTRACELLULÁRIS BAKTÉRIUMOK ELLENI IMMUNVÁLASZ Példák intracelluláris baktériumokra Intracelluláris
Szisztémás autoimmun betegségek: a kezelés és gondozás elvei Dr Szűcs Gabriella
 Szisztémás autoimmun betegségek: a kezelés és gondozás elvei Dr Szűcs Gabriella DEOEC Reumatológiai Tanszék Szisztémás autoimmun betegségek Tünetek diagnózis Szervi manifesztációk, stádium felmérése Prognosztikai
Szisztémás autoimmun betegségek: a kezelés és gondozás elvei Dr Szűcs Gabriella DEOEC Reumatológiai Tanszék Szisztémás autoimmun betegségek Tünetek diagnózis Szervi manifesztációk, stádium felmérése Prognosztikai
 www.printo.it/pediatric-rheumatology/hu/intro Gyógyszeres Kezelés Verzió 2016 13. Biológiai szerek Az elmúlt néhány évben új perspektívákat nyitottak a biológiai szereknek nevezett hatóanyagok. Az orvosok
www.printo.it/pediatric-rheumatology/hu/intro Gyógyszeres Kezelés Verzió 2016 13. Biológiai szerek Az elmúlt néhány évben új perspektívákat nyitottak a biológiai szereknek nevezett hatóanyagok. Az orvosok
Anamnézis, fizikális vizsgálat májbetegségekben
 Anamnézis, fizikális vizsgálat májbetegségekben Dr. Vincze Áron egyetemi docens PTE KK I.sz. BelgyógyászaA Klinika Hepatológia szakvizsga- előkészítő tanfolyam, Balatonfüred 2011. március 8-10. Májbetegségek
Anamnézis, fizikális vizsgálat májbetegségekben Dr. Vincze Áron egyetemi docens PTE KK I.sz. BelgyógyászaA Klinika Hepatológia szakvizsga- előkészítő tanfolyam, Balatonfüred 2011. március 8-10. Májbetegségek
III./2.3.: Klinikai jellegzetességek, tünetek. III./2.3.1.: Migrén
 III./2.3.: Klinikai jellegzetességek, tünetek III./2.3.1.: Migrén Egyes felmérések szerint a migrén az orvosok által leggyakrabban látott neurológiai kórkép. Nagy epidemiológiai vizsgálatok szerint a migrén
III./2.3.: Klinikai jellegzetességek, tünetek III./2.3.1.: Migrén Egyes felmérések szerint a migrén az orvosok által leggyakrabban látott neurológiai kórkép. Nagy epidemiológiai vizsgálatok szerint a migrén
Epilepszia és görcsállapotok gyermekkorban. Fogarasi András. Bethesda Gyermekkórház, Budapest. Gyermekgyógyászati kötelező szinten tartó tanfolyam
 Epilepszia és görcsállapotok gyermekkorban Fogarasi András Bethesda Gyermekkórház, Budapest Gyermekgyógyászati kötelező szinten tartó tanfolyam Budapest, 2013. november 22. fog.andras@gmail.com Tel: 4222-875
Epilepszia és görcsállapotok gyermekkorban Fogarasi András Bethesda Gyermekkórház, Budapest Gyermekgyógyászati kötelező szinten tartó tanfolyam Budapest, 2013. november 22. fog.andras@gmail.com Tel: 4222-875
Veleszületett és szerzett immundefektusok. Decsi Tamás Gyermekgyógyászati Klinika
 Veleszületett és szerzett immundefektusok Decsi Tamás Gyermekgyógyászati Klinika Képzési célkitűzéek Alapelvek Az immundefektus klinikai gyanújelei Veleszületett immundefektusok: Szelektív IgA-hiány Primér
Veleszületett és szerzett immundefektusok Decsi Tamás Gyermekgyógyászati Klinika Képzési célkitűzéek Alapelvek Az immundefektus klinikai gyanújelei Veleszületett immundefektusok: Szelektív IgA-hiány Primér
Májátültetés és veleszületett anyagcsere betegségek. Dezsőfi Antal
 Májátültetés és veleszületett anyagcsere betegségek Dezsőfi Antal Öröklődő anyagcsere betegségek Az öröklődő anyagcsere betegségek döntő többsége a ritka betegségek közé tartozik. Ritka betegség, prevalencia
Májátültetés és veleszületett anyagcsere betegségek Dezsőfi Antal Öröklődő anyagcsere betegségek Az öröklődő anyagcsere betegségek döntő többsége a ritka betegségek közé tartozik. Ritka betegség, prevalencia
Gyermekkori IBD jellegzetességei. Dr. Tomsits Erika SE II. sz. Gyermekklinika
 Gyermekkori IBD jellegzetességei Dr. Tomsits Erika SE II. sz. Gyermekklinika Gyulladásos bélbetegség feltételezhetı Hasmenés >4 hét >2 székürítés naponta Folyékony/pépes széklet Crohn-betegség? Colitis
Gyermekkori IBD jellegzetességei Dr. Tomsits Erika SE II. sz. Gyermekklinika Gyulladásos bélbetegség feltételezhetı Hasmenés >4 hét >2 székürítés naponta Folyékony/pépes széklet Crohn-betegség? Colitis
A LABORBAN ELÉRHETŐ GYORSTESZTEK ÉRTELMEZÉSE
 A LABORBAN ELÉRHETŐ GYORSTESZTEK ÉRTELMEZÉSE Dr. Kiss Virág 2016.11.20 A LABORBAN ELÉRHETŐ GYORSTESZTEK: 1. Clostridium difficile gyorsteszt 2. RSV gyorsteszt 3. Influenza gyorsteszt 4. H.pylori Ag gyorsteszt
A LABORBAN ELÉRHETŐ GYORSTESZTEK ÉRTELMEZÉSE Dr. Kiss Virág 2016.11.20 A LABORBAN ELÉRHETŐ GYORSTESZTEK: 1. Clostridium difficile gyorsteszt 2. RSV gyorsteszt 3. Influenza gyorsteszt 4. H.pylori Ag gyorsteszt
4. A humorális immunválasz október 12.
 4. A humorális immunválasz 2016. október 12. A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja a limfocitát A keletkező
4. A humorális immunválasz 2016. október 12. A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja a limfocitát A keletkező
Az intravénás immunglobulin hatásmechanizmusa és alkalmazási köre a klinikai immunológiában
 Az intravénás immunglobulin hatásmechanizmusa és alkalmazási köre a klinikai immunológiában Dr. Bazsó Anna ORFI Klinikai Immunológiai, Felnőtt-és Gyermekreumatológiai Osztály Haladás a reumatológia, immunológia
Az intravénás immunglobulin hatásmechanizmusa és alkalmazási köre a klinikai immunológiában Dr. Bazsó Anna ORFI Klinikai Immunológiai, Felnőtt-és Gyermekreumatológiai Osztály Haladás a reumatológia, immunológia
ANAFILAXIA. Herjavecz Irén. Országos Korányi Tbc és Pulmonológiai Intézet
 ANAFILAXIA Herjavecz Irén Országos Korányi Tbc és Pulmonológiai Intézet Allergológiai krízis állapotok Az anafilaxia, rovarméreg allergia és herediter angioneuroticus oedema diagnosztikája és kezelése
ANAFILAXIA Herjavecz Irén Országos Korányi Tbc és Pulmonológiai Intézet Allergológiai krízis állapotok Az anafilaxia, rovarméreg allergia és herediter angioneuroticus oedema diagnosztikája és kezelése
Familiáris mediterrán láz
 www.printo.it/pediatric-rheumatology/hu/intro Familiáris mediterrán láz Verzió 2016 1. MI AZ FMF 1.1 Mi ez? A familiáris mediterrán láz (Familial Mediterranean Fever, FMF) egy genetikailag öröklődő betegség.
www.printo.it/pediatric-rheumatology/hu/intro Familiáris mediterrán láz Verzió 2016 1. MI AZ FMF 1.1 Mi ez? A familiáris mediterrán láz (Familial Mediterranean Fever, FMF) egy genetikailag öröklődő betegség.
Colorectalis carcinomában szenvedő betegek postoperatív öt éves követése
 Colorectalis carcinomában szenvedő betegek postoperatív öt éves követése Kegyes Lászlóné 1, Némethné Lesó Zita 1, Varga Sándor Attiláné 1, Barna T. Katalin 1, Rombauer Edit 2 Dunaújvárosi Prodia Központi
Colorectalis carcinomában szenvedő betegek postoperatív öt éves követése Kegyes Lászlóné 1, Némethné Lesó Zita 1, Varga Sándor Attiláné 1, Barna T. Katalin 1, Rombauer Edit 2 Dunaújvárosi Prodia Központi
Esetbemutatás. Dr. Iván Mária Uzsoki Kórház 2013.11.07.
 Esetbemutatás Dr. Iván Mária Uzsoki Kórház 2013.11.07. Esetbemutatás I. 26 éves férfi 6 héttel korábban bal oldali herében elváltozást észlelt,majd 3 héttel később haemoptoe miatt kereste fel orvosát antibiotikumos
Esetbemutatás Dr. Iván Mária Uzsoki Kórház 2013.11.07. Esetbemutatás I. 26 éves férfi 6 héttel korábban bal oldali herében elváltozást észlelt,majd 3 héttel később haemoptoe miatt kereste fel orvosát antibiotikumos
A molekuláris genetikai vizsgálatok jelentősége veleszületett immunhiány betegségekben
 293 Maródi László A molekuláris genetikai vizsgálatok jelentősége veleszületett immunhiány betegségekben Az első veleszületett immunhiány betegséget, az X-kromoszómához kötött agammaglobulinaemiát 1952-ben
293 Maródi László A molekuláris genetikai vizsgálatok jelentősége veleszületett immunhiány betegségekben Az első veleszületett immunhiány betegséget, az X-kromoszómához kötött agammaglobulinaemiát 1952-ben
Immunológiai módszerek a klinikai kutatásban
 Immunológiai módszerek a klinikai kutatásban 3. előadás Az immunrendszer molekuláris elemei: antigén, ellenanyag, Ig osztályok Az antigén meghatározása Detre László: antitest generátor - Régi meghatározás:
Immunológiai módszerek a klinikai kutatásban 3. előadás Az immunrendszer molekuláris elemei: antigén, ellenanyag, Ig osztályok Az antigén meghatározása Detre László: antitest generátor - Régi meghatározás:
MI ÁLLHAT A FEJFÁJÁS HÁTTERÉBEN? Dr. HégerJúlia, Dr. BeszterczánPéter, Dr. Deák Veronika, Dr. Szörényi Péter, Dr. Tátrai Ottó, Dr.
 MI ÁLLHAT A FEJFÁJÁS HÁTTERÉBEN? Dr. HégerJúlia, Dr. BeszterczánPéter, Dr. Deák Veronika, Dr. Szörényi Péter, Dr. Tátrai Ottó, Dr. Varga Csaba ESET 46 ÉVES FÉRFI Kórelőzmény kezelt hypertonia kivizsgálás
MI ÁLLHAT A FEJFÁJÁS HÁTTERÉBEN? Dr. HégerJúlia, Dr. BeszterczánPéter, Dr. Deák Veronika, Dr. Szörényi Péter, Dr. Tátrai Ottó, Dr. Varga Csaba ESET 46 ÉVES FÉRFI Kórelőzmény kezelt hypertonia kivizsgálás
 HOMEOPÁTIÁVAL ELÉRT EREDMÉNY PSORIASISBAN DR. DÉRER CECILIA HOMEOPATA BAJA II.INTERDISZCIPLINÁRIS KOMPLEMENTER MEDICINA KONGRESSZUS A PSORIASIS GYAKRAN ELŐFORDULÓ BŐRBETEGSÉG. A BETEGEK 5-8 %-A SZENVED
HOMEOPÁTIÁVAL ELÉRT EREDMÉNY PSORIASISBAN DR. DÉRER CECILIA HOMEOPATA BAJA II.INTERDISZCIPLINÁRIS KOMPLEMENTER MEDICINA KONGRESSZUS A PSORIASIS GYAKRAN ELŐFORDULÓ BŐRBETEGSÉG. A BETEGEK 5-8 %-A SZENVED
Tünetmentes gyermek fokozott szérum transzferáz aktivitással. Mit tegyek? Szőnyi László 2012. 2012.május 11. Kávészünet. 2012.
 Tünetmentes gyermek fokozott szérum transzferáz aktivitással. Mit tegyek? Szőnyi László 2012 Miért fokozott szérum transzferáz aktivitás és nem kóros májfunkció? Szérum fokozott ALP aktivitás, fokozott
Tünetmentes gyermek fokozott szérum transzferáz aktivitással. Mit tegyek? Szőnyi László 2012 Miért fokozott szérum transzferáz aktivitás és nem kóros májfunkció? Szérum fokozott ALP aktivitás, fokozott
REUMATOLÓGIA BETEGTÁJÉKOZTATÓ. Sokízületi gyulladás
 REUMATOLÓGIA BETEGTÁJÉKOZTATÓ Reumatoid artitisz Sokízületi gyulladás Mi is az a reuma? A köznyelv a reuma kifejezésen lényegében a mozgásszervi megbetegedéseket érti. A reumatológiai vagy reumás kórképek
REUMATOLÓGIA BETEGTÁJÉKOZTATÓ Reumatoid artitisz Sokízületi gyulladás Mi is az a reuma? A köznyelv a reuma kifejezésen lényegében a mozgásszervi megbetegedéseket érti. A reumatológiai vagy reumás kórképek
B-sejtek szerepe az RA patológiás folyamataiban
 B-sejtek szerepe az RA patológiás folyamataiban Erdei Anna Biológiai Intézet Immunológiai Tanszék Eötvös Loránd Tudományegyetem Immunológiai Tanszék ORFI, Helia, 2015 április 17. RA kialakulása Gary S.
B-sejtek szerepe az RA patológiás folyamataiban Erdei Anna Biológiai Intézet Immunológiai Tanszék Eötvös Loránd Tudományegyetem Immunológiai Tanszék ORFI, Helia, 2015 április 17. RA kialakulása Gary S.
Leukémia (fehérvérûség)
 Leukémia (fehérvérûség) Leukémia - fehérvérûség A leukémia a rosszindulatú rákos megbetegedések azon formája, amely a vérképzõ sejtekbõl indul ki. A leukémia a csontvelõben lévõ éretlen és érettebb vérképzõ
Leukémia (fehérvérûség) Leukémia - fehérvérûség A leukémia a rosszindulatú rákos megbetegedések azon formája, amely a vérképzõ sejtekbõl indul ki. A leukémia a csontvelõben lévõ éretlen és érettebb vérképzõ
A normál human immunglobulin kezelés gyakorlati szempontjai. DE KK BELGYÓGYÁSZATI KLINIKA KLINIKAI IMMUNOLÓGIA TANSZÉK Szabóné Törő Anna
 A normál human immunglobulin kezelés gyakorlati szempontjai DE KK BELGYÓGYÁSZATI KLINIKA KLINIKAI IMMUNOLÓGIA TANSZÉK Szabóné Törő Anna Immunhiányos betegségek Az immunhiányos betegségeket az immunrendszer
A normál human immunglobulin kezelés gyakorlati szempontjai DE KK BELGYÓGYÁSZATI KLINIKA KLINIKAI IMMUNOLÓGIA TANSZÉK Szabóné Törő Anna Immunhiányos betegségek Az immunhiányos betegségeket az immunrendszer
Prof Dr. Pajor Attila Szülész-nőgyógyász, egyetemi tanár AUTOIMMUN BETEGSÉGEK ÉS TERHESSÉG
 Prof Dr. Pajor Attila Szülész-nőgyógyász, egyetemi tanár AUTOIMMUN BETEGSÉGEK ÉS TERHESSÉG Melyik autoimmun betegség érinti a szülőképes nőket? Izületi betegségek : RA, SLE Pajzsmirigy betegségek: Kevert
Prof Dr. Pajor Attila Szülész-nőgyógyász, egyetemi tanár AUTOIMMUN BETEGSÉGEK ÉS TERHESSÉG Melyik autoimmun betegség érinti a szülőképes nőket? Izületi betegségek : RA, SLE Pajzsmirigy betegségek: Kevert
A gyógyszerallergia és. Dr. Lukács Andrea
 A gyógyszerallergia és intolerancia a gyakorlatban Dr. Lukács Andrea AE (Adverseevent) Adverz esemény: adott gyógyszerkészítmény alkalmazása kapcsán jelentkező kellemetlen tünet, amely nem feltétlenül
A gyógyszerallergia és intolerancia a gyakorlatban Dr. Lukács Andrea AE (Adverseevent) Adverz esemény: adott gyógyszerkészítmény alkalmazása kapcsán jelentkező kellemetlen tünet, amely nem feltétlenül
Légzőszervi megbetegedések
 Orrmelléküreg-gyulladás (sinusitis) Légzőszervi megbetegedések Az orr melléküregeinek gyulladása, melyet leggyakrabban baktériumok okoznak. Orrnyálkahártya-gyulladás (rhinitis) Különböző típusú gyulladások
Orrmelléküreg-gyulladás (sinusitis) Légzőszervi megbetegedések Az orr melléküregeinek gyulladása, melyet leggyakrabban baktériumok okoznak. Orrnyálkahártya-gyulladás (rhinitis) Különböző típusú gyulladások
1. A GYÓGYSZER NEVE 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL. 100 mikrogramm flutikazon-propionát (mikronizált) adagonként.
 1. A GYÓGYSZER NEVE Flixotide Diskus 100 mikrogramm/adag adagolt inhalációs por Flixotide Diskus 250 mikrogramm/adag adagolt inhalációs por Flixotide Diskus 500 mikrogramm/adag adagolt inhalációs por 2.
1. A GYÓGYSZER NEVE Flixotide Diskus 100 mikrogramm/adag adagolt inhalációs por Flixotide Diskus 250 mikrogramm/adag adagolt inhalációs por Flixotide Diskus 500 mikrogramm/adag adagolt inhalációs por 2.
Intraoperatív és sürgıs endokrin vizsgálatok. Kıszegi Tamás Pécsi Tudományegyetem Laboratóriumi Medicina Intézet
 Intraoperatív és sürgıs endokrin vizsgálatok Kıszegi Tamás Pécsi Tudományegyetem Laboratóriumi Medicina Intézet Sürgıs vizsgálatok elérhetısége Elvben minden vizsgálat lehet sürgıs! Non-stop elérhetıség
Intraoperatív és sürgıs endokrin vizsgálatok Kıszegi Tamás Pécsi Tudományegyetem Laboratóriumi Medicina Intézet Sürgıs vizsgálatok elérhetısége Elvben minden vizsgálat lehet sürgıs! Non-stop elérhetıség
Spondyloarthritisekhez társuló csontvesztés megelőzésének és kezelésének korszerű szemlélete
 Spondyloarthritisekhez társuló csontvesztés megelőzésének és kezelésének korszerű szemlélete Szántó Sándor DE OEC, Reumatológiai Tanszék 2014.02.05. Szeminárium Szisztémás OP SPA-ban Csigolyatörés SPA-s
Spondyloarthritisekhez társuló csontvesztés megelőzésének és kezelésének korszerű szemlélete Szántó Sándor DE OEC, Reumatológiai Tanszék 2014.02.05. Szeminárium Szisztémás OP SPA-ban Csigolyatörés SPA-s
www.printo.it/pediatric-rheumatology/hu/intro
 www.printo.it/pediatric-rheumatology/hu/intro Behcet-kór Verzió 2016 1. MI A BEHCET-KÓR 1.1 Mi ez? A Behçet-szindróma vagy Behçet-kór (BD) egy szisztémás vaszkulitisz (az egész testre kiterjedő érgyulladás),
www.printo.it/pediatric-rheumatology/hu/intro Behcet-kór Verzió 2016 1. MI A BEHCET-KÓR 1.1 Mi ez? A Behçet-szindróma vagy Behçet-kór (BD) egy szisztémás vaszkulitisz (az egész testre kiterjedő érgyulladás),
Alkohollal kapcsolatos zavarok. Az alkoholbetegség. Általános jellegzetességek
 Alkohollal kapcsolatos zavarok Az alkoholbetegség Az alkoholisták mértéktelen ivók, alkoholfüggőségük olyan szintet ér el, hogy észrevehető mentális zavarokat okoz, károsítja test-lelki egészségüket, interperszonális
Alkohollal kapcsolatos zavarok Az alkoholbetegség Az alkoholisták mértéktelen ivók, alkoholfüggőségük olyan szintet ér el, hogy észrevehető mentális zavarokat okoz, károsítja test-lelki egészségüket, interperszonális
A juvenilis idiopathias arthritis diagnosztikájának és kezelésének finanszírozási protokollja (eljárásrend)
 A juvenilis idiopathias arthritis diagnosztikájának és kezelésének finanszírozási protokollja (eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály
A juvenilis idiopathias arthritis diagnosztikájának és kezelésének finanszírozási protokollja (eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály
Apoptózis. 1. Bevezetés 2. Külső jelút 3. Belső jelút
 Jelutak Apoptózis 1. Bevezetés 2. Külső jelút 3. Belső jelút Apoptózis Sejtmag 1. Kondenzálódó sejtmag apoptózis autofágia nekrózis Lefűződések Összezsugorodás Fragmentálódó sejtmag Apoptotikus test Fagocita
Jelutak Apoptózis 1. Bevezetés 2. Külső jelút 3. Belső jelút Apoptózis Sejtmag 1. Kondenzálódó sejtmag apoptózis autofágia nekrózis Lefűződések Összezsugorodás Fragmentálódó sejtmag Apoptotikus test Fagocita
III. melléklet. Az Alkalmazási előírás és a Betegtájékoztató vonatkozó fejezeteiben szükséges módosítások
 III. melléklet Az Alkalmazási előírás és a Betegtájékoztató vonatkozó fejezeteiben szükséges módosítások Megjegyzés: Ezen alkalmazási előírás, betegtájékoztató és cimkeszöveg a referál eljárás eredményeként
III. melléklet Az Alkalmazási előírás és a Betegtájékoztató vonatkozó fejezeteiben szükséges módosítások Megjegyzés: Ezen alkalmazási előírás, betegtájékoztató és cimkeszöveg a referál eljárás eredményeként
IBD. Dr. Kempler Miklós Semmelweis Egyetem III. Sz. Belgyógyászati Klinika. ÁOK V. évfolyam 2018/2019. tanév I. félév
 IBD Dr. Kempler Miklós Semmelweis Egyetem III. Sz. Belgyógyászati Klinika ÁOK V. évfolyam 2018/2019. tanév I. félév IBD (Inflammatory bowel disease) Idült gyulladásos bélbetegségek Crohn-betegség Colitis
IBD Dr. Kempler Miklós Semmelweis Egyetem III. Sz. Belgyógyászati Klinika ÁOK V. évfolyam 2018/2019. tanév I. félév IBD (Inflammatory bowel disease) Idült gyulladásos bélbetegségek Crohn-betegség Colitis
A keringı tumor markerek klinikai alkalmazásának aktuális kérdései és irányelvei
 A keringı tumor markerek klinikai alkalmazásának aktuális kérdései és irányelvei A TM vizsgálatok alapkérdései A vizsgálatok célja, információértéke? Az alkalmazás területei? Hogyan válasszuk ki az alkalmazott
A keringı tumor markerek klinikai alkalmazásának aktuális kérdései és irányelvei A TM vizsgálatok alapkérdései A vizsgálatok célja, információértéke? Az alkalmazás területei? Hogyan válasszuk ki az alkalmazott
Gyermekkori Spondilartritisz/Entezitisszel Összefüggő Artritisz (SPA-ERA)
 www.printo.it/pediatric-rheumatology/hu/intro Gyermekkori Spondilartritisz/Entezitisszel Összefüggő Artritisz (SPA-ERA) Verzió 2016 1. MI A GYERMEKKORI SPONDILARTRITISZ/ENTEZITISSZEL ÖSSZEFÜGGŐ ARTRITISZ
www.printo.it/pediatric-rheumatology/hu/intro Gyermekkori Spondilartritisz/Entezitisszel Összefüggő Artritisz (SPA-ERA) Verzió 2016 1. MI A GYERMEKKORI SPONDILARTRITISZ/ENTEZITISSZEL ÖSSZEFÜGGŐ ARTRITISZ
Jelutak. Apoptózis. Apoptózis Bevezetés 2. Külső jelút 3. Belső jelút. apoptózis autofágia nekrózis. Sejtmag. Kondenzálódó sejtmag
 Jelutak Apoptózis 1. Bevezetés 2. Külső jelút 3. Belső jelút Apoptózis Sejtmag Kondenzálódó sejtmag 1. autofágia nekrózis Lefűződések Összezsugorodás Fragmentálódó sejtmag Apoptotikus test Fagocita bekebelezi
Jelutak Apoptózis 1. Bevezetés 2. Külső jelút 3. Belső jelút Apoptózis Sejtmag Kondenzálódó sejtmag 1. autofágia nekrózis Lefűződések Összezsugorodás Fragmentálódó sejtmag Apoptotikus test Fagocita bekebelezi
Immunológia alapjai előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B-sejt receptorok:
 Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B-sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B-sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
24 ÓRA ALATT MINDENT MEGVÁLTOZTATHAT!
 A meningococcus B okozta gennyes agyhártyagyulladás és vérmérgezés 24 ÓRA ALATT MINDENT MEGVÁLTOZTATHAT! Védje meg gyermekét a MENINGOCOCCUS B okozta betegség súlyos szövődményeitől! MI AZ AGYHÁRTYAGYULLADÁS
A meningococcus B okozta gennyes agyhártyagyulladás és vérmérgezés 24 ÓRA ALATT MINDENT MEGVÁLTOZTATHAT! Védje meg gyermekét a MENINGOCOCCUS B okozta betegség súlyos szövődményeitől! MI AZ AGYHÁRTYAGYULLADÁS
