SYSTEMS CHEMISTRY. Mucsi Zoltán SERVIER
|
|
|
- Ede Nemes
- 5 évvel ezelőtt
- Látták:
Átírás
1 SYSTEMS CEMISTY Mucsi Zoltán SEVIE
2 MLECULA EGIEEIG ewton egyenlet Szabályok, képletek Schrödinger egyenlet? Szabályok, képletek 2
3 apíron: Valóság: SL 3 SL 1 SL 3 B SL SL 3 B 1 SL 2 SL 3 SL B 1 2 SL 3 SL B 1 2 SL 3 SL B 1 2 SL 3 SL B 1 2 A SL 3 SL B SL 2 1 A 3 SL 1 A B SL 2 A
4 Kémiai eakció SYSTEMS CEMISTY eactant roduct Entalpia dekonvolució 2 ldószer Aromaticity Belső energia Amidicity Térbeli gátlás -kötés Carbonylicity lefinicity 4
5 Kvantitatív v KémiaK CJUGATICVICITY C 2 C Y 1 olefinicity C Y 1 iminicity S C Y 1 tiocarbonylicity 1 C Y C 1 3 aromaticity carbonyicity 2 amidicity 5
6 1 Z C 2 Z 2 Z C C (1) Z C ICS KJ. 2 (A) A Z C Z C EGYELŐ KJ. 2 (B) 0 % EGYEL 100 % B Z C = Z [conj%](a) = 0% = m 2 (A) + [conj%] 0 [conj%](b) = 100% = m 2 (B) + [conj%] 0 [conj%](1) = m 2 (1) + [conj%] 0 E (1) = [conj%](1) / m 1. eq 2. eq 3. eq 4. eq 6
7 conjugativicity 1 C carbonyicity C amidicity 1 S C thiocarbonylicity 1 C iminicity 1 C 2 C olefinicity 7
8 (1) + (2) I(1,2) (1) + (2) Conj. = ΣConj.[(i)] - ΣConj.[(j)] Termodinamikai: Conj. (E) ozitív = kedvező; negatív = nem kedvező kinetikai: Conj.[(i)] Kicsi érték= reaktív; magas = nem reaktív 8
9 1. Aromaticity a. Foszfol b. eterofoszfét 2. Amidicity a. Transamidiation b. Szelektivitás c. Biológiai példa 3. Carbonylicity a. eptidkapcsolás b. eaktivitás 4. lefinicity a. Keresztkapcsolások b. Indolreakció 5. Komplex megközelítések a. 1. példa b. AD, FAD c. enicillin
10 Aromaticitás/Antiaromaticit s/antiaromaticitás Aromaticity Az aromaticitás olyan mint a szépség, könnyű felismerni, de nehéz mérni. (. V.. Schleyer) Meghatározza a 1. molekulák stabilitását 2. reakcióutakat 3. aktiválási energiát 4. spetkroszkópiai tulajdonságokat π-(2d)aromaticitás (1920) antiaromaticitás (1965) 3D aromaticitás (1978) σ-aromaticitás (1979) [pl. Li klaszter], δ-aromaticitás (2004) [pl. Au klaszter], 10 1
11 Aromaticitás/Antiaromaticit s/antiaromaticitás mérések Aromaticity Illat alapú Illatos illetve büdös Geometria alapú referencia referencia antiaromás MA, Bird, BDST index Mágneses árnyékolás alapú uclear Independent Chemical Shift: ICS l. cbutadien [27-29] benzol [(-8)-(-9)] pirrol [(-12)-(-13)]? 11 11
12 AMATICITÁS Ciklikus delokalizáci ció Aromaticity ückel modell 6π elektron Degeneráció 4π elektron nem-aromás aromás nem-aromás antiaromás betöltetlen betöltött ε ASE ε ASE ε ASE ASE ε ASE 12
13 MÓDSZE: LIEÁIS AMATICITÁS S SKÁLA G3M2B3 1 AMÁS Studied reaction 2 2 (1) kj/mol eference reaction 2 2(2) kj/mol Aromaticity 2 = 2 (1) - 2 (2) kj/mol 2 ATIAMÁS 3 EM AMÁS (1) 2 (2) kj/mol 2 2 (1) kj/mol 2(2) kj/mol kj/mol kj/mol kj/mol 2 ( ) n ( ) n ( ) n ( ) n 2 2 (1) ( ) n [1] J. hys. Chem A. 2007, 111, ( ) n ( ) n 2 2 (2) ( ) n kj/mol 13
14 LIEÁIS AMATICITÁS S SKÁLA Aromaticity Y = aromaticitási paraméter (%) 100 % 0 % -100 % (1) 2 2 (2) 2 2 (1) 2 2 (2) 3 1 Illesztés (G3M2B3): Y = m. + b m = b = (1) 2 2 (2) = 2 (kj/mol) [1] J. hys. Chem A. 2007, 111,
15 Aromaticitás s skála Aromaticity % t-bu t-bu S S t-bu t-bu Mucsi, Z.; Viskolcz, B.; Csizmadia, I. G. J. hys. Chem A. 2007, 111, Mucsi, Z.; Csizmadia, I. G. Cur. rg. Chem. 2008, 12, Mucsi, Z.; Körtvélyesi, T.; Viskolcz, B.; Csizmadia, I. G.; ovák, T.; Keglevich, G. Eur. J. rg. Chem. 2007, Mucsi, Z.; Viskolcz, B.; ermecz, I.; Csizmadia, I. G.; Keglevich, G. Tetrahedron 2008, 64, Mucsi, Z.; Keglevich, G. Eur. J. rg. Chem. 2007,
16 FSZFL ID Aromaticity aromás foszfol antiaromás? foszfol oxid Y '' Y r.t. Y Y '' or S 8 Y Z = or S Z Y Z Y 16
17 Aromaticity Tanulmányozott nyozott reakció eferencia reakció 2 [I] 2 [II] 2 aromaticitás Me Me Me Me % Me Me Me Me % 17
18 Aromaticity 6π Me 6π Me Me 4π Me 4π B Me 18
19 Y + =, S, 150 o C ETEFSZFÉT Y ekvatoriális Y 1A ISTABIL Y axiális Y 1B Aromaticity β-, TI-,, IMI- FSZF Á Y 3 A két konformer formában felírható négytagú heterofoszfét szerkezetek (1A és 1B) instabilak és gyűrűfelnyílásuk során stabil β-oxo, tio-, iminofoszforánokat (3) eredményeznek [2]. ETEFSZFETÁ Y Y Y 2A STABIL 2B 4 Telített változatuk, amelyek a Wittig reakció ismert intermedierei, ezzel ellentétben stabilnak tekinthetőek (2A and 2B) és analóg gyűrűfelnyílásban nem vesznek részt. [2] Current rg. Chem. 2004, 8,
20 ELEKTIKUS SZEKEZET Aromaticity Y Y 2 elektron a p z -n Y üres d xz ÁTFEDÉS a atom d xz és az Y atom p z pályája között Felmerül l a kérdk rdés, hogy miért van ilyen éles stabilitásbeli sbeli különbség g a p C 4 telített tett és s a telítettlen tettlen molekula közöttk tt. z p z C 3 Y 2 p z d xz 1 4π elektron tronrendszerrendszer ATIAMÁS Kvantumkémiai számításaink szerint az 1A és 1B szerkezetek instabilitását az antiaromaticitásukkal lehet magyarázni. [3] Eur. J. rg. Chem. 2007,
21 ATÁSZEKEZETEK instabil ETEFSZFÉT stabil ETEFSZFETÁ Aromaticity Y Y Y Y 1A-I 1A-II 2A-I 2A-II Y Y Y Y 1B-I 1B-II 2B-I 2B-II Konjugált 4π elektronrendszer Ciklobutadién-szerű határszerkezet incs konjugáció incs ciklobutadién-szerű határszerkezet ATIAMÁS 21 EM AMÁS 21 4
22 ATIAMATICITÁS Az aromaticitás mértékét a lineáris aromaticitási skálával mértük.[3] Az 1A szerkezet (ekvatoriális Y) nagyobb antiaromaticitással rendelkezik, mint az 1B szerkezet (axiális Y), ezekre inkább mint nem aromás vegyületekként tekinthetünk. Y 1A(Y,) Y 1B(Y,) 2 2 Y 2A(Y,) Y 2B(Y,) Aromaticity 1A(C 2,) 1B(C 2,) 2 2 2A(C 2,) = F, Cl, C és Y =,, S = 9 szerkeze ( 10%) (15%) ( 40%) ( 15%) 22 22
23 TEMDIAMI AMIKA ÉS KIETIKA KA Y Mechanism of the 1A 1B 3 transformation Y 1 4 Turnstile pseudorotation Y Y = F, Cl, C Y =,, S Y Y 1A 1B-TS 1B 3-TS 3 Antiaromaticitás csökken Aromaticity relative energy (kj/mol) TS 1A 1BTS 1B TS 1BTS 1A kj/mol kj/mol 3-12 kj/mol 1B 3TS χ torsion angle Y2 distance (A) kiind 3-5 kj/mol 23
24 ATIAMATICITÁS FELSZÍ ES Aromaticity Az 1A 1B 3 reakciósorozat antiaromaticitás felszíne ( = F and Y = ). A hajtóerő az antiaromás karakter csökkentése a reakció során. Aromaticitás felszín A 3 szerkezet egy aromás domboldalon fekszik, amely már nem értelmezhető. Az 1B szerkezet egy nem aromás, lapos völgyben helyezkedik el. Az 1(,F) antiaromaticitás % felszíne egy erős negatív lyukat mutat 24 az 1A pozíciójában. 24
25 Amidicity Stabilitás vizes oldatban (p = 7) 1 3 ~100 év 2 gyenge vagy erős konjugáció másodpercek percek = δ δ 25
26 Az Amiditás s kvantitatív v mérésem Amidicity MÉÉS: a delokalizáció megszűnik A [I] 2 1 B 3 SKÁLA (%): 2 ~stabilizációs energia 100 % 0 % [I] = kj mol -1 ~teljes konjugáció [I] = kj mol -1 nincs konjugáció B3LY/6-31G(d,p) [Amidicity %] = m 2 [I] + [Amidicity %] 0 26
27 róbavegy bavegyületek 1 Amidicity 2 2 DMF 93 % 95 % 97 % 101 % 100 % 97 % 82 % 58 % 87 % 95 % + gyűrűfeszültség 2 79 % 117 % 91 % 81 % M 122 % 90 % 13 % 27 ( ) n ( ) 2 [II] n n = 1 : kj mol -1 2 : kj mol -1 3 : kj mol [III] kj mol -1 27
28 róbavegy bavegyületek 2 Amidicity Aromás (6π) segítő Antiaromás (4π) versengő Konjugált 123 % 131 % 25 % 27 % versengő 2-30 % 53 % 89 % 88 % 61 % 57 % segítő 128 % 108 % 28 28
29 Amidicitás s skála Amidicity Amidity (%) 29
30 Amidicity M Amidity % Models with Models with Me ing size elative Amidity % 30
31 eaktivitás Amidicity eact (kj mol -1 ) eferences (1,2) Models (3-29) Amidity % Y = ( ) ( 2 = 0.884) + δ δ δ A TS-A δ 3 TS- 1 J 31
32 Transzamidálási si reakciók Amidicity Lágy acilezés - Szelektivitás l.: + + Amidity = Amidity(T) Amidity() Szabály: a a Amidity pozitív, akkor mehet a reakció, ha negatív akkor nem Aromaticity = Aromaticity (T) Aromaticity() 32
33 A 5 4 Amidicity LS C 3 = 4 5 +AG- AG bázis B D LS sav Termodinamikailag engedélyezett AG = actíváló csoport LS = Lewis sav 2 3 Termodinamikailag nem engedélyezett 33
34 Tanulmányozott nyozott transzamidálási si reakciók k 1 Amidicity -I Amidity 93.4 % 96.8 % -II Amidity = 3.4 % Amidity 96.1 % % Amidity = 3.9 % 34
35 Amidicity -III Amidity Aromaticity % 99.4 % 100 % % % 2 -IV Amidity Aromaticity % % % 0.0 % 35
36 Tanulmányozott nyozott transzamidálási si reakciók k 2 -V Amidity 59.0 % % Amidity = % Aromaticity 39.5 % 0.0 % 56.9 % 0.0 % Aromaticity = % -VI Amidity 46.6 % % Amidity = % Aromaticity 28.6 % 0.0 % 50.3 % 0.0 % Aromaticity = % -VII Amidity 44.9 % % Amidity = % Aromaticity2 x 20.6 % 2 x 0.0 % 2 x 50.3 % 2 x 0.0 % Aromaticity = % Amidicity 36
37 Tanulmányozott nyozott transzamidálási si reakciók k 3 Amidicity -VIII Amidity % % Amidity = % Aromaticity 91.1 % 0.0 % 99.4 % 0.0 % Aromaticity = % -I Amidity % 46.6 % Amidity = % Aromaticity 91.1 % 50.3 % 99.4 % 28.6 % Aromaticity = % Amidity 81.7 % % Amidity = % Aromaticity % 0.0 % % 0.0 % Aromaticity = -3.2 %
38 Tanulmányozott nyozott transzamidálási si reakciók k 4 Amidicity -I % 95.6 % DMF Amidity = -1.4 % II 49 incs reakció!! % % M 50 Amidity = % 38
39 Tanulmányozott nyozott transzamidálási si reakciók k 5 -III % % Amidity = 38.5 % -IV % % Amidity = 79.7 % -V CF 3 S 2 CF 3 CF 3 S S % 1 MehS % % -VI Amidity = 71.5 % hme hme S 2 + S 2 + MeC % % Amidity = 38.0 % -VII % % % Amidity = % Amidicity 39
40 Tanulmányozott nyozott transzamidálási si reakciók k 6 Amidicity -VIII 51 -I % 1 eqv. tbuc Me % 95.1 % 39.1 % 2 eqv. tbuc = CtBu, Cl 70.8 % Me 61 tbu % + tbu tbu + Me 70.8 % tbu % + tbu % % % tbu Amidity = 76.1 % % Amidity = % 40
41 Tanulmányozott nyozott transzamidálási si reakciók k 7 Amidicity - a ( ) n AcCl ( ) n + n = 4, 6, 7 AlCl 3 A út n = 1 n = 2 n = 3 n = 4 ( ) n Amidity % % 85.8 % % % 48.5 % % % 86.1 % % % 72.7 % 30 n = % n = % n = % n = % % 83.1 % 47.5 % 53.0 % 71.3 % 75.6 % 69.6 % 76.5 % n = 5 B út 30 n = 1 65 n = 2 66 n = 3 67 n = % % 89.6 % 78.0 % % Amidity 47.9 % 56.3 % 72.5 % 48.5 % 41
42 Tanulmányozott nyozott transzamidálási si reakciók k 8 Amidicity -I 77 2 ame 97.0 % + 47 reverzibilis sav irreverzibilis % 71.9 % 42
43 Szelektivitás s 1 Amidicity -II (93.4 %) 81 Bz o C 2-4 óra Bz 82 (100.4 %) + 84 Bz + 86 Bz o C 2 + Bz Bz 0.2 eq. AlCl óra 27 (96.1 %) 83 (101.2 %) + 85 Bz + 87 Bz 43
44 Szelektivitás s 2 Amidicity -III o C 2-4 óra (93.4 %) (100.4 %) 91 (80.4 %) o C 0.2 eq. AlCl 3 15 óra (96.1 %) (101.2 %) 92 (82.2 %) 94 44
45 Biológiai példap Véralvadás Amidicity +4.1% STÁ 45
46 A Carbonylicity kvantitatív v mérésem Carbonylicity MÉÉS: a delokalizáció megszűnik SKÁLA (%): 2 ~stabilizációs energia 100 % 0 % ~teljes konjugáció nincs konjugáció B3LY/6-31G(d,p) [Carbonylicity%] = m 2 [A] + [Carbonylicity %] 0 46
47 Carbonylicity skála Carbonylicity [B] C 8 Cl 5 S C Carbonylicity (%) 47
48 eptidkapcsolás s (1) Carbonylicity % 55.6 % % 55.6 % Me + + Me +3.9 % % +1.2 % 54.4 % 55.6 % Aktiválás + + % 51.7 % % 55.6 % 48
49 eptidkapcsolás s (2) Carbonylicity Aktív észter % 44.3 % % % DCC c-ex c-ex C c-ex c-ex 51.7 % 38.7 % % % 49
50 eptidkapcsolás s (3) Carbonylicity Vegyes anhidrid i-bu MAJ DUCTS Cl 44.9 % i-bu + i-bu - Cl 51.7 % 29.8 % 57.0 % 55.6 % 56.6 % % 2 + C % + i-bu 57.0 % % MI DUCTS 50
51 B eptidkapcsolás s (4) 51.7 % 25.5 % 36.4 % 55.6 % % Carbonylicity % BTU % 51.7 % % +8.1 % 36.4 % % 51
52 enicillin szintézis zis Carbonylicity S 51.7 % c-ex C c-ex S 36.0 % c-ex % c-ex S 37.1 % S 51.7 % c-ex c-ex C S 36.0 % % c-ex - c-ex S 22.6 % 52
53 Laktámok és s Laktonok (Amidicity, Carbonylicity) Carbonylicity Gyűrűfelnyit felnyitás 2 ( ) n ( ) n 2 ( ) n ( ) n n = 1, 2, 3, 4 53
54 A lefinicity kvantitatív v mérésem lefinicity MÉÉS: a delokalizáció megszűnik SKÁLA (%): 2 ~stabilizációs energia 100 % 0 % ~teljes konjugáció nincs konjugáció B3LY/6-31G(d,p) [lefinicity%] = m 2 [A] + [lefinicity%] 0 55
55 lefinicity CJUGATIVE EFFECTS F MSUSTITUTED ETEE(Group 1) C 2 C 2 C 2 C 2 C 2 F C B % 20.3% 31.1% 12.1% 19.6% (11.5%) (20.4%) (29.2%) (11.4%) (22.4%) C 2 2 C 2 C 2 C 2 C 2 C 2 C 2 Cl S Si Al % 11.9% 8.9% 8.8% 19.2% (4.4%) (10.3%) (7.4%) (10.4%) (20.4%) C 2 C 2 C 2 C 2 C 2 C 2 C 2 C 2 C 2 C S Si Me % 110.7% 100.0% -14.6% 49.0% 57.4% 29.7% -5.3% 27.3% (87.2%) (100.7%) (100.0%) (-10.0%) (46.0%) (47.2%) (27.8%) (-0.3%) (26.4%) C 2 C 2 C 2 C 2 C 2 C 2 C 2 C 2 C 2 Me S % 7.1% 18.8% 9.0% 18.9% 1.7% 25.4% 19.1% 34.7% (15.5%) (10.1%) (19.6%) (11.6%) (19.5%) (5.1%) (24.8%) (19.4%) (32.4%) 56
56 lefinicity 57
57 lefinicity skála lefinicity [B] olefinicity (%) 58
58 eck kapcsolás s (lefinicity) lefinicity Br d(me 3 ) + 2 =, CMe 2, 2, Me -Br (1) (2) (3) olefinicity (2) (3) olefinicity CMe Me
59 Keresztkapcsolás s 2. lefinicity 1.4 % Me 3 Br +d(me 3 ) 2 d 17.3 % (1) (2) Br Me % Me 3 (3) d Me -Br 3 -d(me 3 ) % % % (4) (5) olefinicity (1) (3) (5) olefinicity ame Li x Si(Me) x iyama SiF x iyama Si(C 2 ) x iyama MgCl x Kumada ZnCl x egeshi SnMe x Stille B() x Suzuki 60
60 Indol reakció lefinicity -8.6% 40.9% olefinicity = (-8.64) = kj mol -1 (E) = 71.0 kj mol -1 61
61 1. Komplex példa CMLE 2B C 3TS 3 2A C C 4TS 4 5 2C C 2D 6TS 6 62
62 Szintek CMLE Szigma alapváz z képzk pződéshője ány C-C, C-, C-, -, C- i alapváz z képzk pződéshője + ány C=C, C=, C= ezonancia energia + 63
63 Szigma és i alapváz CMLE Kötéstípus (kj mol -1 ) Vegyület C-C 344 C C- 340 C C=C 271 C= C= 340 σ π Σ C
64 106.7 % EZACIA EEGIA (kj mol -1 ) 2A % +53 C 15.1 % CMLE % 92.3 % (27.5 %) 70.9 % % 70.5 % (21.0%) % % % (-46.5%) -38.8%
65 C 3TS 3 4TS 4 6TS = = Me = I = F
66 edox reaction in biochemistry CMLE 67
67 CMLE 68
68 CMLE 69
69 EICILLI CMLE SYSTEMS F CMETS 1. roper 3D-geometry (DESIG) 2. Internal ring strain (SIG) 3. Sensitive sensor (BAIT) 4. Acylation property (MTAL TL) 70
70 AMIDICITY F EICILLI CMLE 3 superactive active ME ACTIVE 71 inactive 71
AROMÁS SZÉNHIDROGÉNEK
 AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
Szénhidrogének III: Alkinok. 3. előadás
 Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Toluol (Bruckner II/1 476) µ= 0.33 Debye
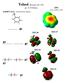 E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés Lewis elmélet
 Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Elektronegativitás. Elektronegativitás
 Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Általános és szervetlen kémia 3. hét Kémiai kötések. Kötések kialakítása - oktett elmélet. Lewis-képlet és Lewis szerkezet
 Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
3. A kémiai kötés. Kémiai kölcsönhatás
 3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis-elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis-elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
Szénhidrogének II: Alkének. 2. előadás
 Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Kémiai reakciók. Közös elektronpár létrehozása. Általános és szervetlen kémia 10. hét. Elızı héten elsajátítottuk, hogy.
 Általános és szervetlen kémia 10. hét Elızı héten elsajátítottuk, hogy a kémiai reakciókat hogyan lehet csoportosítani milyen kinetikai összefüggések érvényesek Mai témakörök a közös elektronpár létrehozásával
Általános és szervetlen kémia 10. hét Elızı héten elsajátítottuk, hogy a kémiai reakciókat hogyan lehet csoportosítani milyen kinetikai összefüggések érvényesek Mai témakörök a közös elektronpár létrehozásával
OXOVEGYÜLETEK. Levezetés. Elnevezés O CH 2. O R C H aldehid. O R C R' keton. Aldehidek. propán. karbaldehid CH 3 CH 2 CH 2 CH O. butánal butiraldehid
 XVEGYÜLETEK Levezetés 2 aldehid ' keton Elnevezés Aldehidek propán karbaldehid 3 2 2 butánal butiraldehid oxo karbonil formil Példák 3 3 2 metanal etanal propanal formaldehid acetaldehid propionaldehid
XVEGYÜLETEK Levezetés 2 aldehid ' keton Elnevezés Aldehidek propán karbaldehid 3 2 2 butánal butiraldehid oxo karbonil formil Példák 3 3 2 metanal etanal propanal formaldehid acetaldehid propionaldehid
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
6) Az átmenetifémek szerves származékai
 Rendszeres fémorganikus kémia 2009-2010 (134) Átmenetifém-átmenetifém kötések és klaszterek Történet: A. Werner (1866-1919) oligonukleáris komplexekben ligandum-hidakat tételezett fel: (H 3 N)(Cl)Pt(µ-Cl)
Rendszeres fémorganikus kémia 2009-2010 (134) Átmenetifém-átmenetifém kötések és klaszterek Történet: A. Werner (1866-1919) oligonukleáris komplexekben ligandum-hidakat tételezett fel: (H 3 N)(Cl)Pt(µ-Cl)
Kémia OKTV I. kategória II. forduló A feladatok megoldása
 ktatási ivatal Kémia KTV I. kategória 2008-2009. II. forduló A feladatok megoldása I. FELADATSR 1. A 6. E 11. A 16. C 2. A 7. C 12. D 17. B 3. E 8. D 13. A 18. C 4. D 9. C 14. B 19. C 5. B 10. E 15. E
ktatási ivatal Kémia KTV I. kategória 2008-2009. II. forduló A feladatok megoldása I. FELADATSR 1. A 6. E 11. A 16. C 2. A 7. C 12. D 17. B 3. E 8. D 13. A 18. C 4. D 9. C 14. B 19. C 5. B 10. E 15. E
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Kötések kialakítása - oktett elmélet
 Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
CH 2 =CH-CH 2 -S-S-CH 2 -CH=CH 2
 10. Előadás zerves vegyületek kénatommal Példák: ZEVE VEGYÜLETEK KÉATMMAL CH 2 =CH-CH 2 ---CH 2 -CH=CH 2 diallil-diszulfid (fokhagyma olaj) H H H szacharin merkapto-purin tiofén C H2 H szulfonamid (Ultraseptyl)
10. Előadás zerves vegyületek kénatommal Példák: ZEVE VEGYÜLETEK KÉATMMAL CH 2 =CH-CH 2 ---CH 2 -CH=CH 2 diallil-diszulfid (fokhagyma olaj) H H H szacharin merkapto-purin tiofén C H2 H szulfonamid (Ultraseptyl)
A vas-oxidok redukciós folyamatainak termodinamikája
 BUDAESTI MŰSZAKI EGYETEM Anyagtudomány és Technológia Tanszék Anyag- és gyártástechnológia (hd) féléves házi feladat A vas-oxidok redukciós folyamatainak termodinamikája Thiele Ádám WTOSJ Budapest, 11
BUDAESTI MŰSZAKI EGYETEM Anyagtudomány és Technológia Tanszék Anyag- és gyártástechnológia (hd) féléves házi feladat A vas-oxidok redukciós folyamatainak termodinamikája Thiele Ádám WTOSJ Budapest, 11
Periódusosság. Általános Kémia, Periódikus tulajdonságok. Slide 1 of 35
 Periódusosság 11-1 Az elemek csoportosítása: a periódusos táblázat 11-2 Fémek, nemfémek és ionjaik 11-3 Az atomok és ionok mérete 11-4 Ionizációs energia 11-5 Elektron affinitás 11-6 Mágneses 11-7 Az elemek
Periódusosság 11-1 Az elemek csoportosítása: a periódusos táblázat 11-2 Fémek, nemfémek és ionjaik 11-3 Az atomok és ionok mérete 11-4 Ionizációs energia 11-5 Elektron affinitás 11-6 Mágneses 11-7 Az elemek
ALKOHOLOK ÉS SZÁRMAZÉKAIK
 ALKLK ÉS SZÁRMAZÉKAIK Levezetés R R alkohol R R R éter Elnevezés Nyíltláncú, telített alkoholok általános név: alkanol alkil-alkohol 2 2 2 metanol etanol propán-1-ol metil-alkohol etil-alkohol propil-alkohol
ALKLK ÉS SZÁRMAZÉKAIK Levezetés R R alkohol R R R éter Elnevezés Nyíltláncú, telített alkoholok általános név: alkanol alkil-alkohol 2 2 2 metanol etanol propán-1-ol metil-alkohol etil-alkohol propil-alkohol
Palládium-organikus vegyületek
 Palládium-organikus vegyületek 1894 Phillips: C 2 H 4 + PdCl 2 + H 2 O CH 3 CHO + Pd + 2 HCl 1938 Karasch: (C 6 H 5 CN) 2 PdCl 2 + RCH=CHR [(π-rhc=chr)pdcl 2 ] 2 Cl - Cl Pd 2+ Pd 2+ Cl - - Cl - H O 2 2
Palládium-organikus vegyületek 1894 Phillips: C 2 H 4 + PdCl 2 + H 2 O CH 3 CHO + Pd + 2 HCl 1938 Karasch: (C 6 H 5 CN) 2 PdCl 2 + RCH=CHR [(π-rhc=chr)pdcl 2 ] 2 Cl - Cl Pd 2+ Pd 2+ Cl - - Cl - H O 2 2
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 2000
 Megoldás 000. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 000 JAVÍTÁSI ÚTMUTATÓ I. A NITROGÉN ÉS SZERVES VEGYÜLETEI s s p 3 molekulák között gyenge kölcsönhatás van, ezért alacsony olvadás- és
Megoldás 000. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 000 JAVÍTÁSI ÚTMUTATÓ I. A NITROGÉN ÉS SZERVES VEGYÜLETEI s s p 3 molekulák között gyenge kölcsönhatás van, ezért alacsony olvadás- és
Periódusosság. Általános Kémia, Periódikus tulajdonságok. Slide 1 of 35
 Periódusosság 3-1 Az elemek csoportosítása: a periódusos táblázat 3-2 Fémek, nemfémek és ionjaik 3-3 Az atomok és ionok mérete 3-4 Ionizációs energia 3-5 Elektron affinitás 3-6 Mágneses 3-7 Az elemek periodikus
Periódusosság 3-1 Az elemek csoportosítása: a periódusos táblázat 3-2 Fémek, nemfémek és ionjaik 3-3 Az atomok és ionok mérete 3-4 Ionizációs energia 3-5 Elektron affinitás 3-6 Mágneses 3-7 Az elemek periodikus
Szalai István. ELTE Kémiai Intézet 1/74
 Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74 Periodikus
Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74 Periodikus
Beszélgetés a szerves kémia elméleti alapjairól III.
 Beszélgetés a szerves kémia elméleti alapjairól III. Csökkentett vagy fokozott reakciókészségű halogénszármazékok? A középiskolai szerves kémiai tananyag alapján, a telített alkil-halogenidek reakcióképes
Beszélgetés a szerves kémia elméleti alapjairól III. Csökkentett vagy fokozott reakciókészségű halogénszármazékok? A középiskolai szerves kémiai tananyag alapján, a telített alkil-halogenidek reakcióképes
10. Előadás. Heterociklusos vegyületek.
 0. Előadás eterociklusos vegyületek. ETECIKLUSS VEGYÜLETEK Felosztás:. telített telítetlen. heteroatomok száma 3. gyűrűk száma. heteroatomok milyensége (,, S, P, As, Si) oxa- S tia- aza- I. Monociklusos,
0. Előadás eterociklusos vegyületek. ETECIKLUSS VEGYÜLETEK Felosztás:. telített telítetlen. heteroatomok száma 3. gyűrűk száma. heteroatomok milyensége (,, S, P, As, Si) oxa- S tia- aza- I. Monociklusos,
Heterociklusos vegyületek
 Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
KÉMIA ÍRÁSBELI ÉRETTSÉGI-FELVÉTELI FELADATOK 2003.
 KÉMIA ÍRÁSBELI ÉRETTSÉGI-FELVÉTELI FELADATK 2003. JAVÍTÁSI ÚTMUTATÓ Az írásbeli felvételi vizsgadolgozatra összesen 100 (dolgozat) pont adható, a javítási útmutató részletezése szerint. Minden megítélt
KÉMIA ÍRÁSBELI ÉRETTSÉGI-FELVÉTELI FELADATK 2003. JAVÍTÁSI ÚTMUTATÓ Az írásbeli felvételi vizsgadolgozatra összesen 100 (dolgozat) pont adható, a javítási útmutató részletezése szerint. Minden megítélt
Név: Pontszám: 1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban
 1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban a, diszulfidhíd (1 példa), b, hidrogénkötés (2 példa), c, töltés-töltés kölcsönhatás (2 példa)!
1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban a, diszulfidhíd (1 példa), b, hidrogénkötés (2 példa), c, töltés-töltés kölcsönhatás (2 példa)!
feladatmegoldásai K É M I Á B Ó L
 A 2006/2007. tanévi ORSZÁGOS KÖZÉPISKOLAI TANULMÁNYI VERSENY első (iskolai) fordulójának Az értékelés szempontjai feladatmegoldásai K É M I Á B Ó L Egy-egy feladat összes pontszáma a részpontokból tevődik
A 2006/2007. tanévi ORSZÁGOS KÖZÉPISKOLAI TANULMÁNYI VERSENY első (iskolai) fordulójának Az értékelés szempontjai feladatmegoldásai K É M I Á B Ó L Egy-egy feladat összes pontszáma a részpontokból tevődik
Nitrogé ntartalmú hétérociklúsos végyú léték
 itrogé ntartalmú hétérociklúsos végyú léték A nitrogéntartalmú heterociklusos vegyületek a természetben előforduló jelentős vegyületek közé tartoznak. Piridin C55 Szerkezete o A benzolhoz hasonló a felépítése,
itrogé ntartalmú hétérociklúsos végyú léték A nitrogéntartalmú heterociklusos vegyületek a természetben előforduló jelentős vegyületek közé tartoznak. Piridin C55 Szerkezete o A benzolhoz hasonló a felépítése,
KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK I. FULLERÉNEK
 ÓBUDAI EGYETEM ANYAGTUDOMÁNYI SZEMINÁRIUMOK, 2014. MÁJUS 12. PEKKER SÁNDOR MTA WIGNER SZFI KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK I. FULLERÉNEK KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK
ÓBUDAI EGYETEM ANYAGTUDOMÁNYI SZEMINÁRIUMOK, 2014. MÁJUS 12. PEKKER SÁNDOR MTA WIGNER SZFI KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK I. FULLERÉNEK KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK
1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban
 1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban a, diszulfidhíd (1 példa), b, hidrogénkötés (2 példa), c, töltés-töltés kölcsönhatás (2 példa)!
1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban a, diszulfidhíd (1 példa), b, hidrogénkötés (2 példa), c, töltés-töltés kölcsönhatás (2 példa)!
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
A METABOLIZMUS ENERGETIKÁJA
 A METABOLIZMUS ENERGETIKÁJA Futó Kinga 2014.10.01. Metabolizmus Metabolizmus = reakciók együttese, melyek a sejtekben lejátszódnak. Energia nyerés szempontjából vannak fototrófok ill. kemotrófok. szervesanyag
A METABOLIZMUS ENERGETIKÁJA Futó Kinga 2014.10.01. Metabolizmus Metabolizmus = reakciók együttese, melyek a sejtekben lejátszódnak. Energia nyerés szempontjából vannak fototrófok ill. kemotrófok. szervesanyag
A METABOLIZMUS ENERGETIKÁJA
 A METABOLIZMUS ENERGETIKÁJA Futó Kinga 2013.10.02. Metabolizmus Metabolizmus = reakciók együttese, melyek a sejtekben lejátszódnak. Energia nyerés szempontjából vannak fototrófok ill. kemotrófok. szervesanyag
A METABOLIZMUS ENERGETIKÁJA Futó Kinga 2013.10.02. Metabolizmus Metabolizmus = reakciók együttese, melyek a sejtekben lejátszódnak. Energia nyerés szempontjából vannak fototrófok ill. kemotrófok. szervesanyag
Spontaneitás, entrópia
 Spontaneitás, entrópia 6-1 Spontán folyamat 6-2 Entrópia 6-3 Az entrópia kiszámítása 6-4 Spontán folyamat: a termodinamika második főtétele 6-5 Standard szabadentalpia változás, ΔG 6-6 Szabadentalpia változás
Spontaneitás, entrópia 6-1 Spontán folyamat 6-2 Entrópia 6-3 Az entrópia kiszámítása 6-4 Spontán folyamat: a termodinamika második főtétele 6-5 Standard szabadentalpia változás, ΔG 6-6 Szabadentalpia változás
Energia. Energia: munkavégző, vagy hőközlő képesség. Kinetikus energia: a mozgási energia
 Kémiai változások Energia Energia: munkavégző, vagy hőközlő képesség. Kinetikus energia: a mozgási energia Potenciális (helyzeti) energia: a részecskék kölcsönhatásából származó energia. Energiamegmaradás
Kémiai változások Energia Energia: munkavégző, vagy hőközlő képesség. Kinetikus energia: a mozgási energia Potenciális (helyzeti) energia: a részecskék kölcsönhatásából származó energia. Energiamegmaradás
Fizikai kémia 2 Reakciókinetika házi feladatok 2016 ősz
 Fizikai kémia 2 Reakciókinetika házi feladatok 2016 ősz A házi feladatok beadhatóak vagy papír alapon (ez a preferált), vagy e-mail formájában is az rkinhazi@gmail.com címre. E-mail esetén ügyeljetek a
Fizikai kémia 2 Reakciókinetika házi feladatok 2016 ősz A házi feladatok beadhatóak vagy papír alapon (ez a preferált), vagy e-mail formájában is az rkinhazi@gmail.com címre. E-mail esetén ügyeljetek a
Savak bázisok. Csonka Gábor Általános Kémia: 7. Savak és bázisok Dia 1 /43
 Savak bázisok 121 Az Arrhenius elmélet röviden 122 BrønstedLowry elmélet 123 A víz ionizációja és a p skála 124 Erős savak és bázisok 125 Gyenge savak és bázisok 126 Több bázisú savak 127 Ionok mint savak
Savak bázisok 121 Az Arrhenius elmélet röviden 122 BrønstedLowry elmélet 123 A víz ionizációja és a p skála 124 Erős savak és bázisok 125 Gyenge savak és bázisok 126 Több bázisú savak 127 Ionok mint savak
Kémiai reakciók Műszaki kémia, Anyagtan I. 11. előadás
 Kémiai reakciók Műszaki kémia, Anyagtan I. 11. előadás Dolgosné dr. Kovács Anita egy.doc. PTE MIK Környezetmérnöki Tanszék Kémiai reakció Kémiai reakció: különböző anyagok kémiai összetételének, ill. szerkezetének
Kémiai reakciók Műszaki kémia, Anyagtan I. 11. előadás Dolgosné dr. Kovács Anita egy.doc. PTE MIK Környezetmérnöki Tanszék Kémiai reakció Kémiai reakció: különböző anyagok kémiai összetételének, ill. szerkezetének
Termokémia. Hess, Germain Henri (1802-1850) A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 Termokémia Hess, Germain Henri (1802-1850) A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 A reakcióhő fogalma A reakcióhő tehát a kémiai változásokat kísérő energiaváltozást jelenti.
Termokémia Hess, Germain Henri (1802-1850) A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 A reakcióhő fogalma A reakcióhő tehát a kémiai változásokat kísérő energiaváltozást jelenti.
Periódusos rendszer (Mengyelejev, 1869) nemesgáz csoport: zárt héj, extra stabil
 s-mezı (fémek) Periódusos rendszer (Mengyelejev, 1869) http://www.ptable.com/ nemesgáz csoport: zárt héj, extra stabil p-mezı (nemfém, félfém, fém) d-mezı (fémek) Rendezés elve: növekvı rendszám (elektronszám,
s-mezı (fémek) Periódusos rendszer (Mengyelejev, 1869) http://www.ptable.com/ nemesgáz csoport: zárt héj, extra stabil p-mezı (nemfém, félfém, fém) d-mezı (fémek) Rendezés elve: növekvı rendszám (elektronszám,
Oldódás, mint egyensúly
 Oldódás, mint egyensúly Szilárd (A) anyag oldódása: K = [A] oldott [A] szilárd állandó K [A] szilárd = [A] oldott S = telített oldat conc. Folyadék oldódása: analóg módon Gázok oldódása: [gáz] oldott K
Oldódás, mint egyensúly Szilárd (A) anyag oldódása: K = [A] oldott [A] szilárd állandó K [A] szilárd = [A] oldott S = telített oldat conc. Folyadék oldódása: analóg módon Gázok oldódása: [gáz] oldott K
AMINOKARBONILEZÉS ALKALMAZÁSA ÚJ SZTERÁNVÁZAS VEGYÜLETEK SZINTÉZISÉBEN
 AMIKABILEZÉS ALKALMAZÁSA ÚJ SZTEÁVÁZAS VEGYÜLETEK SZITÉZISÉBE A Ph.D. DKTI ÉTEKEZÉS TÉZISEI Készítette: Takács Eszter okleveles vegyészmérnök Témavezető: Skodáné Dr. Földes ita egyetemi docens, az MTA
AMIKABILEZÉS ALKALMAZÁSA ÚJ SZTEÁVÁZAS VEGYÜLETEK SZITÉZISÉBE A Ph.D. DKTI ÉTEKEZÉS TÉZISEI Készítette: Takács Eszter okleveles vegyészmérnök Témavezető: Skodáné Dr. Földes ita egyetemi docens, az MTA
Az elemeket 3 csoportba osztjuk: Félfémek vagy átmeneti fémek nemfémek. fémek
 Kémiai kötések Az elemeket 3 csoportba osztjuk: Félfémek vagy átmeneti fémek nemfémek fémek Fémek Szürke színűek, kivétel a színesfémek: arany,réz. Szilárd halmazállapotúak, kivétel a higany. Vezetik az
Kémiai kötések Az elemeket 3 csoportba osztjuk: Félfémek vagy átmeneti fémek nemfémek fémek Fémek Szürke színűek, kivétel a színesfémek: arany,réz. Szilárd halmazállapotúak, kivétel a higany. Vezetik az
Közös elektronpár létrehozása
 Kémiai reakciók 10. hét a reagáló részecskék között közös elektronpár létrehozása valósul meg sav-bázis reakciók komplexképződés elektronátadás és átvétel történik redoxi reakciók Közös elektronpár létrehozása
Kémiai reakciók 10. hét a reagáló részecskék között közös elektronpár létrehozása valósul meg sav-bázis reakciók komplexképződés elektronátadás és átvétel történik redoxi reakciók Közös elektronpár létrehozása
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 2001 (pótfeladatsor)
 2001 pótfeladatsor 1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 2001 (pótfeladatsor) Útmutató! Ha most érettségizik, az I. feladat kidolgozását karbonlapon végezze el! Figyelem! A kidolgozáskor
2001 pótfeladatsor 1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 2001 (pótfeladatsor) Útmutató! Ha most érettségizik, az I. feladat kidolgozását karbonlapon végezze el! Figyelem! A kidolgozáskor
Az egyensúly. Általános Kémia: Az egyensúly Slide 1 of 27
 Az egyensúly 6'-1 6'-2 6'-3 6'-4 6'-5 Dinamikus egyensúly Az egyensúlyi állandó Az egyensúlyi állandókkal kapcsolatos összefüggések Az egyensúlyi állandó számértékének jelentősége A reakció hányados, Q:
Az egyensúly 6'-1 6'-2 6'-3 6'-4 6'-5 Dinamikus egyensúly Az egyensúlyi állandó Az egyensúlyi állandókkal kapcsolatos összefüggések Az egyensúlyi állandó számértékének jelentősége A reakció hányados, Q:
Szerves kémiai szintézismódszerek
 Szerves kémiai szintézismódszerek 6. Szén-szén többszörös kötések kialakítása: alkinek és kumulének. Periciklusos reakciók Kovács Lajos 1 Bergman-reakció Éndiin antibiotikumok 200 ravasz aktív rész t 1/2
Szerves kémiai szintézismódszerek 6. Szén-szén többszörös kötések kialakítása: alkinek és kumulének. Periciklusos reakciók Kovács Lajos 1 Bergman-reakció Éndiin antibiotikumok 200 ravasz aktív rész t 1/2
HALOGÉNEZETT SZÉNHIDROGÉNEK
 ALOGÉNEZETT SZÉNIDOGÉNEK Elnevezés Nyíltláncú, telített általános név: halogénalkán alkilhalogenid l 2 l 2 2 l klórmetán klóretán 1klórpropán l metilklorid etilklorid propilklorid 2klórpropán izopropilklorid
ALOGÉNEZETT SZÉNIDOGÉNEK Elnevezés Nyíltláncú, telített általános név: halogénalkán alkilhalogenid l 2 l 2 2 l klórmetán klóretán 1klórpropán l metilklorid etilklorid propilklorid 2klórpropán izopropilklorid
Szerves kémiai szintézismódszerek
 Szerves kémiai szintézismódszerek 5. Szén-szén többszörös kötések kialakítása: alkének Kovács Lajos 1 Alkének el állítása X Y FGI C C C C C C C C = = a d C O + X C X C X = PR 3 P(O)(OR) 2 SiR 3 SO 2 R
Szerves kémiai szintézismódszerek 5. Szén-szén többszörös kötések kialakítása: alkének Kovács Lajos 1 Alkének el állítása X Y FGI C C C C C C C C = = a d C O + X C X C X = PR 3 P(O)(OR) 2 SiR 3 SO 2 R
Redoxi reakciók Elektrokémiai alapok Műszaki kémia, Anyagtan I. 12-13. előadás
 Redoxi reakciók Elektrokémiai alapok Műszaki kémia, Anyagtan I. 12-13. előadás Dolgosné dr. Kovács Anita egy.doc. PTE MIK Környezetmérnöki Tanszék Redoxi reakciók Például: 2Mg + O 2 = 2MgO Részfolyamatok:
Redoxi reakciók Elektrokémiai alapok Műszaki kémia, Anyagtan I. 12-13. előadás Dolgosné dr. Kovács Anita egy.doc. PTE MIK Környezetmérnöki Tanszék Redoxi reakciók Például: 2Mg + O 2 = 2MgO Részfolyamatok:
Célkitűzés/témák Fehérje-ligandum kölcsönhatások és a kötődés termodinamikai jellemzése
 Célkitűzés/témák Fehérje-ligandum kölcsönhatások és a kötődés termodinamikai jellemzése Ferenczy György Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biokémiai folyamatok - Ligandum-fehérje kötődés
Célkitűzés/témák Fehérje-ligandum kölcsönhatások és a kötődés termodinamikai jellemzése Ferenczy György Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biokémiai folyamatok - Ligandum-fehérje kötődés
MÉRÉSTECHNIKA. BME Energetikai Gépek és Rendszerek Tanszék Fazekas Miklós (1) márc. 1
 MÉRÉSTECHNIKA BME Energetikai Gépek és Rendszerek Tanszék Fazekas Miklós (1) 463 26 14 16 márc. 1 Méréstechnikai alapfogalmak CÉL Mennyiségek mérése Fizikai mennyiség Hosszúság L = 2 m Mennyiségi minőségi
MÉRÉSTECHNIKA BME Energetikai Gépek és Rendszerek Tanszék Fazekas Miklós (1) 463 26 14 16 márc. 1 Méréstechnikai alapfogalmak CÉL Mennyiségek mérése Fizikai mennyiség Hosszúság L = 2 m Mennyiségi minőségi
R R C X C X R R X + C H R CH CH R H + BH 2 + Eliminációs reakciók
 Eliminációs reakciók Amennyiben egy szénatomhoz távozó csoport kapcsolódik és ugyanazon a szénatomon egy (az ábrákon vel jelölt) bázis által protonként leszakítható hidrogén is található, a nukleofil szubsztitúció
Eliminációs reakciók Amennyiben egy szénatomhoz távozó csoport kapcsolódik és ugyanazon a szénatomon egy (az ábrákon vel jelölt) bázis által protonként leszakítható hidrogén is található, a nukleofil szubsztitúció
O k t a t á si Hivatal
 O k t a t á si Hivatal 0/0. tanévi Országos Középiskolai Tanulmányi Verseny Kémia II. kategória. forduló I. FELADATSOR Megoldások. A helyes válasz(ok) betűjele: B, D, E. A legnagyobb elektromotoros erejű
O k t a t á si Hivatal 0/0. tanévi Országos Középiskolai Tanulmányi Verseny Kémia II. kategória. forduló I. FELADATSOR Megoldások. A helyes válasz(ok) betűjele: B, D, E. A legnagyobb elektromotoros erejű
Osztályozó vizsgatételek. Kémia - 9. évfolyam - I. félév
 Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Összefoglaló előadás. Sav-bázis elmélet
 Összefoglaló előadás Sav-bázis elmélet SAV-BÁZIS TULAJDNSÁGKAT BEFLYÁSLÓ TÉNYEZŐK Elméletek: 1. Brönsted Lowry elmélet: sav - + donor; bázis - + akceptor; Konjugálódó (vagy korrespondáló) sav-bázis pár:
Összefoglaló előadás Sav-bázis elmélet SAV-BÁZIS TULAJDNSÁGKAT BEFLYÁSLÓ TÉNYEZŐK Elméletek: 1. Brönsted Lowry elmélet: sav - + donor; bázis - + akceptor; Konjugálódó (vagy korrespondáló) sav-bázis pár:
Nitrogéntartalmú szerves vegyületek. 6. előadás
 Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Kémiai kötések. Kémiai kötések. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Curie Kémia Emlékverseny 2018/2019. Országos Döntő 9. évfolyam
 A feladatokat írta: Kódszám: Pócsiné Erdei Irén, Debrecen... Lektorálta: Kálnay Istvánné, Nyíregyháza 2019. május 11. Curie Kémia Emlékverseny 2018/2019. Országos Döntő 9. évfolyam A feladatok megoldásához
A feladatokat írta: Kódszám: Pócsiné Erdei Irén, Debrecen... Lektorálta: Kálnay Istvánné, Nyíregyháza 2019. május 11. Curie Kémia Emlékverseny 2018/2019. Országos Döntő 9. évfolyam A feladatok megoldásához
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1997
 1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1997 JAVÍTÁSI ÚTMUTATÓ I. A HIDROGÉN, A HIDRIDEK 1s 1, EN=2,1; izotópok:,, deutérium,, trícium. Kétatomos molekula, H 2, apoláris. Szobahőmérsékleten
1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1997 JAVÍTÁSI ÚTMUTATÓ I. A HIDROGÉN, A HIDRIDEK 1s 1, EN=2,1; izotópok:,, deutérium,, trícium. Kétatomos molekula, H 2, apoláris. Szobahőmérsékleten
Kémiai átalakulások. A kémiai reakciók körülményei. A rendszer energiaviszonyai
 Kémiai átalakulások 9. hét A kémiai reakció: kötések felbomlása, új kötések kialakulása - az atomok vegyértékelektronszerkezetében történik változás egyirányú (irreverzibilis) vagy megfordítható (reverzibilis)
Kémiai átalakulások 9. hét A kémiai reakció: kötések felbomlása, új kötések kialakulása - az atomok vegyértékelektronszerkezetében történik változás egyirányú (irreverzibilis) vagy megfordítható (reverzibilis)
KARBONSAVSZÁRMAZÉKOK
 KABNSAVSZÁMAZÉKK Levezetés Kémiai rokonság 2 2 2 N 3 N A karbonsavszármazékok típusai l karbonsavklorid karbonsavanhidrid karbonsavészter N N 2 karbonsavnitril karbonsavamid Példák karbonsavkloridok 3
KABNSAVSZÁMAZÉKK Levezetés Kémiai rokonság 2 2 2 N 3 N A karbonsavszármazékok típusai l karbonsavklorid karbonsavanhidrid karbonsavészter N N 2 karbonsavnitril karbonsavamid Példák karbonsavkloridok 3
XXIII. SZERVES KÉMIA (Középszint)
 XXIII. SZERVES KÉMIA (Középszint) XXIII. 1 2. FELELETVÁLASZTÁSOS TESZTEK 0 1 2 4 5 6 7 8 9 0 E D D A A D B D B 1 D D D C C D C D A D 2 C B D B D D B D C A A XXIII.. TÁBLÁZATKIEGÉSZÍTÉS Az etanol és az
XXIII. SZERVES KÉMIA (Középszint) XXIII. 1 2. FELELETVÁLASZTÁSOS TESZTEK 0 1 2 4 5 6 7 8 9 0 E D D A A D B D B 1 D D D C C D C D A D 2 C B D B D D B D C A A XXIII.. TÁBLÁZATKIEGÉSZÍTÉS Az etanol és az
Helyettesített karbonsavak
 elyettesített karbonsavak 1 elyettesített savak alogénezett savak idroxisavak xosavak Dikarbonsavak Aminosavak (és fehérjék, l. Természetes szerves vegyületek) 2 alogénezett savak R az R halogént tartalmaz
elyettesített karbonsavak 1 elyettesített savak alogénezett savak idroxisavak xosavak Dikarbonsavak Aminosavak (és fehérjék, l. Természetes szerves vegyületek) 2 alogénezett savak R az R halogént tartalmaz
Spontaneitás, entrópia
 Spontaneitás, entrópia 11-1 Spontán és nem spontán folyamat 11-2 Entrópia 11-3 Az entrópia kiszámítása 11-4 Spontán folyamat: a termodinamika második főtétele 11-5 Standard szabadentalpia változás, ΔG
Spontaneitás, entrópia 11-1 Spontán és nem spontán folyamat 11-2 Entrópia 11-3 Az entrópia kiszámítása 11-4 Spontán folyamat: a termodinamika második főtétele 11-5 Standard szabadentalpia változás, ΔG
Reakciókinetika. Általános Kémia, kinetika Dia: 1 /53
 Reakciókinetika 9-1 A reakciók sebessége 9-2 A reakciósebesség mérése 9-3 A koncentráció hatása: a sebességtörvény 9-4 Nulladrendű reakció 9-5 Elsőrendű reakció 9-6 Másodrendű reakció 9-7 A reakciókinetika
Reakciókinetika 9-1 A reakciók sebessége 9-2 A reakciósebesség mérése 9-3 A koncentráció hatása: a sebességtörvény 9-4 Nulladrendű reakció 9-5 Elsőrendű reakció 9-6 Másodrendű reakció 9-7 A reakciókinetika
Kémiai alapismeretek 11. hét
 Kémiai alapismeretek 11. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2011. május 3. 1/8 2009/2010 II. félév, Horváth Attila c Elektród: Fémes
Kémiai alapismeretek 11. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2011. május 3. 1/8 2009/2010 II. félév, Horváth Attila c Elektród: Fémes
Szerves kémiai szintézismódszerek
 Szerves kémiai szintézismódszerek. Bevezetés Kovács Lajos Problémafelvetés Egy szintézis akkor jó, ha... a legjobb hozamban a legkevesebb lépésben a legszelektívebben a legolcsóbban a legflexibilisebben
Szerves kémiai szintézismódszerek. Bevezetés Kovács Lajos Problémafelvetés Egy szintézis akkor jó, ha... a legjobb hozamban a legkevesebb lépésben a legszelektívebben a legolcsóbban a legflexibilisebben
A kémiai kötés. Kémiai kölcsönhatás
 A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
Savak bázisok. Csonka Gábor Általános Kémia: 7. Savak és bázisok Dia 1 /43
 Savak bázisok 12-1 Az Arrhenius elmélet röviden 12-2 Brønsted-Lowry elmélet 12-3 A víz ionizációja és a p skála 12-4 Erős savak és bázisok 12-5 Gyenge savak és bázisok 12-6 Több bázisú savak 12-7 Ionok
Savak bázisok 12-1 Az Arrhenius elmélet röviden 12-2 Brønsted-Lowry elmélet 12-3 A víz ionizációja és a p skála 12-4 Erős savak és bázisok 12-5 Gyenge savak és bázisok 12-6 Több bázisú savak 12-7 Ionok
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer energia szintek atomokban
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer energia szintek atomokban
Kémiai átalakulások. A kémiai reakciók körülményei. A rendszer energiaviszonyai
 Kémiai átalakulások 9. hét A kémiai reakció: kötések felbomlása, új kötések kialakulása - az atomok vegyértékelektronszerkezetében történik változás egyirányú (irreverzibilis) vagy megfordítható (reverzibilis)
Kémiai átalakulások 9. hét A kémiai reakció: kötések felbomlása, új kötések kialakulása - az atomok vegyértékelektronszerkezetében történik változás egyirányú (irreverzibilis) vagy megfordítható (reverzibilis)
Fémorganikus kémia 1
 Fémorganikus kémia 1 A fémorganikus kémia tárgya a szerves fémvegyületek előállítása, szerkezetvizsgálata és kémiai reakcióik tanulmányozása A fémorganikus kémia fejlődése 1760 Cadet bisz(dimetil-arzén(iii))-oxid
Fémorganikus kémia 1 A fémorganikus kémia tárgya a szerves fémvegyületek előállítása, szerkezetvizsgálata és kémiai reakcióik tanulmányozása A fémorganikus kémia fejlődése 1760 Cadet bisz(dimetil-arzén(iii))-oxid
Szent-Györgyi Albert kémiavetélkedő Kód
 9. osztály Kedves Versenyző! A jobb felső sarokban található mezőbe a verseny lebonyolításáért felelős személy írja be a kódot a feladatlap minden oldalára a verseny végén. A feladatokat lehetőleg a feladatlapon
9. osztály Kedves Versenyző! A jobb felső sarokban található mezőbe a verseny lebonyolításáért felelős személy írja be a kódot a feladatlap minden oldalára a verseny végén. A feladatokat lehetőleg a feladatlapon
Cikloalkánok és származékaik konformációja
 1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
Fémorganikus vegyületek
 Fémorganikus vegyületek A fémorganikus vegyületek fém-szén kötést tartalmaznak. Ennek polaritása a fém elektropozitivitásának mértékétől függ: az alkálifém-szén kötések erősen polárosak, jelentős százalékban
Fémorganikus vegyületek A fémorganikus vegyületek fém-szén kötést tartalmaznak. Ennek polaritása a fém elektropozitivitásának mértékétől függ: az alkálifém-szén kötések erősen polárosak, jelentős százalékban
Országos Középiskolai Tanulmányi Verseny 2009/2010. Kémia I. kategória II. forduló A feladatok megoldása
 Oktatási Hivatal I. FELADATSOR Országos Középiskolai Tanulmányi Verseny 2009/2010. Kémia I. kategória II. forduló A feladatok megoldása 1. B 6. E 11. A 16. E 2. A 7. D 12. A 17. C 3. B 8. A 13. A 18. C
Oktatási Hivatal I. FELADATSOR Országos Középiskolai Tanulmányi Verseny 2009/2010. Kémia I. kategória II. forduló A feladatok megoldása 1. B 6. E 11. A 16. E 2. A 7. D 12. A 17. C 3. B 8. A 13. A 18. C
KÉMIA ÍRÁSBELI ÉRETTSÉGI FELVÉTELI FELADATOK 2004.
 KÉMIA ÍRÁSBELI ÉRETTSÉGI FELVÉTELI FELADATOK 2004. JAVÍTÁSI ÚTMUTATÓ Az írásbeli felvételi vizsgadolgozatra összesen 100 (dolgozat) pont adható, a javítási útmutató részletezése szerint. Minden megítélt
KÉMIA ÍRÁSBELI ÉRETTSÉGI FELVÉTELI FELADATOK 2004. JAVÍTÁSI ÚTMUTATÓ Az írásbeli felvételi vizsgadolgozatra összesen 100 (dolgozat) pont adható, a javítási útmutató részletezése szerint. Minden megítélt
KÉMIA JAVÍTÁSI-ÉRTÉKELÉSI ÚTMUTATÓ
 Kémia középszint 1512 ÉRETTSÉGI VIZSGA 2015. október 20. KÉMIA KÖZÉPSZINTŰ ÍRÁSBELI ÉRETTSÉGI VIZSGA JAVÍTÁSI-ÉRTÉKELÉSI ÚTMUTATÓ EMBERI ERŐFORRÁSOK MINISZTÉRIUMA Az írásbeli feladatok értékelésének alapelvei
Kémia középszint 1512 ÉRETTSÉGI VIZSGA 2015. október 20. KÉMIA KÖZÉPSZINTŰ ÍRÁSBELI ÉRETTSÉGI VIZSGA JAVÍTÁSI-ÉRTÉKELÉSI ÚTMUTATÓ EMBERI ERŐFORRÁSOK MINISZTÉRIUMA Az írásbeli feladatok értékelésének alapelvei
Koordinációs vegyületek (komplexek)
 Koordinációs vegyületek (komplexek) ML n M: központi ion/atom L: ligandum n: koordinációs szám Komplexek 1. Nevezéktan 2. Csoportosítás 3. A komplexképzıdés ismérvei 4. Koordinációs szám, geometria 5.
Koordinációs vegyületek (komplexek) ML n M: központi ion/atom L: ligandum n: koordinációs szám Komplexek 1. Nevezéktan 2. Csoportosítás 3. A komplexképzıdés ismérvei 4. Koordinációs szám, geometria 5.
KÉMIA FELVÉTELI DOLGOZAT
 KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Bevezetés a biokémiába fogorvostan hallgatóknak
 Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 14. hét METABOLIZMUS III. LIPIDEK, ZSÍRSAVAK β-oxidációja Szerkesztette: Jakus Péter Név: Csoport: Dátum: Labor dolgozat kérdések 1.) ATP mennyiségének
Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 14. hét METABOLIZMUS III. LIPIDEK, ZSÍRSAVAK β-oxidációja Szerkesztette: Jakus Péter Név: Csoport: Dátum: Labor dolgozat kérdések 1.) ATP mennyiségének
Szerves kémiai szintézismódszerek
 Szerves kémiai szintézismódszerek 3. Alifás szén-szén egyszeres kötések kialakítása báziskatalizált reakciókban Kovács Lajos 1 C-H savak Savas hidrogént tartalmazó szerves vegyületek H H 2 C α C -H H 2
Szerves kémiai szintézismódszerek 3. Alifás szén-szén egyszeres kötések kialakítása báziskatalizált reakciókban Kovács Lajos 1 C-H savak Savas hidrogént tartalmazó szerves vegyületek H H 2 C α C -H H 2
a. 35-ös tömegszámú izotópjában 18 neutron található. b. A 3. elektronhéján két vegyértékelektront tartalmaz. c. 2 mól atomjának tömege 32 g.
 MAGYAR TANNYELVŰ KÖZÉPISKOLÁK IX. ORSZÁGOS VETÉLKEDŐJE AL IX.-LEA CONCURS PE ŢARĂ AL LICEELOR CU LIMBĂ DE PREDARE MAGHIARĂ FABINYI RUDOLF KÉMIA VERSENY - SZERVETLEN KÉMIA Marosvásárhely, Bolyai Farkas
MAGYAR TANNYELVŰ KÖZÉPISKOLÁK IX. ORSZÁGOS VETÉLKEDŐJE AL IX.-LEA CONCURS PE ŢARĂ AL LICEELOR CU LIMBĂ DE PREDARE MAGHIARĂ FABINYI RUDOLF KÉMIA VERSENY - SZERVETLEN KÉMIA Marosvásárhely, Bolyai Farkas
Víz. Az élő anyag szerkezeti egységei. A vízmolekula szerkezete. Olyan mindennapi, hogy fel sem tűnik, milyen különleges
 Az élő anyag szerkezeti egységei víz nukleinsavak fehérjék membránok Olyan mindennapi, hogy fel sem tűnik, milyen különleges A Föld felszínének 2/3-át borítja Előfordulása az emberi szövetek felépítésében
Az élő anyag szerkezeti egységei víz nukleinsavak fehérjék membránok Olyan mindennapi, hogy fel sem tűnik, milyen különleges A Föld felszínének 2/3-át borítja Előfordulása az emberi szövetek felépítésében
Országos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia I. kategória 2. forduló Megoldások
 Oktatási Hivatal Országos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia I. kategória 2. forduló Megoldások I. FELADATSOR 1. C 6. C 11. E 16. C 2. D 7. B 12. E 17. C 3. B 8. C 13. D 18. C 4. D
Oktatási Hivatal Országos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia I. kategória 2. forduló Megoldások I. FELADATSOR 1. C 6. C 11. E 16. C 2. D 7. B 12. E 17. C 3. B 8. C 13. D 18. C 4. D
Adatgyőjtés, mérési alapok, a környezetgazdálkodás fontosabb mőszerei
 GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
Általános és szervetlen kémia 3. hét. Kémiai kötések. Kötések kialakítása - oktett elmélet. Az elızı órán elsajátítottuk, hogy.
 Általános és szervetlen kémia 3. hét Az elızı órán elsajátítottuk, hogy milyen a kvantummechanikai atommodell hogyan épül fel a periódusos rendszer melyek a periodikus tulajdonságok Mai témakörök elsıdleges
Általános és szervetlen kémia 3. hét Az elızı órán elsajátítottuk, hogy milyen a kvantummechanikai atommodell hogyan épül fel a periódusos rendszer melyek a periodikus tulajdonságok Mai témakörök elsıdleges
I. Atomszerkezeti ismeretek (9. Mozaik Tankönyv:10-30. oldal) 1. Részletezze az atom felépítését!
 I. Atomszerkezeti ismeretek (9. Mozaik Tankönyv:10-30. oldal) 1. Részletezze az atom felépítését! Az atom az anyagok legkisebb, kémiai módszerekkel tovább már nem bontható része. Az atomok atommagból és
I. Atomszerkezeti ismeretek (9. Mozaik Tankönyv:10-30. oldal) 1. Részletezze az atom felépítését! Az atom az anyagok legkisebb, kémiai módszerekkel tovább már nem bontható része. Az atomok atommagból és
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
O k t a t á si Hivatal
 k t a t á si Hivatal 01/01. tanévi rszáos Középiskolai Tanulmányi Verseny Kémia I. kateória. orduló I. FELADATR Meoldások 1. A helyes válasz(ok) betűjele: B, D, E. A lenayobb elektromotoros erejű alvánelem
k t a t á si Hivatal 01/01. tanévi rszáos Középiskolai Tanulmányi Verseny Kémia I. kateória. orduló I. FELADATR Meoldások 1. A helyes válasz(ok) betűjele: B, D, E. A lenayobb elektromotoros erejű alvánelem
