Különbözı porozitású tömb alumínium-oxid rendszerek szol-gél elıállítása. Dr. Sinkó Katalin ELTE TTK Kémia Intézet, Analitikai Kémiai Tanszék
|
|
|
- Valéria Kelemen
- 8 évvel ezelőtt
- Látták:
Átírás
1 Tudományos Diákköri Dolgozat FÖLDESI LÁSZLÓ Különbözı porozitású tömb alumínium-oxid rendszerek szol-gél elıállítása Dr. Sinkó Katalin ELTE TTK Kémia Intézet, Analitikai Kémiai Tanszék Eötvös Loránd Tudományegyetem Természettudományi Kar Budapest, 2008
2 Köszönetnyilvánítás: Mindenekelıtt köszönettel tartozom témavezetımnek Dr. Sinkó Katalinnak, felelısségteljes oktatásáért, a dolgozat elkészítésében nyújtott segítségéért, rendkívül értékes útmutató tanácsaiért, türelméért, bátorításáért, a SAXS mérések elvégzéséért és kiértékelésben nyújtott segítségéért, valamint a kísérletekhez szükséges anyagokat biztosításáért. Köszönet az Universität Wien, Institute of Materialsphysic laboratóriumának, Herwig Peterliknek, hogy lehetıvé tették a SAXS mérések elvégzését. Szeretnék köszönetet mondani Rohonczy Jánosnak az NMR spektrumok elkészítéséért, valamint Pénzes Csanád Botondnak az AFM és Kubuki Shiro-nak a nagy szilárdságú mintákon elvégzett SEM vizsgálatokért. 2
3 Tartalomjegyzék: I. Bevezetés 4 II. Irodalmi áttekintés 5 II.1 Szol-gél módszer ismertetése 5 II.2 Gélek elıállítása alkoxid prekurzorokból 6 II.3 Gélek elıállítása szervetlen prekurzorokból 7 II.4 Célkitőzés 9 III. Kísérleti munka 10 III.1 Felhasznált anyagok 10 III.2 Az AlOOH gélrendszerek elıállítása 10 III.2.1 A gélesítés paraméterei 11 III.2.2 Porózus szerekezet elıállítása 12 III.3 Nagyszilárdságú tömb aluminium-oxid rendszerek elıállítása 12 IV. Szerkezetvizsgálat 14 IV.1 Kisszögő-röntgenszórás vizsgálatok 14 IV.2 Mágneses magrezonancia spektroszkópiai vizsgálatok 18 IV.3 Keménységvizsgálatok 20 IV.4 Mikroszkópos felületi vizsgálatok 20 V. Összefoglalás 23 VI. Irodalomjegyzék 24 VII. Rövidítések jegyzéke 25 3
4 I. Bevezetés Az alumínum-oxid-hidroxid alapú gélek felhasználása az utóbbi évek során egyre inkább elterjedté vált (pl.: γ ; θ Al 2 O 3 -ok kiindulási anyagaként is használatosak). A xeroés aerogélek szóba jöhetnek mint katalizátorhordozók, adszorbensek, hıszigetelık és membrán-anyagok. Kolloidiális alumínium-oxid részecskéket alkalmaznak katalizátorokként, valamint a kerámiaiparban is fontos szerepet játszanak. Alacsonyabb hımérsékleten ( 800 C) eddig csak kisebb-nagyobb porozitású alumínium-oxid kerámiákat állítottak elı, tömör kerámiák szintetizálása csak olvasztással, magasabb hımérsékleten ( 2000 C) valósítható meg. Munkánk során szol-gél technikával, a tanszéken már korábban kidolgozott eljárás segítségével alumínium-nitrát és propanol reakciójából kis porozitású, tömör, kemény tömbkerámiákat és nagy porozitású rugalmas, tiszta hidrogéleket állítottunk elı. A szol-gél módszer legnagyobb elınye a hagyományos olvasztásos technikákkal összevetve, hogy sokkal alacsonyabb hımérsékleten, kevesebb energia befektetésével, környezetbarát eljárással juthatunk a kívánt végtermékekhez. Az oldattechnika végett elıre eltervezett, kívánt mérető részecskék készítése is megvalósítható, melyekkel új kémiai szerkezetek állíthatóak elı, számunkra kedvezı tulajdonságokkal. Vizsgálataink során arra a kérdésre szerettünk volna választ kapni, hogy az elıállítás pármétereinek változtatása, milyen hatással van a termékek mechanikai tulajdonságaira és porozitására. 4
5 II. Irodalmi áttekintés II.1 Szol-gél módszer ismertetése A szol-gél módszer legnagyobb elınye a hagyományos olvasztásos technikákkal összevetve, hogy sokkal alacsonyabb hımérsékleten, kevesebb energia befektetésével juthatunk a végtermékekhez. Az eljárás lényege, hogy oldatfázisban kémiai reakcióval fémhidroxid kötések hozhatók létre, melyek perkurzorként szolgálnak a továbbiakban kémiai térhálósítással létrejövı, nagyobb hányadban fém-oxigén kötések által összetartott gélszerkezetnek, majd a végsı hıkezelés után kialakuló kerámiaszerkezetnek. A szintézis megvalósítására két perkurzor-típus jöhet számításba; szerves csoportokat tartalmazó fémalkoxidok ill. szervetlen sók. A szol-gél módszer célja, hogy már nanomérettartományban is tervezhetı legyen az elıállítandó anyagok szerkezete, a lejátszódó folyamatok elsı lépéseitıl kezdve. A tayloring technique -nek nevezett, tervezett szintézis során, meghatározott mérető és geometriájú részecskék és szerkezetek alakíthatóak ki. A pontosan kialakított kémiai szerkezet eredményeképpen a fizikai és kémiai tulajdonságok is egyértelmően befolyásolhatóak. A szol-gél módszer energetikailag is jóval kedvezıbb reakció utakra ad lehetıséget, ezáltal jóval költséghatékonyabb eljárás az olvasztásos technikákhoz képest. Tisztább, homogénebb összetételő végterméket eredményez, kevesebb melléktermék képzıdik és ebbıl kifolyólag környezetkímélıbb technika. Hátránya, hogy a gélesítés és a szárítás során általában nagymértékő összehúzódás következik be, illetve az oldószergızök eltávozása a kialakult monolit szerkezet repedezését okozza. További hátrány alkoxid prekurzorok esetében a magas ár és a lassú szárítási folyamatból adódó hosszú elıállítási idı. A szol-gél módszer részlépései 1. ábra Két, egymást követı alapfolyamatra bontható a szol-gél módszer. Elsı lépésben a prekurzor molekulák hidrolízise következik be, majd ezt követıen kondenzációs reakciók játszódnak le, aminek következtében nanomérető részecskék képzıdnek. Késıbb ezekbıl 5
6 alakul ki a gélváz térhálós szerkezete. A képzıdött részecskék szolvátburokkal rendelkeznek stabil kolloid rendszert, un. szolt képeznek. A tömbfázison belül ezek mobilisak és nem alkotnak térhálós szerkezetet. Porok vagy filmek elıállítása esetében a szol állapotnak igen nagy jelentısége van. A második lépésben kerül sor a gélképzésre. A még mindig nagy mennyiségő folyadékot tartalmazó rendszerben a kolloidrészecskék közötti kapcsolat kialakításával háromdimenziós, folytonos szerkezethez jutunk. Ezt gél állapotnak nevezzük. Az oldószer eltávolítása többnyire 100 C alatti hımérsékleten történik, majd ezt a hıkezelés követi, melynek hımérséklete általában C közé esik, ennek során kialakul és rögzül a végleges kötésrendszer, a melléktermékek, valamint a felszíni OH-csoportok eliminálódnak. A szol-gél módszer legfontosabb lépéseit ill. a szintézis különbözı fázisaiban keletkezı termékeket szemlélteti az 1. ábra. II.2 Gélek elıállítása alkoxid prekurzorokból Alumínium-alkoxidok használata esetén [1] elsı lépésként a prekurzor hidrolízise (1) játszódik le. E folyamat során, vízmolekulák nukleofil támadásával a prekurzor (Al(OR) 3 ) alkoxicsoportja hidroxilcsoportra cserélıdik ki. Ezt követi a kondenzációs reakció (2), amely során kialakul a túlnyomó részt Al-OH/(O)-Al kötések alkotta térhálós szerkezet. A reakció általában alacsony hımérsékleten megy végbe ( 100 C) nagy mennyiségő víz jelenlétében. A második lépésben kerül sor a gélképzésre. A még mindig nagy mennyiségő folyadékot tartalmazó rendszerben további kondenzációs és hidrolízises reakciók játszódnak le a kolloidrészecskék között. Az új kapcsolatok kialakításával háromdimenziós, folytonos szerkezethez jutunk. Ezt gél állapotnak nevezzük. Al(OR) 3 + H 2 O Al(OR) 2 (OH) + ROH (1) Al(OR) 2 (OH) + Al(OR) 2 (OH) (OR) 2 Al OH Al (OR) 2 + H 2 O (2) A legismertebb alkoxid prekurzorokat használó technika kidolgozása Yoldas nevéhez főzıdik. Alumínium-iso-propoxidot, illetve, alumínium-sec-butoxidot hidrolizált vízfeleslegben, savkatalizátor jelenlétében [2-3]. A hidrolízist meleg vízzel végezte, melyet a sztöchiometrikus mennyiségnek szorosával végzett. Ennek eredményeképpen amorf csapadékkiválást tapasztalt, majd ezt a csapadékot savval peptizálta. A peptizáció terméke szol, melybıl az oldószer lassú elpárologtatásával nyerhetı gél. Szobahımérsékleten lejátszódó reakció terméke amorf gél, ami bayeritté (Al(OH) 3 ) alakul 24 óra állás után. Magasabb hımérsékleten, 80 C-on, stabil kristályos monohidroxid, böhmit keletkezik Szobahımérsékleten elindított reakció esetében melegítéssel megakadályozható a bayeritté való átalakulás. A reakció optimális lejátszódásához szükséges, hogy az alkalmazott sav anionja ne létesítsen komplexet az alumínium-ionnal, és kis koncentrációban legyen jelen. A vizsgálatok során Yoldas azt az eredményt kapta, hogy a sav/hidroxid mólarány értékének 0,03 felett kell lennie ahhoz, hogy tiszta szol képzıdjön, viszont ha az arány 0,1-nél nagyobb, a gél nem lesz monolit. Yoldas vizsgálatai kimutatták, hogy a savas peptizáció ideális hımérséklete 80 C fölött van, ennél alacsonyabb hımérsékleten a reakció igen lassan megy csak végbe és gyakran igen hosszú idı múlva keletkezik szol. Melegítéssel azonban órák alatt tiszta szolt lehet kapni. A Yoldas által kidolgozott technika sok más, szintézis kiindulópontja, például gél filmek, illetve alumina nanoporok elıállításának is alapja. Pierre és Uhlmann szerint [4] a nagy vízfeleslegben történı hidrolízis, majd peptizáció termékeként fibrilláris böhmit részecskékbıl álló szol készíthetı, mely lemezes szerkezetővé 6
7 alakul. Szobahımérsékleten Al(NO 3 ) 3 és Al(OC 4 H 9 ) prekurzorokból kiindulva állítottak elı AlOOH gélt szol-gél módszerrel [5], a gélesedés folyamatát, melyet a párolgás okozott, savval és lúggal is katalizálták. Szárítás utáni termék fehér színő, kissé transzparens monolit gél volt, amelybıl fél év múlva szálasítható állapotba került. A kapott termékek amorf szerkezettel bírtak, böhmit és bayerit alpúak voltak. Columban [6] különféle szerves oldószerekben oldott Al(OBu) 3 -ot, melyet a levegı nedvességtartalmával hidrolizált. Optikailag tiszta monolit gélt nyert e lassú folyamat termékeként. Anyagmennyiségtıl függött a folyamat lejátszódásának ideje. Hevítéssel, C között, üveges aluminium-oxidot sikerült elıállítania. A gél szárítása közben megfigyelték, hogy 300 C alatt az oldószer távozik a rendszerbıl, 400 C-ig a pórusokban található víz távolítható így el és C között történik az OH-csoportok eliminációja. Ettıl is magasabb hımérsékleten, 800 C felett, a repedezések száma intenzíven növekszik, majd 1150 C-nál abbamarad, mert a gélbıl teljes egészében α-al 2 O 3 keletkezik. Zhang és munkatársai [7] Kaptonra, mely egy rendkívül hıálló poliamid típusú mőanyag, szol-gél eljárással felvitt böhmit filmek oxigén hatására lezajló erózióját vizsgálták. Aluminium-izopropoxid perekurzort használtak a böhmit film készítéséhez. A hidrolízist C-os vízben végezték, a használt prekurzor szorosának megfelelı moláris mennyiségő vízzel. Ezután salétromsavval peptziálták a keletkezett csapadékot, 1/0.23 mólarányban. Ezután 24 órán keresztül ülepedni hagyták a keletkezett elegyet 90 C-os hımérsékleten, lezárt edényben. A lúgos kezelésnek alávetett hordozóra vitték fel az így készített gél filmet, majd annak, oxigén hatására bekövetkezı erózióját vizsgálták. Egy új szol gél módszert fejlesztett ki nagy felszíni porozitású γ-aluminium-oxid elıállításra Kureti és Weisweiler [8]. Különleges reaktorban, vízgızzel reagáltatták az alumínium-alkoxidot. Aluminium tri-sec-butoxid-ot alakalmaztak prekurzorként és acetonban oldották. A keverék stabil lyogelhez vezetett. Szárítás és pirolízis után nagy porozitású γ- aluminium-oxidot kaptak, amit xerogéllé alakítottak. II.3 Gélek elıállítása szervetlen prekurzorokból Szervetlen sók kiindulási anyagokként történı alkalmazása során, a vizes oldatuk phját bázikus reagenssel növelve, hidroxid, oxid-hidroxid csapadékok válnak ki vizes oldatukból. Ezt követı savas peptizációval a csapadékból szolt, majd gélt lehet elıállítani [ ]. A hidrolízis körülményeitıl függıen a szol tartalmazhat gömb, illetve szál alakú részecskéket is. Alumínium-sók lúgos hidrolízisének terméke alumínium-oxi-hidroxid csapadék. Az Al 3+ -kation vizes oldatban hexaakva-aluminát-komplex-ion formájában van jelen és nagy töltése és kis mérete lévén a hozzá koordinálódott vízmolekulák polarizációja által, a komplex ion képes proton leadására. Az így kialakult OH-ligandummal rendelkezı komplex ionok olációval dimereket hoznak létre egy vagy két közös hidroxid hídon keresztül. A kondenzációs és hidrolízises folyamatok újbóli lejátszódása polikationok képzıdését eredményezheti, melyek térhálós szerkezetet alkothatnak. Az oldatban lévı részecskék eloszlása erısen koncentráció-függı, az Al 3+ - kation csak 0,5 M alatt létezik, e fölött megnı az oligomerek aránya, melyek fıként tetra- és pentamerek. Ha az OH/Al arány eléri a 2,5-öt, akkor amorf csapadék válik ki. Ez az anyalúggal érintkezve oldódás és rekrisztallizáció során valamilyen jobban kristályosodott formává alakul, ami lehet böhmit (AlOOH), bayerit (Al(OH) 3 ) vagy gibbsit (Al(OH) 3 ). Másik lehetséges út a szervetlen sók alkalmazásánál, ha a víz helyett más oldószert, kis szénatomszámú, nyílt láncú alkoholokat használnak fel. Az így megvalósuló szintézisek 7
8 során kristályvizes szervetlen só a prekurzor, ugyanis a só víztartalmának nélkülözhetetlen szerepe van a hidrolízises reakciók végbemenetelénél [13]. A tanszékünkön kifejlesztett eljárásnak [12-14] köszönhetıen, Al(NO 3 ) 3.9H 2 O és 1- propanol elegyébıl, alumínium-oxid-hidroxid szálakat és porózus tömböket lehet elıállítani. A kristályvizes sót propanolban feloldva, majd C-on refluxáltatva, az oldószer nagy részének eltávolítása után igen sőrő, viszkózus anyagot lehet elıállítani, mely óvatos szárítással, kis nyílással ellátott edényben, 70 C-on, pár óra alatt kiválóan szálasítható anyaggá alakul. Hosszabb szárítási idı alkalmazásával, a kapott termék szilárd, makropórusos hab, mely rendkívül jól duzzasztható vízzel, akár tömege kilencszeresének megfelelı mennyiségő vizet is képes felvenni, és az így készített rugalmas hidrogél sokáig eltartható. Szobahımérsékleten állva, a hidrogél fokozatosan veszít víztartalmából, míg kemény, taraszparens, színtelen xerogéllé alakul. A gélszerkezetben az Al 3+ -ionokat megosztott hidroxid és karboxilát csoportok kapcsolják össze. A propanol egyrészt, oldószerként szerepel, másrészt emellett csökkenti az oldat polaritását. A kis polaritású oldatban a nitrátion protonfelvétele kedvezı folyamat, az alkalmazott hımérsékleten az így képzıdı salétromsav viszont hıbomlást szenved és nitrózus gázok formájában távozik a rendszerbıl. A savas oldatban a propanol oxidációja is lejátszódik, mely ecetsavat eredményez, ami a gélszerkezetben kétfogú ligandumként vesz részt a térszerkezet kialakításában. Az Al-nitrát alkoholban való hidrolízisét Akitt tanulmányozta [15]. Propanolban melegítve az Al(NO 3 ) 3.9H 2 O-t, amorf szerkezető bázikus Al-só kiválását tapasztalta. A kivált sóban a OH/Al arányt 2 körülinek találta és ebbıl nagyfokú hidrolízisre következtetett. Akitt szerint a propanolos közegben a nitrát-ion bázikus tulajdonságúvá válik, protonáldóik, és ezáltal elısegíti az Al 3+ -ion hidrolízisét. Ibrahima, és Abu-Ayanab,[16] alumina nanoporok elıállítását végezte és az alkalmazott perkurzorok típusának hatását vizsgálták a készített alumínium porokra, amelyeket urea-formaldehid-gyantán állítottak elı Al 3+ -ionon keresztül, Al-észter és inorganikus Al-sóból, -szulfátból és -foszfát-hidrátból. Az organikus részbıl kiégetett porokat vizsgálták. Az alumínium észter nem képezett kersztkötéseket a gyanta anyagával. A kapott Al por az észter égéstermékeként jön létre. Hevítve ezeket C között más-más kristályszerkezető porokat kaptak. A fı termékben, a foszfát-ion kötésben maradt. Zhixian Hao és kollégái [17] inorganikus sókból alumínium-oxi-hidroxi gélek elıállítását végezték szol-gél eljárással. A zselatinizálódásra épülı egyszerő eljárás dolgoztak ki, alumínium-só és propilén-oxid nyitott győrőjő reakciójával, alumina gyártására. Az aluminium-nitrátot propilén oxiddal elegyítették, és zselatizálták etanolos oldatban. Miután szárították és kalcinálták, légköri nyomáson, egyfajta amorf aluminát kaptak, jól definiált mezoporózus struktúrával. Folyékony nirtogénnel végzett adszorpció után port kaptak. Propilén-oxid moláris mennyiségének növelésével a szemcseméret 6nm-ig volt növelhetı. A spektroszkópiás vizsgálatok szerint a propilén-oxid protont vett fel, ami az Al 3+ -iont hidrolízisre és kondenzációra késztette. Az Al-só és vízmentes etanol elegyét reagáltatták, mágneses keverés közben, szobahımérsékleten, feloldódás után adták hozzá a propilénoxidot. Kevertették tovább az elegyet, majd állni hagyták. A traszparens oldat begélesedett, észlelhetı hımérsékletemelkedés mellett. A gélt összetörték, szárították 70 C-on, majd hıkezelésnek vetették alá C között. Zeng és munkatársai böhmitet állítottak elı AlCl 3 és NH 3 oldat elegyítésével. Egy nap után a kicsapódott AlOOH-t leszőrték, majd desztillált vízzel mosták. Az így kapott szolt ecetsavval peptizálták melegítés közben, majd 72 órát szárították, melynek eredményeként fehér, porszerő anyagot kaptak [18]. Seok és társai az AlOOH elıállítását AlCl 3.6H 2 O és ammónia-oldat elegyítésével végezték. Az elegyet szobahımérsékleten kevertették, az így keletkezı gélt szőrték, és vízzel mosták a képzıdı ammónium-klorid eltávolítása végett, majd 100 C-on szárították [19]. 8
9 II.4 Célkitőzés Kísérleteink célja AlOOH tömb minták elıállítása volt, széles tartományban változtatva a monolit szerkezetek porozitását. A kísérletek alapjául a tanszéken korábban kifejlesztett szol-gél eljárás szolgált [12-14]. A vizsgálatokban arra kerestünk választ, hogy milyen paraméterek segítségével lehet a porozitást, a tömb minták mechanikai tulajdonságait befolyásolni. Két egymástól szignifikánsan eltérı porozitású és mechanikai szilárdságú alumíniumoxid-hidroxid rendszert készítettünk. Az általunk elıállított rendszerek, a tömbgélek és a tömkerámiák egy széles porozitás-tartomány két végpontját képviselik. Az elıállított hidrogélek igen nagy porozitású, kis mechanikai szilárdságú rendszerek. A tömb alumíniumoxid kerámiák kis porozitásúak, és nagy mechanikai szilárdsággal rendelkeznek. A paraméterek optimalizálásával meghatározott mérető és geometriájú részecskék és szerkezetek alakíthatóak ki. A közös kiindulási alapból, az alumínium-só és alkohol elegyébıl, szol-gél technikával, rendkívül változatos, porozitását és mechanikai szilárdságát tekintve széles skálán mozgó, szerkezeteket lehet elıállítani. Ezzel az eljárással készíthetıek igen nagy viszkozitású anyagok melyek kitőnıen szálásíthatóak, vékony film rétegek, felületi bevonatok, különbözı szemcsemérető alumínium-oxid porok és monolit rendszerek is. Az alkalmazott technika legfontosabb elınyei közé tartozik, hogy általa kontrolláltan, rendkívül olcsón és kevés melléktermék keletkezésével, igen környezetbarát módon lehet a kívánt végtermékeket elıállítani. Vizsgálataink alapján megállapítható, hogy az alumínium-nitrát és propanol elegyének refluxáltatási idejével jól szabályozható az elıállítható gélszerkezet. Rövidebb reflux idık alkalmazásával csak kevesebb számú kötés alakítható ki, az így készített gélek, kevésbé porózusosak, jobban szinterelhetıek, nagy szilárdságú tömbkerámiák megfelelı alapanyagai. A hosszabb reakcióidık alkalmazásával végrehajtott gélesítés háromdimenziós szerkezet eredményez. Az így elıállított minták vízben duzzaszthatók a legnagyobb mértékben, mely nagy porozitású, monolit tömb gélekhez vezet. A tömbgélek szerkezetét kisszögő-röntgenszórással (SAXS) és mágnesesmagrezonancia (NMR) mérésekkel tanulmányoztuk. A monolit kerámiák felületét scanning elektronmikroszkópos felvételekkel (SEM) és atomi erı mikroszkópiával (AFM) jellemeztük. A tömbkerámia termék mechanikai szilárdságát keménységmérésekkel (Vickers-féle keménységmérı berendezéssel) ellenıriztük. 9
10 III. Kísérleti munka III.1 Felhasznált anyagok - kristályos alumínium-nitrát (Al(NO 3 ) 3 *9H 2 O M=375,13 g/mol; Reanal) - 1-propanol (C 3 H 7 OH M=60,10 g/mol; Reanal) III.2 Az AlOOH gélrendszerek elıállítása Az alkogélek elıállítása során a már korábban a tanszéken kifejlesztett módszert alkalmaztuk [12-14], Az alumínium-nitrát/propanol mólarány 1: 4,5 volt. A nagy szilárdságú alumínium-oxid tömbök gélrendszereken keresztüli elıállítására kidolgozott eljárás több lépésbıl áll. Az elsı lépés a gélkészítés, melynek alapfolyamatai az Al(NO 3 ) 3 9 H 2 O hidrolízise (3) és kondenzációja (4) 1-propanolban 80 C-on. Al(H 2 O) H 2 O Al(H 2 O) 5 (OH) 2+ + H 3 O + (3) Al(H 2 O) 5 (OH) + Al(H 2 O) 5 (OH) Al(H 2 O) 5 -OH-(H 2 O) 5 Al + H 2 O (4) Elsı lépésként a kristályvizes alumínium-nitrátot 80 C-os vízfürdıt alkalmazva 1- propanolban oldottuk. Állandó kevertetés mellett, 80 C-on refluxáltattuk a reakcióelegyet. A rendszerbıl egy órás refluxáltatást követıen nitrózus gázok távozása tapasztalható. A refluxidıt 2 és 48 óra között változtattuk. A refluxáltatás után az oldószer nagy részét 60 Con, vákuumbepárlóval távolítottuk el. A tömegcsökkenés mértéke a kiindulási tömeghez képest ekkor 40 %-os. Az így elıállított viszkózus folyadék további óvatos, 80 C-os szárítása makropórusos habokat eredményezett. A kapott szilárd hab tömege a kiindulási elegy 28%-a. További 80 C-os szárítás során újra fejlıdött nitrózus gáz. A már kialakult szilárd hab nem oldható acetonban, és 1-propanolban. Korlátozottan oldódik metanolban, etanolban és etilénglikolban. Vízben kiválóan oldódik, de ha az oldat a szilárd hab tömegére nézve 10 m/m %-nál töményebb, akkor állás során, gyengén elasztikus hidrogél keletkezik. A hidrogél képzıdéséhez minimum 24 óra refluxáltatás szükséges, ennyi idı alatt alakul ki megfelelı kötésrendszer. Korábbi vizsgálatok szerint a szilárd hab saját tömege mintegy kilencszeresének megfelelı mennyiségő vizet is fel tud venni. A duzzasztás során szerzett tapasztalatok szerint a duzzasztás eredményesebb, és gyorsabb volt, ha meleg, 70ºC-os habot oldottunk. Továbbá a hab beletapad a tároló edénybe, ha a habot nem választjuk le az edény faláról, és nem törjük kissé össze, az oldás nem lesz teljes, olajszerő réteg marad az oldat alján és nehezen szilárdul meg a hidrogél, esetleg folyadék állapotú maradhat. A megszilárdulás egyébként gyakran igen hamar, mintegy 5 percen belül bekövetkezik. A duzzasztáshoz alkalmazott víz tömegének növelésével (> 4-szeres duzzasztás) a gélek egyre opálosabbak lettek. Míg a mintával azonos mennyiségő vízzel történt duzzasztás esetén (1-szeres duzzasztás) a termék gyakorlatilag hab maradt, a dupla mennyiség hatására lehetett a legtisztább, legátlátszóbb gélt kapni. Ez a hidrogél óvatos, lassú szárítással átlátszó, kemény kisebb porozitású xerogéllé alakul. Más, szervetlen sókat alkalmazó preparációs módszerrel szemben itt a víz szerepe csak a hidrlízisre korlátozódik. 10
11 III.2.1 A gélesítés paraméterei A gélesítéshez legmegfelelıbb oldószernek a tanszéken korábban elvégzett kutatások alapján az 1-propanol bizonyult [12-14]. Az oldás mellett a propanol elsıdleges szerepe, hogy csökkentse az oldat polaritását, ez a körülmény a nitrátion protonfelvételének kedvez, és az ez úton képzıdı salétromsav, a reakció hımérsékletén, 80 C-on hıbomlást szenved, nagy mennyiségő nitrózus gáz formájában távozik a rendszerbıl. Metanol vagy etanol használata esetén ez a csökkenés nem elég nagy, butanol alkalmazásakor pedig túlzott mértékővé válik. A salétromsav bomlása egyenletesen megy végbe, eközben az oldat ph-ja folyamatosan nı, ami elısegíti a kondenzációt. Mellékreakcióban a propanol a még erısen savas közegben ecetsavvá oxidálódik, mely kétfogú ligandumként vesz részt a gélszerkezet kialakításában [13]. A gélesítés ideális hımérsékletének 80 C bizonyult. Alacsonyabb hımérsékleten a reakció sebessége igen nagymértékben lelassul, e hımérséklet felett viszont csapadékkiválás észlelhetı. [12-14]. Az alumínium-nitrát már szobahımérsékleten is oldódik kis szénatom számú alkoholokban. Az alkalmazott 1-propanol esetében ez 45g só/100g alkohol, ami 1:11,5 mólaránynak felel meg. A hımérsékletet emelve az oldhatóság nı. Azon szintézisek során, amikor a reakció hımérséklete nagymértékben meghaladja a 80 C-ot, 24 órás refluxidı után csapadékkiválás észlelhetı. 80 C-on még 48 órás reakcióidı után sem észlelhetı csapadékkiválás. A gélesítés optimális idıtartama függ a kívánt terméktıl. Leghatékonyabban a refluxáltatás idejével lehet a szerkezetet befolyásolni. A különbözı refluxáltatási idık alkalmazásával kapott termékek bepárlása más-más tapasztalatokat hozott, a hidrolízises és kondenzációs reakciók lejátszódásának különbözı mértéke miatt. Rövidebb, 2, 4, 6 órás refluxáltatás esetén a vákuum bepárlás végeredménye opálos, fehér, igen viszkózus folyadék lett, és nem kaptunk tömb hidrogélt. Hosszabb reakcióidı esetén, 8, 12, 24, 36, 48 óra, a bepárlás után az oldat színtelen, áttetszı, igen sőrő, nagy viszkozitású, jól szálasítható anyag, melybıl könnyen lehet tömb hidrogélt készíteni. Már a 12 órás reflux esetében teljes biztonsággal tömb hidrogél a duzzasztás eredménye, nem pedig folyadék. A kapott hidrogélek igen sokáig stabilak, alacsonyabb hımérsékleten (hőtıszekrényben), zárt edényben tárolva, szinerézis csak nagyon kis mértékben játszódik le. Kis porozitású végtermék elıállítása esetén a vákuumbepárlást követı, további egy órás, 80 C-os kevertetés hatására, további nagy mennyiségő nitrózus gáz távozik a rendszerbıl, mely kezdetben igen intenzív, majd körülbelül egy óra múlva megszőnik. Az összes nitrát-tartalom csak magasabb hımérséklető szárítással távolítható el teljesen. A szárítás, illetve a hıkezelés hımérséklete és módja is változik attól függıen, hogy mi a kívánt végtermék. Nagy porozitású monolit tömbök elıállítása esetén az alkalmazott hosszabb reakcióidık leteltét és a vákuumbepárlás folyamatát követıen 80 C-os hıkezelésnek vetettük alá a nagy viszkozitású, folyékony halmazállapotú mintákat. A szárítás kezdetén nitrózus gáz fejlıdése tapasztalható, az elegy viszkozitása csökken, majd fokozatos buborékképzıdés tapasztalható, végül makropórusos hab képzıdik. Kis porozitású és nagy mechanikai szilárdságú termék elérése érdekében, a rövidebb reakcióidık alkalmazása és az oldószer nagy részének bepárlása után egy 80 C-os, egy órás kevertetési lépés közbeiktatása következett, mely a nitrát tartalom nagyobb részét eltávolítja. A teljes eltávolítás érdekében magasabb hımérséklető, 400 C-os hıkezelés alkalmazása a megfelelı. 11
12 III.2.2 Porózus szerkezet elıállítása A porozitás szabályozása egyrészt a nedves gélek odószertartalmán keresztül, illetve a gélek szárításával lehetséges legegyszerőbben. Nagy porozitás eléréshez, vagyis aerogél készítéshez szén-dioxiddal történı szuperkritikus-szárítás szükséges. Eddigi kísérleti tapasztalataink szerint a hidrogél nagyon nehezen szárítható szuperkristikus körülmények között a víztartalom miatt. Viszont tömb gél szükséges a szuperkrtikis szárításhoz. A víz helyett a metil-alkohol, mint duzzasztószer használata látszik célravezetınek, ezzel kapcsolatos kísérletek jelenleg is folynak. Al(NO 3 ) 3.9H 2 O + C 3 H 7 OH Viszkózus termék (gél) Refluxoltatás 48 óra, vákuumbepárlás Makropórusos hab Szárítás 80 C-on 24 óra Duzzasztás Nagy porozitású monolit gél Aerogél Szuperkitikus szárítás Nagy porozitású rendszer elıállításának folyamatábrája 2. ábra III.3 Nagyszilárdságú tömb aluminium-oxid renszerek elıállítása Ebben a kísérletben a cél kis porozitású, tömör, jó mechanikai tulajdonsággal rendelkezı monolit rendszer elıállítása. Az alapanyag most is Al-nitrát, az oldószer pedig a már jól bevált 1-propanol. A refluxáltatás idejét viszont rövidebb idıben kell korlátozni, a késıbbi jó préselhetıség eléréséhez. A refluxáltatást vákuum bepárlás követ. Az így kapott üveges állapotú anyag hıkezelése viszont nem ad monolit anyagot, mert a feldolgozás során nagy mennyiségő gáz fejlıdik, széttördelve a szerkezetet. Ennek elkerülésért megpróbáltuk a nitrózus gázokat már az elıállítási folyamat egy korábbi fázisában eltávolítani, hogy a még folytatódó kondenzációs reakciók képesek legyenek újra tömb szerkezetet létrehozni. A megoldást egy a vákuum bepárlást követı, 80 C-os, egy órás kevertetés jelentette, mely alatt nagy mennyiségő illékony anyag távozik a nagyobb koncentrációnak köszönhetıen. A nitrát tartalom teljes eltávolítása érdekében 400 C-on még egy hıkezelésnek vetettük alá a mintákat. Az így kapott hófehér, habszerő terméket elporítva, majd tablettázó berendezéssel pasztillázva ( 40 tonna/cm 2 nyomás mellett) kompakt tömböket nyertünk. Ezeket a 12
13 tablettákat további hıkezelésnek alávetve, C-on szinterelve tömbkerámiákhoz jutottunk, melyek keménységét Vickers-féle keménységméréssel vizsgáltuk. Al(NO 3 ) 3.9H 2 O + C 3 H 7 OH Refluxoltatás 2-6 óra, vákuumbepárlás Csapadékos termék (gél) Kevertetés 80 C-on 1 óra Nagy viszkozitású termék Hıkezelés 400 C-on 1 óra Habszerő termék Porítás, tablettázás, szinterelés 800 C-on Monolit kerámia Kis porozitású rendszer elıállításának folyamatábrája 3. ábra 13
14 IV. Szerkezetvizsgálat IV.1 Kisszögő röntgenszórás vizsgálatok A 2 óra refluxáltatással készített nagyobb szilárdságú monolit minták elıállítási folyamatát kísérı SAXS-vizsgálatok (4. ábra) szerint 2h refluxáltatás után létre jövı szerkezet (1. minta) strukturálatlan, kis szórási intenzitású az adott vizsgálati (kisszögő) tartományban. A vákuum bepárlás után kapott jól szálasítható, viszkózus minta szerkezete függ a bepárlás mértékétıl. Ha kisebb mértékő a bepárlás a szerkezet (2a. minta) strukturálatlan marad, bár egy 1,3 nm-es karakterisztikus távolság már bizonytalanul feltőnik. Nagyobb mértékő bepárláskor a minta elkezd kikristályosodni (0,5 1 Å -1 q-tartomány éles diffrakciós csúcsai). A diffrakciós csúcsok kocka ( cubic gyroid ) rácshoz tartoznak. További 1h 80 ºC-os kevertetés a kristályosodás mértékét nem növeli tovább, bár a gélszerkezet elkezd strukturálódni, némi rendezettséget mutat (3a. és 3b. minták). Az 1,3 nm-es távolság mellett egy 13 nm körüli is feltőnik. Meglepetésre a 400 ºC-os hıkezeléssel kialakított minták nem mutatnak kristályos orientációt, sem a nagyobb, sem a kisebb koncentrációjú keverékben. 3b minta 3a minta 2b minta 2a minta 1 minta q (Å -1 ) Szilárd, kis porozitású, monolit minták elıállítási folyamatát (2h refluxáltatás) kísérı SAXS-vizsgálatok 4. ábra 1. minta: 2h refluxáltatás után; 2a. minta: vákuum bepárlás után - kisebb koncentrációjú keverék kialakításakor; 2b. minta: vákuum bepárlás után - nagyobb koncentrációjú keverék kialakításakor; 3a. minta: további 1h kevertetés 80 ºC-on kisebb koncentrációjú keverékkel; 3b. további 1h kevertetés 80 ºC-on nagyobb koncentrációjú keverékkel; 4. minta: 400 ºC-os hıkezelés után. 14
15 A 48 óra refluxáltatással nagy porozitású minták kialakítása is lehetıvé válik, ezt a folyamatot követı SAXS-vizsgálat (5. ábra) szerint 48 óra refluxáltatás után sincs még jól rendezett szerkezet, a minták gyenge szórási intenzitást mutatnak a szupramolekuláris mérettartományban (1a. és 1b. minták). A vákuum bepárlás karakterisztikus rendezettséget eredményez. A széles csúcsok nem mutatnak azonos kvázi kristályos orientációhoz való tartozást, a jellemzı méret, amelyet a csúcsokhoz lehet rendelni: nm, illetve 10 ±0,1 nm (2a. és 2b. minták). További 24 h zárt körülmények közötti, 80 ºC-os hın tartás eltünteti a strukturáltságot, homogén, véletlenszerően összekapcsolódott aggregát szerkezet alakul ki. Az aggregátumok felületét 2,23 ±0,05 felületi fraktál dimenzióval lehet jellemezni (3. minta). Intenzitás (a.u.) 3 minta 2b minta 2a minta 1b minta 1a minta q (Å -1 ) Porózus monolit minták elıállítási folyamatát (48h refluxáltatás) kísérı SAXS-vizsgálatok 5. ábra 1a. minta: 48h refluxáltatás után; 1b. minta: 48h refluxáltatás után után paralel minta; 2a. minta: vákuum bepárlás után; 2b. minta: vákuum bepárlás után paralel minta; 3. minta: további 24h kezelés 80 ºC-on. A reflux idı szerkezetre gyakorolt hatásának pontosabb megismeréséért különbözı idıvel refluxáltatott majd bepárolt, kiszárított és vízben (2- és 4-szeresen) duzzasztott mintákat vizsgáltunk kisszögő röntgenszórással (6, 7 ábrák). 2 óra refluxáltatással készített duzzasztott hidrogél minták alapvetıen strukturálatlan szerkezetőek, inkább az oldatokhoz állnak közelebb. Nagyon kis szórási intenzitású szupramolekuláris szerkezet a jellemzı. Négyszeres duzzasztásnál szeparált, nm-es részecskék jelenléte valószínősíthetı. 4 óra refluxáltatás mellett a szerkezet még mindig strukturálatlan a SAXS tartományában nagyobb hígításnál (4x), de kisebb hígításnál (2x) már némi rendezettséget, véletlenszerően összekapcsolódott nm-es aggregátumok jelenlétét lehet igazolni. 12 óra refluxáltatással elıállított mintákban már nagyobb hígításnál is 15
16 detektálható csekély rendezettség. 2-szeresen duzzasztott minták már erısen strukturáltak (24, 11-12, 1,3 nm-es méretek) (6. ábra). A nagyobb koncentrációjú mintákban ez a strukturáltság végig megmarad némi változással a 24 és 48 óra refluxáltatásnál is (7. ábra). A széles diffrakciós csúcsok helye nem változik, csak az intenzitásuk. A hosszabbodó refluxáltatás növeli a kondenzációs reakcióban kialakult kötések számát, mely jobban rendezi a szerkezetet. Nagyobb hígításnál a 12 órás és a 24 órás reflux nagyobb szerkezeti különbséget okoz. Bár az aggregátumos szerkezet a jellemzı itt is a lineáris illesztés log-log ábrázolásnál -3,75 -ös meredekséget mutat de a méretek változnak. 2,5 nm a domináns méret. Ezek a szerkezeti paraméterek nem változnak 48 óra refluxszal sem, de megjelenik kis intenzitással egy 22 nm távolsághoz rendelhetı csúcs is a 2,5 nm mellé. Összefoglalóan megállapítható, hogy a refluxáltatás idejével jól lehet szabályozni a szerkezetet; 2 óra alatt csak kevés számú kötés tud kialakulni, ezek a gélek jobban préselhetık, szinterelhetık. Ezeket a mintákat viszont nem lehetett duzzasztani. A hosszabb refluxáltatással végrehajtott gélesítés 3D-os szerkezet eredményez, mely jól duzzasztható. A nagy porozitású termékek elıállításához szükség van jól duzzasztható gélrendszerekre. A SAXS méréssorozatok bebizonyították, hogy a gélstruktúra 24 óra alatt alakul ki, addig folytonosan változik. További gélesítéssel ez a szerkezet már csak finomodik. Intenzitás (a.u.) 2-szeres duzzasztás reflux idı 48h 24h 12h 4h 2h q (Å -1 ) Különbözı reflux idıvel gélesített és 2-szeres mennyiségő vízzel duzzasztott minták SAXS-vizsgálata. 6. ábra 16
17 48h 24h 12h 4h 2h q (Å -1 ) Különbözı reflux idıvel gélesített és 4-szeres mennyiségő vízzel duzzasztott minták SAXS-vizsgálata. 7. ábra A különbözı széles, diffrakciós jellegő csúcsok által jelzett méretek fizikai jelentésének megértéséhez duzzasztási sorozatot készítettünk, vizsgálva, mely méret, hogy változik. Együtt változnak vagy egymástól függetlenül, változatlan marad vagy nı a karakterisztikus méret (8. ábra). 48 órás refluxáltatással, majd szárítással kapott makropórusos habot duzzasztottunk különbözı mennyiségő vízzel. Maximálisan 9-szeres duzzasztási fok érhetı el víz felhasználásával. Ez a legjobb duzzasztószer az alumínium-oxihidroxid rendszereknél. Különbözı mértékő duzzasztás hatására különösen 4-szeresnél nagyobb duzzasztásnál erıteljes változás következik be. Intenzív rendezıdés játszódik le. A nagyobb víztartalom nagyobb rendezettséget eredményezhet a szupramolekuláris tartományban egyrészt azáltal, hogy a mikroméretes (pár nanométeres) méretek duzzadnak, nınek, és ezáltal mérhetıvé válnak kisszögő szórással. Másrészt a víz hatására további reakciók hidrolízis és kondenzáció játszódhatnak le, ami növeli a gélszerkezetek rendezettségét. Ezt támasztja alá az a tény is, hogy a makroszkopikus tulajdonságokban is irreverzibilis változás következik be pusztán annak hatására, hogy a gélt megszárítjuk és az elpárolgott víztartalmat újra pótoljuk. Pl. megszőnik a szálasíthatóság, és 3D-os térháló jön létre. Az 1,3 nm-es távolság eltőnik a 4-szeres duzzasztásnál, és egy új méret a 2,5 nm-es jelenik meg. 6-szoros duzzasztásánál új karakterisztikus távolság tőnik fel, mely 10 nm körüli, ez az érték végig megmarad a maximális (9x) duzzasztási fokig. Kis duzzasztási foknál is meglévı 20 nm-es méret fokozatosan nı 24-re (6-szoros), majd 24,3-ra (9-szeresnél). Tehát minden változik, egymástól függetlenül. Figyelembe véve, hogy a szol-gél módszerrel általában mezopórusos rendszer jön létre, valamint azt a tényt, hogy a pórus méret nıni fog a duzzasztással, a nm a pórusmérethez köthetı. Mivel a 4-szeresnél nagyobb 17
18 duzzasztási fokú hidrogélek optikai tisztasága megszőnik, erısen opálosak lesznek a gélminták, így az aggregátumok mérete pár száz nanométer lehet, tehát nem a kisszögő szórások tartományában detektálható. Az 1,3 2,5 nm-es karakterisztikus távolság diffrakciós csúcsát az elemi részecskék mérete iniciálhatja. Intenzitás (a.u.) duzzasztási fok 9x 7x 6x 4x 3x 2x 1x q (Å -1 ) Különbözı duzzasztási fokú hidrogélek SAXS-vizsgálata 8. ábra IV.2 Az minták vizsgálata NMR spektroszkópiával Az 27 Al MAS NMR mérésekkel az Al-ion körül elrendezıdı atomok helyzetérıl kívántunk információt nyerni. A spektrumokat az Eötvös Loránd Tudományegyetem Kémia Intézetében vettük fel szobahımérsékleten Bruker AC 250 MHz NMR spektrométer segítségével. Az NMR görbék dekonvolúciója Lorentz- és Gauss-görbék illesztésévél történt. 27 Al MAS NMR mérések is igazolják a jelentıs változást a hidrogélek elıállítási folyamata során (9. ábra). 2 óra refluxáltatás után (10. ábra) az NMR-görbe (0 ppm-es szignál) az Al(III)-ionokat tartalmazó oldat NMR-felvételéhez hasonlít. A 0 ppm körül jelentkezı NMR csúcs csak hidratált, oktaéderes Al(III)-ionok, [Al(H 2 O) 6-x (OH) x ] jelenlétét igazolják. 48 óra reflux után már jelentıs számú asszociátum kialakulását jelzi a 4 ppm körüli Al NMR csúcs. A vákuum bepárlással kapott viszkózus keveréket egy széles NMR csúcs jellemzi negatív ppm tartományban. A negatív eltolódást a nitráttartalom okozza, melynek intenzív hatása a nagy koncentráció miatt jól tud érvényesülni (9. ábra). A széles jel változó kémiai környezetet jelez. A hidrogélben az asszociátumokban kötött Al(III)-ionok száma 18
19 jelentısen megnı, %-ról %-ra. Ez a komoly különbség alátámasztja az irreverzibilis szerkezeti változást. 4,2 0,09 48 óra reflux hidrogél viszkózus keverék reflux után ppm 27 Al MAS NMR mérések - porózus tömb minták elıállítási folyamatának (48 óra refluxáltatással) követése 9. ábra 2h reflux után ppm 27 Al MAS NMR mérés 2 h refluxáltatás után 10. ábra 19
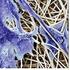
20 IV.3 Keménységvizsgálatok A mérés alapja, hogy meghatározott mérető négyzet alapú gyémántgúlát F terheléssel meghatározott ideig a vizsgálandó anyagba kell nyomni és a terhelés megszüntetése után a benyomódás átlóját (d) kell mérni. A Vickers-keménység számértéke (szabványos jelölése: HV) úgy nyerhetı, hogy a N-ban kifejezett F terhelı erıt el kell osztani a benyomódás mm 2 - ben számított felületével (A), így a Vickers-keménység: Minta HV átlag HV max 2 h reflux 88,5 94,0 4h reflux 104,0 110,5 6h reflux 114,5 128,3 8h reflux 98,5 114,5 1. Táblázat Vickers-keménységi adatok A mérések alapján (1. táblázat) a hat órás refluxidı alkalmazása vezet a legnagyobb keménységő kerámiákhoz. Addig, fokozatos emelkedés figyelhetı meg az átlag és maximumátlag értékekben is. Figyelemre méltó, hogy a 6 órás refluxidıvel készült minták keménységének átlaga megegyezik a 8 órás refluxal készült mintáknál mért maximummal. A SAXS mérések eredményeivel összhangban vannak a keménységvizsgálatokból levonható konzekvenciák. A mért értékek jól mutatják, hogy a refluxáltatás idejével jól lehet szabályozni a szerkezetet. A nagy porozitású termékek elıállításához szükség van jól duzzasztható gélrendszerekre. A kis porozitás, illetve a nagyobb keménység eléréséhez a rövidebb refluxidık alkalmazása bizonyul megfelelınek. Mivel csak néhány minta keménységvizsgálatát volt lehetıségünk elvégezni, a mérési eredményekbıl messzemenı következtetéseket nem vonhattunk le, ezért a közeljövıben célul tőztük ki további kerámia minták elıállítását és az elıállított minták szélesebb körő vizsgálatát, azokon porozitásméréseket is végezve. IV.4 Mikroszkópos felületi vizsgálatok A pásztázó elektronmikroszkóppal (SEM) az elıállított nagyszilárdságú tömb minták felületének topográfiáját, illetve egy vékony rétegét vizsgáltuk 3-50 nm-es mélységben. A mérést szekunder üzemmódban végeztük. A mért minták felszínét vákuum alatt, arannyal kezeltük. A SEM-et szokás az atomi erı mikroszkópiával (AFM-el) összehasonlítani, de nyugodtan kijelenthetı azonban, hogy mindezeknek az eszközöknek megvannak az egyedi és pótolhatatlan funkciójuk és nem konkurensei, hanem kiegészítıi egymásnak. Az atomi erı erımikroszkóppal készített felvételeket PSIA XE-100 készülékkel, kontakt módban készítettük el. 20
21 Mint azt a szerkezetvizsgálatok során is láthattuk, a refluxidı változtatása nagymértékben befolyásolja a elıállított kerámia szerkezetét. A Vickers-mérésekkel összhangban megállapítható, hogy a 6 órás refluxidıt (11/a. ábra, 12/a. ábra) követıen elıállított minták porozitása kisebb, felülete homogénebb. a. b. Kerámia minta SEM felvétele 11. ábra a. 6 órás refluxáltatási idıt alkalmazva b. 2 órás refluxáltatási idıt alkalmazva 21
22 a. b. Kerámia minta AFM felvétele 12. ábra a. 6 órás refluxáltatási idıt alkalmazva b. 2 órás refluxáltatási idıt alkalmazva 22
23 V. Összefoglalás Munkánk során AlOOH tömb mintákat készítettünk, széles tartományban változtatva az elıállított monolit szerkezetek porozitását. Kísérleteink alapjául a tanszéken már korábban kidolgozott szol-gél eljárás szolgált [12-14], melynek segítségével alumínium-nitrát és propanol reakciójából kis porozitású, tömör, kemény tömbkerámiákat és nagy porozitású rugalmas, tiszta hidrogéleket lehetett elıállítani. Vizsgálataink során arra a kérdésre szerettünk volna választ kapni, hogy az elıállítás pármétereinek változtatása, milyen hatással van a termék mechanikai tulajdonságaira és porozitására. Ennek érdekében két, egymástól az említett tulajdonságokban szignifikánsan eltérı alumínium-oxi-hidroxi rendszert készítettünk és vizsgáltunk, tömbgéleket és tömbkerámiákat. Hogy a kívánt tulajdonságú, meghatározott mérető és geometriájú részecskék és szerkezetek megvalósítását elérhessük, az elıállítás paramétereit minden esetében optimalizálni kellett a folyamat részlépésein keresztül. Vizsgálataink alapján megállapítható, hogy az alumínium-nitrát és propanol elegyének refluxáltatási idejével jól szabályozható az elıállítható gélszerkezet. Rövidebb refluxidık alkalmazásával csak kevesebb számú kötés alakítható ki, az így készített gélek, kevésbé porózusosak, jobban szinterelhetıek, nagy szilárdságú tömbkerámiák megfelelı alapanyagai. A hosszabb reakcióidık alkalmazásával végrehajtott gélesítés eredménye viszont háromdimenziós szerkezet lesz, mely vízben duzzasztható a legnagyobb mértékben és nagy porozitású, monolit tömbgélt eredményez. Továbbá a kiértékelt méréssorozatok mutatják, hogy a gélstruktúra kialakulása folyamatos, majd gyakorlatilag 24 óra után befejezıdik, ezt követıen már csak a kialakult szerkezet finomodik. A különbözı duzzasztási fokú minták vizsgálataiból levonható következtetés, hogy duzzasztás hatására intenzív, irreverzibilis rendezıdés játszódik le a szerkezetben, további hidrolízises és kondenzációs reakciók lejátszódásnak köszönhetıen. SAXS mérések alapján megállapítható, hogy a refluxáltatás idejének változtatásával a kialakuló szerkezetet nagymértékben befolyásolható; rövid idı alatt (2 óra) csak kevés számú kötés tud kialakulni, aminek köszönhetıen jobban préselhetı és szinterelhetı mintákat kapunk, viszont nem duzzaszthatók. A hosszabb refluxáltatással végrehajtott gélesítés 3D-os szerkezet eredményez, melyek jól duzzaszthatóak, és nagy porozitású termékek elıállításához vezetnek. A SAXS méréssorozatok bebizonyították, hogy a gélstruktúra 24 óra alatt alakul ki, addig folytonosan változik. További gélesítéssel ez a szerkezet már csak finomodik. 27 Al MAS NMR mérések, mint a SAXS méréseknél is láttuk, alátámasztják a hidrogélek elıállítása során lejátszódó jelentıs változásokat. 2 óra refluxáltatás utáni minta NMR-görbéje az Al(III)-ionokat tartalmazó oldat NMR-felvételéhez hasonlít. A 0 ppm körül jelentkezı NMR csúcs kizárólag a hidratált, oktaéderes Al(III)-ionok, [Al(H 2 O) 6-x (OH) x ] jelenlétét igazolja. Mintegy 48 óra reflux után már jelentıs számú asszociátum kialakulása detektálható (4 ppm-es csúcs). A vákuum bepárlással kapott viszkózus keverék esetében egy széles negatív ppm tartományban található NMR csúcs jelentkezik, amit a nitrát tartalom okoz. A széles jel, változó kémiai környezetet jelez. A hidrogélben az asszociátumokban kötött Al(III)-ionok száma jelentısen megnı (20 30 %-ról %-ra), ami alátámasztja az irreverzibilis szerkezeti változást. A Vickers-mérések alapján a hat órás refluxidı alkalmazása vezet a legnagyobb keménységő kerámiákhoz, addig, fokozatos emelkedés figyelhetı meg. A mikroszkópos vizsgálatok (SEM és AFM), a fent bemutatott mérésekkel összhangban, igazolták a refluxidı szerkezetre gyakorolt nagymértékő befolyásoló hatását. A 6 órás refluxáltatás követıen juthatunk a legnagyobb homogenitású és legkisebb porozitású végtermékekhez. 23
24 VI. Irodalomjegyzék [1] B. E. Yoldas, Journal of Materials Science (1975) [2] J. W. Akitt, Journal of Chemical Society DA 1233 (1981) [3] C.J. Brinker and G.W. Sherer, Sol-gel Science (Academic Press, Boston, 1990) [4] A. C. Pierre-D. R. Uhlmann, Journal of Non-Crystalline Solids (1986) [5] A. C. Pierre, D. R. Uhlmann, Aging of an alumina gel made from aluminium-nitrate Ultrastructure Processing of Advenced Ceramics (1988) [6] Ph. Colomban, Journal of Materials Science (1989) [7] Xin Zhang, Yiyong Wu, Gang Liu, Shiyu He, Thin Solid Films, Vol 516, Issue15, (2008) [8]. S. Kureti, W. Weisweiler, Applied Catalysis, General, Vol 225, Issues 1-2, (2002) [9] C.J.Brinker-G.W.Scherer, Sol-Gel Science (Academic Press, Boston, 1990) [10] K. Wefers-Ch. Misra, Oxides and Hydroxides of Aluminium, Alcoa Laboratories (1987) [11] J. T. Kloprogge, Journal of Non-Crystalline Solids (1993) [12] R. Mezei, K. Sinkó, Journal of Materials Chemistry, 8(9) (1998) [13] R. Mezei, K. Sinkó, Chemical Physics (1999) [14] R. Mezei, K. Sinkó, Colloid and Polymer Science 274 (1996) (1996) [15] J. W. Akitt, Journal of Chemical Society DA 1233 (1981) [16] D.M. Ibrahima, Y.M. Abu-Ayanab, Materialas Chemistry and Physics, online (2008) [17] Xin Zhang, Yiyong Wu, Gang Liu, Shiyu He, Thin Solid Films, Vol 516, Issue15, (2008) [18] W. M. Zeng, L. Gao, J. K. Guo, NanoStructured Materials, Vol.10, No (1980) [19] Sang Il Seok, Jae Houng Kim, Kyung Hun Choi, Young Young Hwang, Surface & Coatings Technology (2006) 24
25 VII. Rövidítések jegyzéke SAXS - Kisszögő-röntgenszórás NMR - Mágneses magrezonancia spektroszkópia MAS NMR - Mágneses magrezonancia spektroszkópia mágikus forgatási szöggel SEM - Scanning elektronmikroszkóp AFM - Atomi erı mikroszkópia 25
Mezopórusos hibrid anyagok új típusú elıállítása
 Kutatás célja Mezopórusos hibrid anyagok új típusú elıállítása # 43636 OTKA zárójelentés Az alumínium-szilikát gélrendszerekkel végzett kísérletek célja a szol-gél módszerrel elıállított gélminták törékenységének
Kutatás célja Mezopórusos hibrid anyagok új típusú elıállítása # 43636 OTKA zárójelentés Az alumínium-szilikát gélrendszerekkel végzett kísérletek célja a szol-gél módszerrel elıállított gélminták törékenységének
Meiszterics Anikó BIOAKTÍV KALCIUMTARTALMÚ GÉL- ÉS KERÁMIARENDSZEREK
 Meiszterics Anikó BIOAKTÍV KALCIUMTARTALMÚ GÉL- ÉS KERÁMIARENDSZEREK Témavezetők: Sinkó Katalin Rosta László Kutatás célkitűzései Célkitűzés: nagyszilárdságú kalcium-szilikát és kalcium-szilikátfoszfát
Meiszterics Anikó BIOAKTÍV KALCIUMTARTALMÚ GÉL- ÉS KERÁMIARENDSZEREK Témavezetők: Sinkó Katalin Rosta László Kutatás célkitűzései Célkitűzés: nagyszilárdságú kalcium-szilikát és kalcium-szilikátfoszfát
Adatgyőjtés, mérési alapok, a környezetgazdálkodás fontosabb mőszerei
 GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
Faanyagok modifikációja_06
 Faanyagok modifikációja_06 Faanyagok módosítása hıkezeléssel kémiai változások a faanyagban a hıkezelés hatására Dr. Németh Róbert, NymE Faipari Mérnöki Kar, Sopron, Faanyagtudományi Intézet, 2009. nemethr@fmk.nyme.hu
Faanyagok modifikációja_06 Faanyagok módosítása hıkezeléssel kémiai változások a faanyagban a hıkezelés hatására Dr. Németh Róbert, NymE Faipari Mérnöki Kar, Sopron, Faanyagtudományi Intézet, 2009. nemethr@fmk.nyme.hu
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1995 JAVÍTÁSI ÚTMUTATÓ
 1 oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1995 JAVÍTÁSI ÚTMUTATÓ I A VÍZ - A víz molekulája V-alakú, kötésszöge 109,5 fok, poláris kovalens kötések; - a jég molekularácsos, tetraéderes elrendeződés,
1 oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1995 JAVÍTÁSI ÚTMUTATÓ I A VÍZ - A víz molekulája V-alakú, kötésszöge 109,5 fok, poláris kovalens kötések; - a jég molekularácsos, tetraéderes elrendeződés,
Poliaddíció. Polimerek kémiai reakciói. Poliaddíciós folyamatok felosztása. Addíció: két molekula egyesülése egyetlen fıtermék keletkezése közben
 Polimerek kémiai reakciói 6. hét Addíció: két molekula egyesülése egyetlen fıtermék keletkezése közben Poliaddíció bi- vagy polifunkciós monomerek lépésenkénti összekapcsolódása: dimerek, trimerek oligomerek
Polimerek kémiai reakciói 6. hét Addíció: két molekula egyesülése egyetlen fıtermék keletkezése közben Poliaddíció bi- vagy polifunkciós monomerek lépésenkénti összekapcsolódása: dimerek, trimerek oligomerek
2. ábra. 1. ábra. Alumínium-oxid
 Alumínium-oxid Alumínium-oxid, más nevén alumina, a leghatékonyabb, széles körben használt és kiváló min ség anyag a m szaki kerámiák között. A természetben csak nagyon kötött formában létezik más anyagokkal,
Alumínium-oxid Alumínium-oxid, más nevén alumina, a leghatékonyabb, széles körben használt és kiváló min ség anyag a m szaki kerámiák között. A természetben csak nagyon kötött formában létezik más anyagokkal,
KÉMIA FELVÉTELI DOLGOZAT
 KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
Kémiai átalakulások. A kémiai reakciók körülményei. A rendszer energiaviszonyai
 Kémiai átalakulások 9. hét A kémiai reakció: kötések felbomlása, új kötések kialakulása - az atomok vegyértékelektronszerkezetében történik változás egyirányú (irreverzibilis) vagy megfordítható (reverzibilis)
Kémiai átalakulások 9. hét A kémiai reakció: kötések felbomlása, új kötések kialakulása - az atomok vegyértékelektronszerkezetében történik változás egyirányú (irreverzibilis) vagy megfordítható (reverzibilis)
T I T - M T T. Hevesy György Kémiaverseny. A megyei forduló feladatlapja. 8. osztály. A versenyző jeligéje:... Megye:...
 T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 8. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 8. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
Környezeti analitika laboratóriumi gyakorlat Számolási feladatok áttekintése
 örnyezeti analitika laboratóriumi gyakorlat Számolási feladatok áttekintése I. A számolási feladatok megoldása során az oldatok koncentrációjának számításához alapvetıen a következı ismeretekre van szükség:
örnyezeti analitika laboratóriumi gyakorlat Számolási feladatok áttekintése I. A számolási feladatok megoldása során az oldatok koncentrációjának számításához alapvetıen a következı ismeretekre van szükség:
Kémiai reakciók. Közös elektronpár létrehozása. Általános és szervetlen kémia 10. hét. Elızı héten elsajátítottuk, hogy.
 Általános és szervetlen kémia 10. hét Elızı héten elsajátítottuk, hogy a kémiai reakciókat hogyan lehet csoportosítani milyen kinetikai összefüggések érvényesek Mai témakörök a közös elektronpár létrehozásával
Általános és szervetlen kémia 10. hét Elızı héten elsajátítottuk, hogy a kémiai reakciókat hogyan lehet csoportosítani milyen kinetikai összefüggések érvényesek Mai témakörök a közös elektronpár létrehozásával
A biomassza, mint energiaforrás. Mit remélhetünk, és mit nem?
 MTA Kémiai Kutatóközpont Anyag- és Környezetkémiai Intézet Budapest II. Pusztaszeri út 59-67 A biomassza, mint energiaforrás. Mit remélhetünk, és mit nem? Várhegyi Gábor Biomassza: Biológiai definíció:
MTA Kémiai Kutatóközpont Anyag- és Környezetkémiai Intézet Budapest II. Pusztaszeri út 59-67 A biomassza, mint energiaforrás. Mit remélhetünk, és mit nem? Várhegyi Gábor Biomassza: Biológiai definíció:
Természetes vizek, keverékek mindig tartalmaznak oldott anyagokat! Írd le milyen természetes vizeket ismersz!
 Összefoglalás Víz Természetes víz. Melyik anyagcsoportba tartozik? Sorolj fel természetes vizeket. Mitől kemény, mitől lágy a víz? Milyen okokból kell a vizet tisztítani? Kémiailag tiszta víz a... Sorold
Összefoglalás Víz Természetes víz. Melyik anyagcsoportba tartozik? Sorolj fel természetes vizeket. Mitől kemény, mitől lágy a víz? Milyen okokból kell a vizet tisztítani? Kémiailag tiszta víz a... Sorold
Kémiai reakciók. Kémiai reakció feltételei: Aktivált komplexum:
 Kémiai reakció feltételei: részecskék ütközése nagyobb koncentrációban gyakoribb: a részecskék megfelelı térhelyzetben legyenek Aktivált komplexum: részecskék ütközés utáni nagyon rövid ideig tartó összekapcsolódása
Kémiai reakció feltételei: részecskék ütközése nagyobb koncentrációban gyakoribb: a részecskék megfelelı térhelyzetben legyenek Aktivált komplexum: részecskék ütközés utáni nagyon rövid ideig tartó összekapcsolódása
Ragasztás, ragasztóanyagok. Kötés kialakulása kémiai úton. Kötés kialakulása kémiai úton. Kötés kialakulása kémiai úton
 Ragasztás, ragasztóanyagok 10. hét kötıanyag: oligomer, monomer kis moláris tömeg felvitel: folyadékállapot és viszkozitás biztosítása a kötés tisztán kémiai reakció poliaddíciós vagy polimerizációs folyamat
Ragasztás, ragasztóanyagok 10. hét kötıanyag: oligomer, monomer kis moláris tömeg felvitel: folyadékállapot és viszkozitás biztosítása a kötés tisztán kémiai reakció poliaddíciós vagy polimerizációs folyamat
ESR-spektrumok különbözı kísérleti körülmények között A számítógépes értékelés alapjai anizotróp kölcsönhatási tenzorok esetén
 ESR-spektrumok különbözı kísérleti körülmények között A számítógépes értékelés alapjai anizotróp kölcsönhatási tenzorok esetén A paraméterek anizotrópiája egykristályok rögzített tengely körüli forgatásakor
ESR-spektrumok különbözı kísérleti körülmények között A számítógépes értékelés alapjai anizotróp kölcsönhatási tenzorok esetén A paraméterek anizotrópiája egykristályok rögzített tengely körüli forgatásakor
Mikrohullámú abszorbensek vizsgálata
 Óbudai Egyetem Anyagtudományok és Technológiák Doktori Iskola Mikrohullámú abszorbensek vizsgálata Balla Andrea Témavezetők: Dr. Klébert Szilvia, Dr. Károly Zoltán MTA Természettudományi Kutatóközpont
Óbudai Egyetem Anyagtudományok és Technológiák Doktori Iskola Mikrohullámú abszorbensek vizsgálata Balla Andrea Témavezetők: Dr. Klébert Szilvia, Dr. Károly Zoltán MTA Természettudományi Kutatóközpont
Dr. JUVANCZ ZOLTÁN Óbudai Egyetem Dr. FENYVESI ÉVA CycloLab Kft
 Dr. JUVANCZ ZOLTÁN Óbudai Egyetem Dr. FENYVESI ÉVA CycloLab Kft Klasszikus analitikai módszerek Csapadékképzéses reakciók: Gravimetria (SZOE, víztartalom), csapadékos titrálások (szulfát, klorid) Sav-bázis
Dr. JUVANCZ ZOLTÁN Óbudai Egyetem Dr. FENYVESI ÉVA CycloLab Kft Klasszikus analitikai módszerek Csapadékképzéses reakciók: Gravimetria (SZOE, víztartalom), csapadékos titrálások (szulfát, klorid) Sav-bázis
XXXVII. KÉMIAI ELŐADÓI NAPOK
 Magyar Kémikusok Egyesülete Csongrád Megyei Csoportja és a Magyar Kémikusok Egyesülete rendezvénye XXXVII. KÉMIAI ELŐADÓI NAPOK Program és előadás-összefoglalók Szegedi Akadémiai Bizottság Székháza Szeged,
Magyar Kémikusok Egyesülete Csongrád Megyei Csoportja és a Magyar Kémikusok Egyesülete rendezvénye XXXVII. KÉMIAI ELŐADÓI NAPOK Program és előadás-összefoglalók Szegedi Akadémiai Bizottság Székháza Szeged,
Adatgyőjtés, mérési alapok, a környezetgazdálkodás fontosabb mőszerei
 GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
HIDROFIL HÉJ KIALAKÍTÁSA
 HIDROFIL HÉJ KIALAKÍTÁSA POLI(N-IZOPROPIL-AKRILAMID) MIKROGÉL RÉSZECSKÉKEN Róth Csaba Témavezető: Dr. Varga Imre Eötvös Loránd Tudományegyetem, Budapest Természettudományi Kar Kémiai Intézet 2015. december
HIDROFIL HÉJ KIALAKÍTÁSA POLI(N-IZOPROPIL-AKRILAMID) MIKROGÉL RÉSZECSKÉKEN Róth Csaba Témavezető: Dr. Varga Imre Eötvös Loránd Tudományegyetem, Budapest Természettudományi Kar Kémiai Intézet 2015. december
1. Gázok oldhatósága vízben: 101 325 Pa nyomáson g/100 g vízben
 1. Gázok oldhatósága vízben: 101 325 Pa nyomáson g/100 g vízben t/ 0 C 0 20 30 60 O 2 0,006945 0,004339 0,003588 0,002274 H 2S 0,7066 0,3846 0,2983 0,148 HCl 82,3 72 67,3 56,1 CO 2 0,3346 0,1688 0,1257
1. Gázok oldhatósága vízben: 101 325 Pa nyomáson g/100 g vízben t/ 0 C 0 20 30 60 O 2 0,006945 0,004339 0,003588 0,002274 H 2S 0,7066 0,3846 0,2983 0,148 HCl 82,3 72 67,3 56,1 CO 2 0,3346 0,1688 0,1257
4. táblázat. 1. osztály 2. osztály 3. osztály 4. osztály SO 4 Cl NO 3 HCO 3
 59 2.1.2. Anionok kimutatása Az anionokat közös reagensekkel történı vizsgálatok megfigyelései alapján, a kationokhoz hasonlóan, analitikai osztályokba sorolhatjuk. A fontosabb anionok négy osztályba kerültek.
59 2.1.2. Anionok kimutatása Az anionokat közös reagensekkel történı vizsgálatok megfigyelései alapján, a kationokhoz hasonlóan, analitikai osztályokba sorolhatjuk. A fontosabb anionok négy osztályba kerültek.
Bevezetés a talajtanba VIII. Talajkolloidok
 Bevezetés a talajtanba VIII. Talajkolloidok Kolloid rendszerek (kolloid mérető részecskékbıl felépült anyagok): Olyan két- vagy többfázisú rendszer, amelyben valamely anyag mérete a tér valamely irányában
Bevezetés a talajtanba VIII. Talajkolloidok Kolloid rendszerek (kolloid mérető részecskékbıl felépült anyagok): Olyan két- vagy többfázisú rendszer, amelyben valamely anyag mérete a tér valamely irányában
Az anyagi rendszerek csoportosítása
 Általános és szervetlen kémia 1. hét A kémia az anyagok tulajdonságainak leírásával, átalakulásaival, elıállításának lehetıségeivel és felhasználásával foglalkozik. Az általános kémia vizsgálja az anyagi
Általános és szervetlen kémia 1. hét A kémia az anyagok tulajdonságainak leírásával, átalakulásaival, elıállításának lehetıségeivel és felhasználásával foglalkozik. Az általános kémia vizsgálja az anyagi
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Javítókulcs (Kémia emelt szintű feladatsor)
 Javítókulcs (Kémia emelt szintű feladatsor) I. feladat 1. C 2. B. fenolos hidroxilcsoport, éter, tercier amin db. ; 2 db. 4. észter 5. E 6. A tercier amino-nitrogén. 7. Pl. a trimetil-amin reakciója HCl-dal.
Javítókulcs (Kémia emelt szintű feladatsor) I. feladat 1. C 2. B. fenolos hidroxilcsoport, éter, tercier amin db. ; 2 db. 4. észter 5. E 6. A tercier amino-nitrogén. 7. Pl. a trimetil-amin reakciója HCl-dal.
Adatgyőjtés, mérési alapok, a környezetgazdálkodás fontosabb mőszerei
 GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
1. feladat. Versenyző rajtszáma:
 1. feladat / 4 pont Válassza ki, hogy az 1 és 2 anyagok közül melyik az 1,3,4,6-tetra-O-acetil-α-D-glükózamin hidroklorid! Rajzolja fel a kérdésben szereplő molekula szerkezetét, és értelmezze részletesen
1. feladat / 4 pont Válassza ki, hogy az 1 és 2 anyagok közül melyik az 1,3,4,6-tetra-O-acetil-α-D-glükózamin hidroklorid! Rajzolja fel a kérdésben szereplő molekula szerkezetét, és értelmezze részletesen
Ecetsav koncentrációjának meghatározása titrálással
 Ecetsav koncentrációjának meghatározása titrálással A titrálás lényege, hogy a meghatározandó komponenst tartalmazó oldathoz olyan ismert koncentrációjú oldatot adagolunk, amely a reakcióegyenlet szerint
Ecetsav koncentrációjának meghatározása titrálással A titrálás lényege, hogy a meghatározandó komponenst tartalmazó oldathoz olyan ismert koncentrációjú oldatot adagolunk, amely a reakcióegyenlet szerint
m n 3. Elem, vegyület, keverék, koncentráció, hígítás m M = n Mértékegysége: g / mol elem: azonos rendszámú atomokból épül fel
 3. Elem, vegyület, keverék, koncentráció, hígítás elem: azonos rendszámú atomokból épül fel vegyület: olyan anyag, amelyet két vagy több különbözı kémiai elem meghatározott arányban alkot, az alkotóelemek
3. Elem, vegyület, keverék, koncentráció, hígítás elem: azonos rendszámú atomokból épül fel vegyület: olyan anyag, amelyet két vagy több különbözı kémiai elem meghatározott arányban alkot, az alkotóelemek
Allotróp módosulatok
 Allotróp módosulatok Egy elem azonos halmazállapotú, de eltérő molekula- vagy kristályszerkezetű változatai. Created by Michael Ströck (mstroeck) CC BY-SA 3.0 A szén allotróp módosulatai: a) Gyémánt b)
Allotróp módosulatok Egy elem azonos halmazállapotú, de eltérő molekula- vagy kristályszerkezetű változatai. Created by Michael Ströck (mstroeck) CC BY-SA 3.0 A szén allotróp módosulatai: a) Gyémánt b)
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 2000
 Megoldás 000. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 000 JAVÍTÁSI ÚTMUTATÓ I. A NITROGÉN ÉS SZERVES VEGYÜLETEI s s p 3 molekulák között gyenge kölcsönhatás van, ezért alacsony olvadás- és
Megoldás 000. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 000 JAVÍTÁSI ÚTMUTATÓ I. A NITROGÉN ÉS SZERVES VEGYÜLETEI s s p 3 molekulák között gyenge kölcsönhatás van, ezért alacsony olvadás- és
Oldatok - elegyek. Elegyek: komponensek mennyisége azonos nagyságrendű
 Oldatok - elegyek Többkomponensű homogén (egyfázisú) rendszerek Elegyek: komponensek mennyisége azonos nagyságrendű Oldatok: egyik komponens mennyisége nagy (oldószer) a másik, vagy a többihez (oldott
Oldatok - elegyek Többkomponensű homogén (egyfázisú) rendszerek Elegyek: komponensek mennyisége azonos nagyságrendű Oldatok: egyik komponens mennyisége nagy (oldószer) a másik, vagy a többihez (oldott
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szolok (szilárd lioszolok S/L), xeroszolok (*/S szilárd közegőek), gélek II. Bányai István. http://dragon.unideb.hu/~kolloid/
 Szolok (szilárd lioszolok S/L), xeroszolok (*/S szilárd közegőek), gélek II. Bányai István http://dragon.unideb.hu/~kolloid/ 1 Kolloid rendszerek (szerkezet alapján) Kolloid rendszerek inkoherens rendszerek
Szolok (szilárd lioszolok S/L), xeroszolok (*/S szilárd közegőek), gélek II. Bányai István http://dragon.unideb.hu/~kolloid/ 1 Kolloid rendszerek (szerkezet alapján) Kolloid rendszerek inkoherens rendszerek
RIEŠENIE A HODNOTENIE TEORETICKÝCH ÚLOH Chemická olympiáda kategória Dz 49. ročník šk. rok 2012/13 Obvodné kolo
 RIEŠENIE A HODNOTENIE TEORETICKÝCH ÚLOH Chemická olympiáda kategória Dz 49. ročník šk. rok 2012/13 Obvodné kolo Helena Vicenová Maximális pontszám 60 pont A megoldás ideje: 60 perc 1. feladat megoldása
RIEŠENIE A HODNOTENIE TEORETICKÝCH ÚLOH Chemická olympiáda kategória Dz 49. ročník šk. rok 2012/13 Obvodné kolo Helena Vicenová Maximális pontszám 60 pont A megoldás ideje: 60 perc 1. feladat megoldása
Nano-kerámia bevonatok konyhai edényeken. Barta Emil, Lampart Zrt, MZE
 Nano-kerámia bevonatok konyhai edényeken. Barta Emil, Lampart Zrt, MZE Elızmények Ismertetım megtartására az ösztönzött, hogy az elmúlt idıben serpenyıt és palacsintasütıt szándékoztam vásárolni. Volt
Nano-kerámia bevonatok konyhai edényeken. Barta Emil, Lampart Zrt, MZE Elızmények Ismertetım megtartására az ösztönzött, hogy az elmúlt idıben serpenyıt és palacsintasütıt szándékoztam vásárolni. Volt
NANOTECHNOLÓGIA - KÖZÉPISKOLÁSOKNAK NAOTECHNOLOGY FOR STUDENTS
 NANOTECNOLÓGIA - KÖZÉPISKOLÁSOKNAK NAOTECNOLOGY FOR STUDENTS Sinkó Katalin 1 1 Eötvös Loránd Tudományegyetem, TTK, Kémiai Intézet ÖSSZEFOGLALÁS Jelen ismertetı a nanoszerkezetek (nanaoszemcsék, nanoszálak,
NANOTECNOLÓGIA - KÖZÉPISKOLÁSOKNAK NAOTECNOLOGY FOR STUDENTS Sinkó Katalin 1 1 Eötvös Loránd Tudományegyetem, TTK, Kémiai Intézet ÖSSZEFOGLALÁS Jelen ismertetı a nanoszerkezetek (nanaoszemcsék, nanoszálak,
A projekt rövidítve: NANOSTER A projekt idıtartama: 2009. október 2012. december
 A projekt címe: Egészségre ártalmatlan sterilizáló rendszer kifejlesztése A projekt rövidítve: NANOSTER A projekt idıtartama: 2009. október 2012. december A konzorcium vezetıje: A konzorcium tagjai: A
A projekt címe: Egészségre ártalmatlan sterilizáló rendszer kifejlesztése A projekt rövidítve: NANOSTER A projekt idıtartama: 2009. október 2012. december A konzorcium vezetıje: A konzorcium tagjai: A
Öntött Poliamid 6 nanokompozit mechanikai és tribológiai tulajdonságainak kutatása. Andó Mátyás IV. évfolyam
 Öntött Poliamid 6 nanokompozit mechanikai és tribológiai tulajdonságainak kutatása Andó Mátyás IV. évfolyam 2005 Kutatás célkitőzése: - a nanokompozitok tulajdonságainak feltérképezése - a jó öntéstechnológia
Öntött Poliamid 6 nanokompozit mechanikai és tribológiai tulajdonságainak kutatása Andó Mátyás IV. évfolyam 2005 Kutatás célkitőzése: - a nanokompozitok tulajdonságainak feltérképezése - a jó öntéstechnológia
Számítástudományi Tanszék Eszterházy Károly Főiskola.
 Networkshop 2005 k Geda,, GáborG Számítástudományi Tanszék Eszterházy Károly Főiskola gedag@aries.ektf.hu 1 k A mérés szempontjából a számítógép aktív: mintavételezés, kiértékelés passzív: szerepe megjelenítés
Networkshop 2005 k Geda,, GáborG Számítástudományi Tanszék Eszterházy Károly Főiskola gedag@aries.ektf.hu 1 k A mérés szempontjából a számítógép aktív: mintavételezés, kiértékelés passzív: szerepe megjelenítés
6. változat. 3. Jelöld meg a nem molekuláris szerkezetű anyagot! A SO 2 ; Б C 6 H 12 O 6 ; В NaBr; Г CO 2.
 6. változat Az 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg azt a sort, amely helyesen
6. változat Az 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg azt a sort, amely helyesen
Minta feladatsor. Az ion neve. Az ion képlete O 4. Szulfátion O 3. Alumíniumion S 2 CHH 3 COO. Króm(III)ion
 Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve.. Szulfátion
Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve.. Szulfátion
Nagynyomású csavarással tömörített réz - szén nanocső kompozit mikroszerkezete és termikus stabilitása
 Nagynyomású csavarással tömörített réz - szén nanocső kompozit mikroszerkezete és termikus stabilitása P. Jenei a, E.Y. Yoon b, J. Gubicza a, H.S. Kim b, J.L. Lábár a,c, T. Ungár a a Anyagfizikai Tanszék,
Nagynyomású csavarással tömörített réz - szén nanocső kompozit mikroszerkezete és termikus stabilitása P. Jenei a, E.Y. Yoon b, J. Gubicza a, H.S. Kim b, J.L. Lábár a,c, T. Ungár a a Anyagfizikai Tanszék,
 Anyagos rész: Lásd: állapotábrás pdf. Ha többet akarsz tudni a metallográfiai vizsgálatok csodáiról, akkor: http://testorg.eu/editor_up/up/egyeb/2012_01/16/132671554730168934/metallografia.pdf
Anyagos rész: Lásd: állapotábrás pdf. Ha többet akarsz tudni a metallográfiai vizsgálatok csodáiról, akkor: http://testorg.eu/editor_up/up/egyeb/2012_01/16/132671554730168934/metallografia.pdf
a. 35-ös tömegszámú izotópjában 18 neutron található. b. A 3. elektronhéján két vegyértékelektront tartalmaz. c. 2 mól atomjának tömege 32 g.
 MAGYAR TANNYELVŰ KÖZÉPISKOLÁK IX. ORSZÁGOS VETÉLKEDŐJE AL IX.-LEA CONCURS PE ŢARĂ AL LICEELOR CU LIMBĂ DE PREDARE MAGHIARĂ FABINYI RUDOLF KÉMIA VERSENY - SZERVETLEN KÉMIA Marosvásárhely, Bolyai Farkas
MAGYAR TANNYELVŰ KÖZÉPISKOLÁK IX. ORSZÁGOS VETÉLKEDŐJE AL IX.-LEA CONCURS PE ŢARĂ AL LICEELOR CU LIMBĂ DE PREDARE MAGHIARĂ FABINYI RUDOLF KÉMIA VERSENY - SZERVETLEN KÉMIA Marosvásárhely, Bolyai Farkas
& A gyártásközi ellenrzés szerepe a szigorodó minségi követelményekben
 & A gyártásközi ellenrzés szerepe a szigorodó minségi követelményekben Rosta Béláné Richter Gedeon Nyrt., Szintetikus I. Üzem Analitikai Laboratóriuma, Dorog Összefoglalás A dolgozatban egy évtizedek óta
& A gyártásközi ellenrzés szerepe a szigorodó minségi követelményekben Rosta Béláné Richter Gedeon Nyrt., Szintetikus I. Üzem Analitikai Laboratóriuma, Dorog Összefoglalás A dolgozatban egy évtizedek óta
Kalcium-szilikát biokerámia előállítása szol-gél módszerrel
 1 Tudományos Diákköri Dolgozat Meiszterics Anikó ELTE TTK Vegyész, IV. évfolyam Kalcium-szilikát biokerámia előállítása szol-gél módszerrel Témavezető: Dr. Sinkó Katalin ELTE TTK Szervetlen és Analitikai
1 Tudományos Diákköri Dolgozat Meiszterics Anikó ELTE TTK Vegyész, IV. évfolyam Kalcium-szilikát biokerámia előállítása szol-gél módszerrel Témavezető: Dr. Sinkó Katalin ELTE TTK Szervetlen és Analitikai
XXXVI. KÉMIAI ELŐADÓI NAPOK
 Magyar Kémikusok Egyesülete Csongrád Megyei Csoportja és a Magyar Kémikusok Egyesülete rendezvénye XXXVI. KÉMIAI ELŐADÓI NAPOK Program és előadás-összefoglalók Szegedi Akadémiai Bizottság Székháza Szeged,
Magyar Kémikusok Egyesülete Csongrád Megyei Csoportja és a Magyar Kémikusok Egyesülete rendezvénye XXXVI. KÉMIAI ELŐADÓI NAPOK Program és előadás-összefoglalók Szegedi Akadémiai Bizottság Székháza Szeged,
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
A II. kategória Fizika OKTV mérési feladatainak megoldása
 Nyomaték (x 0 Nm) O k t a t á si Hivatal A II. kategória Fizika OKTV mérési feladatainak megoldása./ A mágnes-gyűrűket a feladatban meghatározott sorrendbe és helyre rögzítve az alábbi táblázatban feltüntetett
Nyomaték (x 0 Nm) O k t a t á si Hivatal A II. kategória Fizika OKTV mérési feladatainak megoldása./ A mágnes-gyűrűket a feladatban meghatározott sorrendbe és helyre rögzítve az alábbi táblázatban feltüntetett
Adatgyőjtés, mérési alapok, a környezetgazdálkodás fontosabb mőszerei
 GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
CFD alkalmazási lehetıségei a Mátrai Erımőnél Elıadás. Budapest, BME CFD workshop május 11. Egyed Antal
 CFD alkalmazási lehetıségei a Mátrai Erımőnél Elıadás Budapest, BME CFD workshop 2006. május 11 Készítették: Leviczky Géza Egyed Antal 1 Saját vizsgálatok bemutatása Geometriai modellek: Az ábra mutatja
CFD alkalmazási lehetıségei a Mátrai Erımőnél Elıadás Budapest, BME CFD workshop 2006. május 11 Készítették: Leviczky Géza Egyed Antal 1 Saját vizsgálatok bemutatása Geometriai modellek: Az ábra mutatja
B TÉTEL A cukor, ammónium-klorid, nátrium-karbonát kémhatásának vizsgálata A túró nitrogéntartalmának kimutatása A hamisított tejföl kimutatása
 2014/2015. B TÉTEL A cukor, ammónium-klorid, nátrium-karbonát kémhatásának vizsgálata A kísérleti tálcán lévő sorszámozott eken három fehér port talál. Ezek: cukor, ammónium-klorid, ill. nátrium-karbonát
2014/2015. B TÉTEL A cukor, ammónium-klorid, nátrium-karbonát kémhatásának vizsgálata A kísérleti tálcán lévő sorszámozott eken három fehér port talál. Ezek: cukor, ammónium-klorid, ill. nátrium-karbonát
MTA DOKTORI ÉRTEKEZÉS
 MTA DOKTORI ÉRTEKEZÉS ELLENTÉTES TÖLTÉSŐ POLIELEKTROLITOK ÉS TENZIDEK ASSZOCIÁCIÓJA Mészáros Róbert Eötvös Loránd Tudományegyetem Kémiai Intézet Budapest, 2009. december Köszönetnyilvánítás Ezúton szeretném
MTA DOKTORI ÉRTEKEZÉS ELLENTÉTES TÖLTÉSŐ POLIELEKTROLITOK ÉS TENZIDEK ASSZOCIÁCIÓJA Mészáros Róbert Eötvös Loránd Tudományegyetem Kémiai Intézet Budapest, 2009. december Köszönetnyilvánítás Ezúton szeretném
Országos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia II. kategória 2. forduló Megoldások
 ktatási Hivatal rszágos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia II. kategória 2. forduló Megoldások I. FELADATSR 1. C 6. C 11. E 16. C 2. D 7. B 12. E 17. C 3. B 8. C 13. D 18. C 4. D 9.
ktatási Hivatal rszágos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia II. kategória 2. forduló Megoldások I. FELADATSR 1. C 6. C 11. E 16. C 2. D 7. B 12. E 17. C 3. B 8. C 13. D 18. C 4. D 9.
MŐSZAKI KÉMIA. Anyagmérnök MSc képzés. Tantárgyi Kommunikációs Dosszié MISKOLCI EGYETEM MŐSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI INTÉZET
 MŐSZAKI KÉMIA Anyagmérnök MSc képzés Tantárgyi Kommunikációs Dosszié MISKOLCI EGYETEM MŐSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI INTÉZET Miskolc, 2009 Tartalomjegyzék 1. Tantárgyleírás, tantárgyjegyzı, óraszám,
MŐSZAKI KÉMIA Anyagmérnök MSc képzés Tantárgyi Kommunikációs Dosszié MISKOLCI EGYETEM MŐSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI INTÉZET Miskolc, 2009 Tartalomjegyzék 1. Tantárgyleírás, tantárgyjegyzı, óraszám,
A technológiai paraméterek hatása az Al 2 O 3 kerámiák mikrostruktúrájára és hajlítószilárdságára
 Bevezetés A technológiai paraméterek hatása az Al 2 O 3 kerámiák mikrostruktúrájára és hajlítószilárdságára Csányi Judit 1, Dr. Gömze A. László 2 1 doktorandusz, 2 tanszékvezető egyetemi docens Miskolci
Bevezetés A technológiai paraméterek hatása az Al 2 O 3 kerámiák mikrostruktúrájára és hajlítószilárdságára Csányi Judit 1, Dr. Gömze A. László 2 1 doktorandusz, 2 tanszékvezető egyetemi docens Miskolci
Ragasztás, ragasztóanyagok
 9. hét Kötés kialakulása fizikai úton kötı oldószeres diszperziós olvadék-ragasztók kémiai úton kötı oldószeres természetes polimer alapú ragasztók fehérje, szénhidrát, szénhidrogén alapú oldószeres ragasztó
9. hét Kötés kialakulása fizikai úton kötı oldószeres diszperziós olvadék-ragasztók kémiai úton kötı oldószeres természetes polimer alapú ragasztók fehérje, szénhidrát, szénhidrogén alapú oldószeres ragasztó
VÁLASZ. Dr. BÓTA ATTILA, MTA doktora BÍRÁLATÁRA
 VÁLASZ r. BÓTA ATTILA, MTA doktora BÍRÁLATÁRA Elsősorban őszintén köszönöm a Bóta Attila bíráló átfogó munkáját és idejét, melyet a disszertációm értékelésére fordított. Külön köszönöm értékes kiegészítéseit
VÁLASZ r. BÓTA ATTILA, MTA doktora BÍRÁLATÁRA Elsősorban őszintén köszönöm a Bóta Attila bíráló átfogó munkáját és idejét, melyet a disszertációm értékelésére fordított. Külön köszönöm értékes kiegészítéseit
Az elállítási körülmények hatása nanoporokból szinterelt fémek mikroszerkezetére és mechanikai tulajdonságaira
 Az elállítási körülmények hatása nanoporokból szinterelt fémek mikroszerkezetére és mechanikai tulajdonságaira Gubicza Jen 1, Guy Dirras 2, Salah Ramtani 2 1 Eötvös Loránd Tudományegyetem, Anyagfizikai
Az elállítási körülmények hatása nanoporokból szinterelt fémek mikroszerkezetére és mechanikai tulajdonságaira Gubicza Jen 1, Guy Dirras 2, Salah Ramtani 2 1 Eötvös Loránd Tudományegyetem, Anyagfizikai
A feladatok megoldásához csak a kiadott periódusos rendszer és számológép használható!
 1 MŰVELTSÉGI VERSENY KÉMIA TERMÉSZETTUDOMÁNYI KATEGÓRIA Kedves Versenyző! A versenyen szereplő kérdések egy része általad már tanult tananyaghoz kapcsolódik, ugyanakkor a kérdések másik része olyan ismereteket
1 MŰVELTSÉGI VERSENY KÉMIA TERMÉSZETTUDOMÁNYI KATEGÓRIA Kedves Versenyző! A versenyen szereplő kérdések egy része általad már tanult tananyaghoz kapcsolódik, ugyanakkor a kérdések másik része olyan ismereteket
XXXVIII. KÉMIAI ELŐADÓI NAPOK
 Magyar Kémikusok Egyesülete Csongrád Megyei Csoportja és a Magyar Kémikusok Egyesülete rendezvénye XXXVIII. KÉMIAI ELŐADÓI NAPOK Program és előadás-összefoglalók Szegedi Akadémiai Bizottság Székháza Szeged,
Magyar Kémikusok Egyesülete Csongrád Megyei Csoportja és a Magyar Kémikusok Egyesülete rendezvénye XXXVIII. KÉMIAI ELŐADÓI NAPOK Program és előadás-összefoglalók Szegedi Akadémiai Bizottság Székháza Szeged,
Nanokeménység mérések
 Cirkónium Anyagtudományi Kutatások ek Nguyen Quang Chinh, Ugi Dávid ELTE Anyagfizikai Tanszék Kutatási jelentés a Nemzeti Kutatási, Fejlesztési és Innovációs Hivatal támogatásával az NKFI Alapból létrejött
Cirkónium Anyagtudományi Kutatások ek Nguyen Quang Chinh, Ugi Dávid ELTE Anyagfizikai Tanszék Kutatási jelentés a Nemzeti Kutatási, Fejlesztési és Innovációs Hivatal támogatásával az NKFI Alapból létrejött
Általános és szervetlen kémia Laborelıkészítı elıadás I.
 Általános és szervetlen kémia Laborelıkészítı elıadás I. Halmazállapotok, fázisok Fizikai állapotváltozások (fázisátmenetek), a Gibbs-féle fázisszabály Fizikai módszerek anyagok tisztítására - Szublimáció
Általános és szervetlen kémia Laborelıkészítı elıadás I. Halmazállapotok, fázisok Fizikai állapotváltozások (fázisátmenetek), a Gibbs-féle fázisszabály Fizikai módszerek anyagok tisztítására - Szublimáció
Sav bázis egyensúlyok vizes oldatban
 Sav bázis egyensúlyok vizes oldatban Disszociációs egyensúlyi állandó HAc H + + Ac - ecetsav disszociációja [H + ] [Ac - ] K sav = [HAc] NH 4 OH NH 4 + + OH - [NH + 4 ] [OH - ] K bázis = [ NH 4 OH] Ammóniumhidroxid
Sav bázis egyensúlyok vizes oldatban Disszociációs egyensúlyi állandó HAc H + + Ac - ecetsav disszociációja [H + ] [Ac - ] K sav = [HAc] NH 4 OH NH 4 + + OH - [NH + 4 ] [OH - ] K bázis = [ NH 4 OH] Ammóniumhidroxid
TALAJVÉDELEM XI. A szennyezőanyagok terjedését, talaj/talajvízbeli viselkedését befolyásoló paraméterek
 TALAJVÉDELEM XI. A szennyezőanyagok terjedését, talaj/talajvízbeli viselkedését befolyásoló paraméterek A talajszennyezés csökkenése/csökkentése bekövetkezhet Természetes úton Mesterséges úton (kármentesítés,
TALAJVÉDELEM XI. A szennyezőanyagok terjedését, talaj/talajvízbeli viselkedését befolyásoló paraméterek A talajszennyezés csökkenése/csökkentése bekövetkezhet Természetes úton Mesterséges úton (kármentesítés,
A 27/2012. (VIII. 27.) NGM rendelet (29/2016. (VIII. 26.) NGM rendelet által módosított) szakmai és vizsgakövetelménye alapján.
 A 27/2012. (VIII. 27.) NGM rendelet (29/2016. (VIII. 26.) NGM rendelet által módosított) szakmai és vizsgakövetelménye alapján. Szakképesítés azonosítószáma és megnevezése 54 524 03 Vegyész technikus Tájékoztató
A 27/2012. (VIII. 27.) NGM rendelet (29/2016. (VIII. 26.) NGM rendelet által módosított) szakmai és vizsgakövetelménye alapján. Szakképesítés azonosítószáma és megnevezése 54 524 03 Vegyész technikus Tájékoztató
Szakértesítő 1 Interkerám szakmai füzetek A folyósító szerek viselkedése a kerámia anyagokban
 Szakértesítő 1 Interkerám szakmai füzetek A folyósító szerek viselkedése a kerámia anyagokban A folyósító szerek viselkedése a kerámia anyagokban Bevezetés A kerámia masszák folyósításkor fő cél az anyag
Szakértesítő 1 Interkerám szakmai füzetek A folyósító szerek viselkedése a kerámia anyagokban A folyósító szerek viselkedése a kerámia anyagokban Bevezetés A kerámia masszák folyósításkor fő cél az anyag
Badari Andrea Cecília
 Nagy nitrogéntartalmú bio-olajokra jellemző modellvegyületek katalitikus hidrodenitrogénezése Badari Andrea Cecília MTA Természettudományi Kutatóközpont, Anyag- és Környezetkémiai Intézet, Környezetkémiai
Nagy nitrogéntartalmú bio-olajokra jellemző modellvegyületek katalitikus hidrodenitrogénezése Badari Andrea Cecília MTA Természettudományi Kutatóközpont, Anyag- és Környezetkémiai Intézet, Környezetkémiai
Adatgyőjtés, mérési alapok, a környezetgazdálkodás fontosabb mőszerei
 GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 2002
 1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI FELVÉTELI FELADATOK 2002 JAVÍTÁSI ÚTMUTATÓ Az írásbeli felvételi vizsgadolgozatra összesen 100 (dolgozat) pont adható, a javítási útmutató részletezése szerint. Minden
1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI FELVÉTELI FELADATOK 2002 JAVÍTÁSI ÚTMUTATÓ Az írásbeli felvételi vizsgadolgozatra összesen 100 (dolgozat) pont adható, a javítási útmutató részletezése szerint. Minden
Általános Kémia Gyakorlat II. zárthelyi október 10. A1
 2008. október 10. A1 Rendezze az alábbi egyenleteket! (5 2p) 3 H 3 PO 3 + 2 HNO 3 = 3 H 3 PO 4 + 2 NO + 1 H 2 O 2 MnO 4 + 5 H 2 O 2 + 6 H + = 2 Mn 2+ + 5 O 2 + 8 H 2 O 1 Hg + 4 HNO 3 = 1 Hg(NO 3 ) 2 +
2008. október 10. A1 Rendezze az alábbi egyenleteket! (5 2p) 3 H 3 PO 3 + 2 HNO 3 = 3 H 3 PO 4 + 2 NO + 1 H 2 O 2 MnO 4 + 5 H 2 O 2 + 6 H + = 2 Mn 2+ + 5 O 2 + 8 H 2 O 1 Hg + 4 HNO 3 = 1 Hg(NO 3 ) 2 +
Készítette: NÁDOR JUDIT. Témavezető: Dr. HOMONNAY ZOLTÁN. ELTE TTK, Analitikai Kémia Tanszék 2010
 Készítette: NÁDOR JUDIT Témavezető: Dr. HOMONNAY ZOLTÁN ELTE TTK, Analitikai Kémia Tanszék 2010 Bevezetés, célkitűzés Mössbauer-spektroszkópia Kísérleti előzmények Mérések és eredmények Összefoglalás EDTA
Készítette: NÁDOR JUDIT Témavezető: Dr. HOMONNAY ZOLTÁN ELTE TTK, Analitikai Kémia Tanszék 2010 Bevezetés, célkitűzés Mössbauer-spektroszkópia Kísérleti előzmények Mérések és eredmények Összefoglalás EDTA
5. Az adszorpciós folyamat mennyiségi leírása a Langmuir-izoterma segítségével
 5. Az adszorpciós folyamat mennyiségi leírása a Langmuir-izoterma segítségével 5.1. Átismétlendő anyag 1. Adszorpció (előadás) 2. Langmuir-izoterma (előadás) 3. Spektrofotometria és Lambert Beer-törvény
5. Az adszorpciós folyamat mennyiségi leírása a Langmuir-izoterma segítségével 5.1. Átismétlendő anyag 1. Adszorpció (előadás) 2. Langmuir-izoterma (előadás) 3. Spektrofotometria és Lambert Beer-törvény
O k t a t á si Hivatal
 O k t a t á si Hivatal A versenyző kódszáma: 2015/2016. tanévi Országos Középiskolai Tanulmányi Verseny második forduló KÉMIA I. kategória FELADATLAP Munkaidő: 300 perc Elérhető pontszám: 100 pont ÚTMUTATÓ
O k t a t á si Hivatal A versenyző kódszáma: 2015/2016. tanévi Országos Középiskolai Tanulmányi Verseny második forduló KÉMIA I. kategória FELADATLAP Munkaidő: 300 perc Elérhető pontszám: 100 pont ÚTMUTATÓ
1) Standard hidrogénelektród készülhet sósavból vagy kénsavoldatból is. Ezt a savat 100-szorosára hígítva, mekkora ph-jú oldatot nyerünk?
 Számítások ph-val kombinálva 1) Standard hidrogénelektród készülhet sósavból vagy kénsavoldatból is. Ezt a savat 100-szorosára hígítva, mekkora ph-jú oldatot nyerünk? Mekkora az eredeti oldatok anyagmennyiség-koncentrációja?
Számítások ph-val kombinálva 1) Standard hidrogénelektród készülhet sósavból vagy kénsavoldatból is. Ezt a savat 100-szorosára hígítva, mekkora ph-jú oldatot nyerünk? Mekkora az eredeti oldatok anyagmennyiség-koncentrációja?
Oktatáskutató és Fejlesztő Intézet TÁMOP-3.1.1-11/1-2012-0001 XXI. századi közoktatás (fejlesztés, koordináció) II. szakasz KÉMIA 4.
 Oktatáskutató és Fejlesztő Intézet TÁMOP-3.1.1-11/1-2012-0001 XXI. századi közoktatás (fejlesztés, koordináció) II. szakasz KÉMIA 4. MINTAFELADATSOR KÖZÉPSZINT 2015 Az írásbeli vizsga időtartama: 120 perc
Oktatáskutató és Fejlesztő Intézet TÁMOP-3.1.1-11/1-2012-0001 XXI. századi közoktatás (fejlesztés, koordináció) II. szakasz KÉMIA 4. MINTAFELADATSOR KÖZÉPSZINT 2015 Az írásbeli vizsga időtartama: 120 perc
Általános Kémia GY 3.tantermi gyakorlat
 Általános Kémia GY 3.tantermi gyakorlat ph számítás: Erős savak, erős bázisok Gyenge savak, gyenge bázisok Pufferek, pufferkapacitás Honlap: http://harmatv.web.elte.hu Példatárak: Villányi Attila: Ötösöm
Általános Kémia GY 3.tantermi gyakorlat ph számítás: Erős savak, erős bázisok Gyenge savak, gyenge bázisok Pufferek, pufferkapacitás Honlap: http://harmatv.web.elte.hu Példatárak: Villányi Attila: Ötösöm
15. elıadás SZERVES ÜLEDÉKES KİZETEK
 15. elıadás SZERVES ÜLEDÉKES KİZETEK A KİSZÉN A kıszén növényi eredető, szilárd, éghetı, fosszílis üledékes kızet. A kıszénképzıdés szakaszai: Biokémiai szénülési folyamatok: kis mélységben huminsavak
15. elıadás SZERVES ÜLEDÉKES KİZETEK A KİSZÉN A kıszén növényi eredető, szilárd, éghetı, fosszílis üledékes kızet. A kıszénképzıdés szakaszai: Biokémiai szénülési folyamatok: kis mélységben huminsavak
ROMAVERSITAS 2017/2018. tanév. Kémia. Számítási feladatok (oldatok összetétele) 4. alkalom. Összeállította: Balázs Katalin kémia vezetőtanár
 ROMAVERSITAS 2017/2018. tanév Kémia Számítási feladatok (oldatok összetétele) 4. alkalom Összeállította: Balázs Katalin kémia vezetőtanár 1 Számítási feladatok OLDATOK ÖSSZETÉTELE Összeállította: Balázs
ROMAVERSITAS 2017/2018. tanév Kémia Számítási feladatok (oldatok összetétele) 4. alkalom Összeállította: Balázs Katalin kémia vezetőtanár 1 Számítási feladatok OLDATOK ÖSSZETÉTELE Összeállította: Balázs
Általános és szervetlen kémia 3. hét Kémiai kötések. Kötések kialakítása - oktett elmélet. Lewis-képlet és Lewis szerkezet
 Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Az egyensúly. Általános Kémia: Az egyensúly Slide 1 of 27
 Az egyensúly 6'-1 6'-2 6'-3 6'-4 6'-5 Dinamikus egyensúly Az egyensúlyi állandó Az egyensúlyi állandókkal kapcsolatos összefüggések Az egyensúlyi állandó számértékének jelentősége A reakció hányados, Q:
Az egyensúly 6'-1 6'-2 6'-3 6'-4 6'-5 Dinamikus egyensúly Az egyensúlyi állandó Az egyensúlyi állandókkal kapcsolatos összefüggések Az egyensúlyi állandó számértékének jelentősége A reakció hányados, Q:
Aerogél alapú gyógyszerszállító rendszerek. Tóth Tünde Anyagtudomány MSc
 Aerogél alapú gyógyszerszállító rendszerek Tóth Tünde Anyagtudomány MSc 2016. 04. 22. 1 A gyógyszerszállítás problémái A hatóanyag nem oldódik megfelelően Szelektivitás hiánya Nem megfelelő eloszlás A
Aerogél alapú gyógyszerszállító rendszerek Tóth Tünde Anyagtudomány MSc 2016. 04. 22. 1 A gyógyszerszállítás problémái A hatóanyag nem oldódik megfelelően Szelektivitás hiánya Nem megfelelő eloszlás A
Színesfémek forgácsolása
 Színesfémek forgácsolása Szerzı: Dr. Maros Zsolt Lektor: Prof. Dr. Horváth Mátyás Tartalomjegyzék Bevezetés 3 1. Színesfémek forgácsolásának sajátosságai 3 2. Alumíniumötvözetek csoportosítása 4 3. Alumíniumötvözetek
Színesfémek forgácsolása Szerzı: Dr. Maros Zsolt Lektor: Prof. Dr. Horváth Mátyás Tartalomjegyzék Bevezetés 3 1. Színesfémek forgácsolásának sajátosságai 3 2. Alumíniumötvözetek csoportosítása 4 3. Alumíniumötvözetek
ALKÍMIA MA Az anyagról mai szemmel, a régiek megszállottságával.
 ALKÍMIA MA Az anyagról mai szemmel, a régiek megszállottságával www.chem.elte.hu/pr Kvíz az előző előadáshoz 1. Mely mennyiségek között teremt kapcsolatot a bizonytalansági reláció? A) a koordináta értéke
ALKÍMIA MA Az anyagról mai szemmel, a régiek megszállottságával www.chem.elte.hu/pr Kvíz az előző előadáshoz 1. Mely mennyiségek között teremt kapcsolatot a bizonytalansági reláció? A) a koordináta értéke
Kémiai alapismeretek 6. hét
 Kémiai alapismeretek 6. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék biner 2013. október 7-11. 1/15 2013/2014 I. félév, Horváth Attila c Egyensúly:
Kémiai alapismeretek 6. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék biner 2013. október 7-11. 1/15 2013/2014 I. félév, Horváth Attila c Egyensúly:
MAGYAR ÉLELMISZERKÖNYV (Codex Alimentarius Hungaricus) 1-2-2004/45 számú előírás (Hatodik kiegészítés)
 MAGYAR ÉLELMISZERKÖNYV (Codex Alimentarius Hungaricus) 1-2-2004/45 számú előírás (Hatodik kiegészítés) Az élelmiszerekben használható egyes adalékanyagok tisztasági követelményei, az édesítőszerek és színezékek
MAGYAR ÉLELMISZERKÖNYV (Codex Alimentarius Hungaricus) 1-2-2004/45 számú előírás (Hatodik kiegészítés) Az élelmiszerekben használható egyes adalékanyagok tisztasági követelményei, az édesítőszerek és színezékek
Kész polimerek reakciói. Makromolekulák átalakítása. Makromolekulák átalakítása. Természetes és mesterséges makromolekulák átalakítása cellulóz, PVAc
 Kész polimerek reakciói 8. hét Természetes és mesterséges makromolekulák átalakítása cellulóz, PVAc szabad funkciós csoportok reakciói bomlási folyamatok Térhálósítási folyamatok A cellulóz szabad alkoholos
Kész polimerek reakciói 8. hét Természetes és mesterséges makromolekulák átalakítása cellulóz, PVAc szabad funkciós csoportok reakciói bomlási folyamatok Térhálósítási folyamatok A cellulóz szabad alkoholos
Elektrolit kölcsönhatások tőzzománc iszapokban Peggy L. Damewood; Pemco Corporation The Vitreous Enameller 2009,60,4
 Elektrolit kölcsönhatások tőzzománc iszapokban Peggy L. Damewood; Pemco Corporation The Vitreous Enameller 2009,60,4 (Fordította: Barta Emil) A bórax, magnézium-karbonát, kálium-karbonát és nátrium-nitrit
Elektrolit kölcsönhatások tőzzománc iszapokban Peggy L. Damewood; Pemco Corporation The Vitreous Enameller 2009,60,4 (Fordította: Barta Emil) A bórax, magnézium-karbonát, kálium-karbonát és nátrium-nitrit
Többértékű savak és bázisok Többértékű savnak/lúgnak azokat az oldatokat nevezzük, amelyek több protont képesek leadni/felvenni.
 ELEKTROLIT EGYENSÚLYOK : ph SZÁMITÁS Általános ismeretek A savak vizes oldatban protont adnak át a vízmolekuláknak és így megnövelik az oldat H + (pontosabban oxónium - H 3 O + ) ion koncentrációját. Erős
ELEKTROLIT EGYENSÚLYOK : ph SZÁMITÁS Általános ismeretek A savak vizes oldatban protont adnak át a vízmolekuláknak és így megnövelik az oldat H + (pontosabban oxónium - H 3 O + ) ion koncentrációját. Erős
Főzőpoharak. Desztillált víz. Vegyszeres kanál Üvegbot Analitikai mérleg Fűthető mágneses keverő
 KÉMIA TÉMAHÉT 2015 Előzetes feladatok A projekt napokat megelőzően két alkalommal ült össze hat fős csoportunk. Az első alkalommal (márc.02.) Likerné Pucsek Rózsa tanárnő kiosztotta az elkészítendő feladatokat.
KÉMIA TÉMAHÉT 2015 Előzetes feladatok A projekt napokat megelőzően két alkalommal ült össze hat fős csoportunk. Az első alkalommal (márc.02.) Likerné Pucsek Rózsa tanárnő kiosztotta az elkészítendő feladatokat.
Fotoszintézis. fotoszintetikus pigmentek Fényszakasz - gránum/sztrómalamella. Sötétszakasz - sztróma
 Fotoszintézis fotoszintetikus pigmentek Fényszakasz - gránum/sztrómalamella Sötétszakasz - sztróma A növényeket érı hatások a pigmentösszetétel változását okozhatják I. Mintavétel (inhomogén minta) II.
Fotoszintézis fotoszintetikus pigmentek Fényszakasz - gránum/sztrómalamella Sötétszakasz - sztróma A növényeket érı hatások a pigmentösszetétel változását okozhatják I. Mintavétel (inhomogén minta) II.
BIOAKTÍV KALCIUMTARTALMÚ GÉL- ÉS KERÁMIARENDSZEREK
 BIOAKTÍV KALCIUMTARTALMÚ GÉL- ÉS KERÁMIARENDSZEREK DOKTORI ÉRTEKEZÉS TÉZISEI MEISZTERICS ANIKÓ DR. SINKÓ KATALIN ELTE KÉMIA INTÉZET; EGYETEMI DOCENS, PHD. HABIL. DR. ROSTA LÁSZLÓ MTA SZFKI NSO; OSZTÁLYVEZETŐ,
BIOAKTÍV KALCIUMTARTALMÚ GÉL- ÉS KERÁMIARENDSZEREK DOKTORI ÉRTEKEZÉS TÉZISEI MEISZTERICS ANIKÓ DR. SINKÓ KATALIN ELTE KÉMIA INTÉZET; EGYETEMI DOCENS, PHD. HABIL. DR. ROSTA LÁSZLÓ MTA SZFKI NSO; OSZTÁLYVEZETŐ,
Számítások ph-val kombinálva
 Bemelegítő, gondolkodtató kérdések Igaz-e? Indoklással válaszolj! A A semleges oldat ph-ja mindig éppen 7. B A tömény kénsav ph-ja 0 vagy annál is kisebb. C A 0,1 mol/dm 3 koncentrációjú sósav ph-ja azonos
Bemelegítő, gondolkodtató kérdések Igaz-e? Indoklással válaszolj! A A semleges oldat ph-ja mindig éppen 7. B A tömény kénsav ph-ja 0 vagy annál is kisebb. C A 0,1 mol/dm 3 koncentrációjú sósav ph-ja azonos
JAVÍTÁSI-ÉRTÉKELÉSI ÚTMUTATÓ
 Kémia emelt szint 0513 ÉRETTSÉGI VIZSGA 2005. május 18. KÉMIA EMELT SZINTŰ ÉRETTSÉGI VIZSGA Az írásbeli vizsga időtartama: 240 perc JAVÍTÁSI-ÉRTÉKELÉSI ÚTMUTATÓ OKTATÁSI MINISZTÉRIUM Az írásbeli feladatok
Kémia emelt szint 0513 ÉRETTSÉGI VIZSGA 2005. május 18. KÉMIA EMELT SZINTŰ ÉRETTSÉGI VIZSGA Az írásbeli vizsga időtartama: 240 perc JAVÍTÁSI-ÉRTÉKELÉSI ÚTMUTATÓ OKTATÁSI MINISZTÉRIUM Az írásbeli feladatok
1. B 6. C 11. E 16. B 2. E 7. C 12. C 17. D 3. D 8. E 13. E 18. D 4. B 9. D 14. A 19. C 5. C 10. E 15. A 20. C Összesen: 20 pont
 A 2004/2005. tanévi rszágos Középiskolai Tanulmányi Verseny első (iskolai) fordulójának feladatmegoldásai KÉMIÁBÓL I-II. kategória I. FELADATSR 1. B 6. C 11. E 16. B 2. E 7. C 12. C 17. D 3. D 8. E 13.
A 2004/2005. tanévi rszágos Középiskolai Tanulmányi Verseny első (iskolai) fordulójának feladatmegoldásai KÉMIÁBÓL I-II. kategória I. FELADATSR 1. B 6. C 11. E 16. B 2. E 7. C 12. C 17. D 3. D 8. E 13.
Név: Dátum: Oktató: 1.)
 1.) Jelölje meg az egyetlen helyes választ (minden helyes válasz 1 pontot ér)! i). Redős szűrőpapírt akkor célszerű használni, ha a). növelni akarjuk a szűrés hatékonyságát; b). a csapadékra van szükségünk;
1.) Jelölje meg az egyetlen helyes választ (minden helyes válasz 1 pontot ér)! i). Redős szűrőpapírt akkor célszerű használni, ha a). növelni akarjuk a szűrés hatékonyságát; b). a csapadékra van szükségünk;
