MINIATÜRIZÁLÁS AZ ELVÁLASZTÁSTECHNIKÁBAN Elektroforézis mikrochipek alkalmazása a modern bioanalitikában In Memoriam Professzor Horváth Csaba
|
|
|
- Szebasztián Szalai
- 8 évvel ezelőtt
- Látták:
Átírás
1 Guttman András az MTA külső tagja MINIATÜRIZÁLÁS AZ ELVÁLASZTÁSTECHNIKÁBAN Elektroforézis mikrochipek alkalmazása a modern bioanalitikában In Memoriam Professzor Horváth Csaba Elhangzott 2004 október 12-én (részletek) Napjainkban az újabb és újabb molekuláris biológiai módszerek kidolgozása egyre szorosabb kapcsolatba kerül a műszaki tudományokkal, és az egyre hatékonyabb, egyre jobban automatizált technikák megvalósítása ezen szakterületek közös feladata. A természettudományokban az utóbbi évtizedben bekövetkezett paradigmaváltás következtében a kémiai, biokémiai és molekuláris biológiai módszerek mindinkább a rendszerbiológia (1. ábra); az organizmus egy kísérletben történő, globális, átfogó vizsgálata felé tolódnak. A genomika, proteomika és metabolomika rohamosan növekvő igényeinek és a technikában megfigyelhető általános fejlődési tendenciáknak megfelelően a miniatürizálás az elválasztástechnikák körében is egyre inkább tért hódít, mivel egyre kisebb térfogatú, ugyanakkor nagyszámú minta kis helyen történő, gyors analízisét teszi lehetővé [Heller és Guttman, 2002]. 1. ábra. A bioanalitika szerepe a rendszer biológiában Korunkban a komplex biológiai minták vizsgálatánál elengedhetetlen az olyan modern bioanalitikai módszerek alkalmazása, mint a genomtérképezés és -szekvenálás, proteomanalízis és -szekvenálás, valamint metabolomanalízis és -azonosítás. A kapott adatokat bioinformatikai módszerek segítségével hasonlítjuk össze a már meglévő adatbázisokkal, ami nagymértékben megkönnyíti a differenciáltan kifejezett gének illetve géntermékek azonosítását és hasznosítását napjaink orvostudományában és a modern gyógyszerkutatás, -fejlesztés során [Darvas, Guttman és Dorman, 2004]. A múltban a kémiai szintézissel előállított molekulákat egyszerűen próbaszerencse alapon vizsgálták. Ma a nagy mennyiségben rendelkezésre álló kombinatorikus kémiai könyvtárak lehetővé teszik, hogy milliószámra vizsgáljunk újabb és újabb vegyületeket. Így a génszekvenciák és géntermékek ismeretében egyre inkább áttérünk a biológiai fekete doboz vizsgálatáról a rendszer biológiai megközelítésre. A modern orvostudományi kutatások ennek kapcsán genomikai adatbázisokból kiindulva a transzkriptom, proteom és metabolom feltérképezésén keresztül érnek el újabb és újabb eredményeket. E célok eléréséhez azonban feltétlenül szükség van modern és nagyhatékonyságú elválasztási technikák kifejlesztésére. Ezen 1
2 módszereknek meg kell felelniük korunk és természetesen a vizsgált biológiai rendszer kívánalmainak, úgymint kismennyiségű minták (mikro- és nanoliter térfogatok) gyors analízise (másodperces elválasztási idők), nagy felbontóképesség és olyan enyhe elválasztási körülmények, amelyek lehetővé teszik a szeparált komponensek további azonosítását, többnyire tömegspektrometriával vagy mikroszekvenálással [Rathore és Guttman, 2003]. A detektálási érzékenységnek bizonyos esetekben el kell érnie az egy molekula kimutathatósági határt. E modern elválasztási módszereket főleg a rendszer biológia részterületein használjuk, de ezen túl természetesen alkalmazást találnak biomarkerek felfedezésénél, metabolizmus utak analízisében és gyógyszer-céltermékek validálási eljárása során. A korszerű műszeres bioanalitika egyik alapmódszere a nagynyomású folyadékkromatográfia (HPLC), melyet Horváth Csaba professzor fejlesztett ki csaknem négy évtizeddel ezelőtt [Karger, Snyder és Horváth, 1973]. A technika azóta igen komoly fejlődésen ment keresztül és napjainkban a nagyhatékonyságú folyadékkromatográfiás készülékek világszerte az élettudományokkal és gyógyszerfejlesztéssel foglalkozó laboratóriumok mindegyikében megtalálhatók. Az utóbbi évtizedben a nagyhatékonyságú folyadékkromatográfiás módszerek továbbfejlesztése két- sőt többdimenziós rendszerekké komoly előrelépést jelentett a proteomikai és matabolomikai kutatásokban szükséges nagy felbontóképesség eléréséhez. A modern bioanalitika és molekuláris biológia másik leggyakrabban használt elválasztástechnikai módszere az elektroforézis. A poliakrilamid és agaróz gélt alkalmazó elektroforézis technikák alapvető fontosságúak a genomikában és proteomikában. A konvencionális (lap) gél-elektroforézis lehetővé teszi mind egy-, mind kétdimenziós elválasztási rendszerek alkalmazását. A tömegspektrometria és mágneses magrezonancia spektroszkópia szintén fontos szerepet játszik a modern bioanalitikában, különösen csatolt módszerek alkalmazásánál, azaz valamilyen elválasztástechnikai módszerrel összekötve. Ezek a modern kapcsolt rendszerek tették lehetővé az olyan nagyhatékonyságú elválasztási és azonosítási módszerek bevezetését, mint például a nanolc-nanolc/ms 2 -en alapuló multidimenzionális fehérjeazonosítási technika (MUDPIT), amely napjaink proteomika kutatásának egyik leggyakrabban alkalmazott módszere. A kapilláris elektroforézist mint elválasztási technikát csaknem két évtizede használjuk főképpen biomolekulák gyors analízisére [Karger, Cohen és Guttman, 1989]. A Guttman és munkatársai által a 90-es évek elején kifejlesztett, géllel töltött kapillárisok olyan nagyfelbontású DNSelválasztásokat eredményeztek, ami a későbbiekben lehetővé tette a humán genom évekkel a tervezett időpont előtti teljes szekvenálását [Cohen, Najarian, Paulus, Guttman és mtsi, 1988; Guttman, 2003]. A kapilláris elektroforézissel nem csak DNS-molekulákat, hanem fehérjéket [Ganzler, Greve, Cohen, Karger, Guttman és mtsi, 1992; Guttman, Horváth és Cooke, 1993] és komplex szénhidrátokat [Guttman, 1996] is nagy sikerrel választhatunk el. 2. ábra. Elektroforetikus mikrochip mérete az egyforintos érmével összehasonlítva 2
3 A mikrochip elektroforézis [Khandurina és Guttman, 2003] a kapilláris elektroforézisből fejlődött ki és napjaink legmodernebb elválasztástechnikai eszközei közé tartozik, mely biológiailag fontos molekulák úgymint a DNS, fehérjék és komplex cukrok gyors és hatékony elválasztására alkalmas. A módszer azért kapta ezt a nevet, mert a kémiai chipek előállítása a számítógépchipek gyártása során alkalmazott technikákat (fotolitográfia, kémiai maratás, stb.) hasznosítja [Heller és Guttman, 2002]. A miniatürizálás számos előnnyel jár különösen azon alkalmazások esetében, ahol nagyszámú minta gyors elemzése szükséges, ami a rendszer biológia korszakában alapvető fontosságú. Az analízis kisméretű üveg vagy műanyag lapba maratott csatornákban történik (2. ábra), és a néhány cm hosszúságú kapillárisokban a nanoliternyi mennyiségű minták elemzése csupán másodperceket, esetleg perceket vesz igénybe [Ronai, Barta, Sasvari-Szekely és Guttman, 2001]. A miniatürizálás több nagyságrend előrelépést jelent, nemcsak az elválasztás gyorsasága, hanem annak felbontóképessége szempontjából is. Emellett hagyományosan egymást követő kémiai és biokémiai reakciók, valamint elválasztási lépések úgymint polimeráz láncreakció (PCR), restrikciós enzimes emésztés (RFLP), DNS-fragmentumanalízis akár egyetlen monolitikus mikrochipben is elvégezhetők [Chovan és Guttman, 2002]. A miniatürizálás előnyei közé tartozik a kis reagens igény, csökkentett oldószer felhasználás és gyors analízisidő. Ugyanakkor ezen módszer magában hordozza a multiplex, integrált rendszerek kialakításának lehetőségét is. Sokcsatornás chipek alkalmazásával akár több száz minta párhuzamos vizsgálata válik lehetővé (96, 384, stb.), s mivel ezen új módszer könnyen automatizálható, mindez jelentős munka-, idő-, anyag- és költség-megtakarítást jelent. A kémiai mikrochipek bevezetésével a közeljövőben az analitikai kémiai laboratóriumok gyökeres változásának nézünk elébe [Khandurina, Zhu és Guttman, 2003]. Hasonlóan a számítástechnika robbanásszerű fejlődéséhez, amely lehetővé tette, hogy Neumann János egykori több szobát elfoglaló számítógépét ma már egy kis laptop-számítógéppel helyettesítsük, az általunk manapság elfogadott analitikai kémiai laboratórium akár hitelkártya méretűre is lekicsinyíthető [Guttman, 2000]. Abból kiindulva, hogy a számítógépek központi processzorainak sebessége nagyjából 18 havonta megduplázódik, felmerül a kérdés, hogy vajon a kémiai chip technológia képes lesz-e felvenni ezt az iramot? Mielőtt azonban jobban belemerülnék a kémiai chipek részletes leírásába, szeretném megragadni az alkalmat, hogy felhívjam a figyelmet a DNS/fehérjechipek és az elválasztástechnikai kémiai chipek közötti alapvető különbségre. Maga a kémiai chip mindkét esetben speciális mikromegmunkálási eljárással készül, de míg a DNS/fehérjechiphez akár több százezer DNS vagy fehérjemolekula köthető, lehetővé téve annak tömeges diagnosztikai alkalmazását, addig az elválasztástechnikai mikrochipek magas szelektivitásukkal tűnnek ki [Khandurina és Guttman, 2002]. A DNS-chipek működésének alapelve azonos a Southern-blot ill. a reverse dot blot hibridizációs módszerekével, a legfőbb különbség a méretdimenziókban és ebből következőleg a hatékonyságban van. A módszer lényege ebben az esetben kvázi szekvenciaanalízis: a vizsgált DNS a chip felszínén rögzített ismert bázissorrendű próbákhoz kötődik, aminek alapján a minta szekvenciájára következtetünk. A technika minőségi és mennyiségi analízisre egyaránt alkalmas. Fő felhasználási területe a génexpresszió elemzése és mutációk, illetve egypontos nukleotid polimorfizmusok (pont polimorfizmus: SNP) valamint rövid, 1 5 bázispárt érintő inzerciók, mikroszatellita polimorfizmusok és deléciók ezreinek, tízezreinek párhuzamos vizsgálata. Hasonlóképpen a DNS-chipekhez, a fehérjechipekre nagyszámú fehérjét (pl. antitestet) kötnek, és ezek segítségével vizsgálnak egész sejtkivonatokat, illetve különböző testfolyadékokat [Khandurina, Zhu és Guttman, 2003]. Lényegesnek tartom itt megjegyezni, hogy az úgynevezett Lab-on-a-chip megközelítés napjainkban már a realitás szintjén áll, lehetővé téve számos egymást követő műveleti lépés, pl. 3
4 kémiai reakciók, mintaelőkészítés, elválasztás és frakcionálás gyakorlatilag egyetlen mikrochipen történő megvalósítását egy megfelelően kialakított monolitikus rendszerben [Chovan és Guttman, 2001]. Az elektroforézis mikrochip elkészítésének első lépése a csatornahálózat és reagenstartó edények elrendezésének megtervezése annak tudatában, hogy mit várunk el a kémiai chiptől. A következő lépés a terv megfelelő chipalapanyagra való átvitele, felhasználva a számítógépes mikrochipek gyártásánál bevezetett és ma már nagyiparilag is alkalmazott módszereket. Ezzel a technikával akár több ezres nagyságrendben is előállíthatók elektroforézis chipek. Megfelelő detektorok alkalmazásával femto- és attomol mennyiségű minta detektálása lehetséges, és az így kialakított mikrochipek 10, sőt 100-szoros analízissebességet biztosítanak a konvencionális elválasztási módszerekhez képest. Különösen előnyös, hogy már meglévő és beállított folyadékkromatográfiás vagy kapilláris elektroforézis módszerek egyszerűen átültethetők mikrochip formátumra. Többcsatornás chipek alkalmazásával (96, 384, vagy több csatorna) akár nagyságrendekkel is megnövelhető a rendszer kapacitása, és az így nyert hatalmas adathalmaz megfelelően gyors számítógépekkel rövid idő alatt kiértékelhető [Darvas, Guttman és mtsi, 2004]. Elektroforézis mikrochipeket mikromegmunkálással készíthetünk üvegből, kvarcból és különböző műanyagokból, úgymint polimetil-metakrilát, teflon, polikarbonát, stb. A mikrochipekre jellemző rendkívül magas felület térfogat arány előnyös az elektroforetikus folyamatban felszabaduló hő gyors elvezetése szempontjából. Ugyanakkor a kémiai chipalapanyag kiválasztásánál megfontolandó, hogy miniatürizált körülmények között ezen nagy felület anyagi minősége is fontos szerepet játszhat. Ez különösen lényeges lehet fehérjék elektroforézise ill. kémiai reakciók (polimeráz láncreakció, restrikciós emésztés) során, amikor a negatív töltésű üvegfelszín esetleg gátló tényezőként szerepelhet (például nem-specifikus kötődés). Műanyagok alkalmazása esetén ezzel a kedvezőtlen hatással kevésbé kell számolnunk, emellett a műanyagból készült kémiai chipek olcsók, nem törékenyek és könnyen megmunkálhatók [Berdichevsky, Khandurina, Guttman és mtsi, 2004]. Üvegből készült elektroforézis mikrochipek esetén a mintakomponensek elválasztása kisméretű üveglapba maratott csatornákban történik, melyek általában µm mélyek és µm szélesek (2. ábra). A kialakított munkacsatornákban egyszerű pufferoldatoktól a bonyolult géleken keresztül a monolitikus elektrokromatográfiás állófázisokig bármilyen elválasztó-rendszert alkalmazhatunk. Az elektroforézis mikrochipek tipikus mérete néhány centiméter, ámbár 96 és 384 csatornás chipek esetén elérheti a cm-t is. A csatornák a mikrochip felszínén lévő nyílásokban végződnek, amik az oldatok (minta, puffer, szeparáló mátrix) betöltésére szolgálnak (3. ábra). Az ide csatlakozó elektródok segítségével az egyes csatornákban különböző nagyságú és polaritású elektromos mezők alakíthatók ki, amelyek alkalmasak a mikrochipben lévő anyagok mozgatására és a mintakomponensek elektroforetikus elválasztására. A pufferoldatok és a minta mozgatása az általában alkalmazott elektrokinetikus módon kívül még nyomással/vákuummal is elérhető. A legegyszerűbb mikrochipek két, egymást keresztező csatornát tartalmaznak. A rövidebb csatorna a minta injektálására, a hosszabb az elektroforetikus elválasztásra szolgál. Két mintatartály alkalmazásával egyetlen csatornában is igen pontos molekula-méretmeghatározás válik lehetővé, a minta és megfelelő molekulatömegű marker egyidejű injektálásával és elválasztásával. A 3. ábrán bemutatott egyszerű alkotóelemek, úgymint egyenes csatorna, T elágazás vagy kereszt alakú csatlakozás felhasználásával, igen komplikált integrált rendszereket alakíthatunk ki [Guttman, 2001]. Így egyszerűen összekapcsolható egy kémiai/biokémiai reaktor egység az injektáló rendszerrel, az elválasztócsatornával és egy esetleges frakciószedővel az elválasztó csatorna megfelelő részén. Ugyanakkor ma már 4
5 lényegesen összetettebb elrendezésű elektroforetikus mikrochipek is léteznek: 10 cm átmérőjű mikrochip sugár irányú csatornáiban 96 minta egyszerre vizsgálható [Khandurina és Guttman, 2002]. Az ilyen sokcsatornás mikrochipre a minták felvitele általában folyadékkezelő automatákkal történik, és egy minta analízisének ideje átlagosan 5 másodperc. 3. ábra. Integrált elektroforézis mikrochip főbb csatornahálózati alkotóelemei [Guttman, 2001] Az elektroforetikus mikrochip tervezése során megfelelő számítógép programokat is alkalmazhatunk, melyek segítségével jól szimulálhatjuk a mikrochipen lejátszódó reakciós és elválasztási lépéseket [Chovan és Guttman, 2002]. A megfelelő tervrajz birtokában első lépésként fotolitográfiás módszerekkel elkészítjük a chipen a kialakítandó csatornahálózatot. Ez üveg alapanyag esetén ammónium-fluorid és hidrogén-fluorid keverékkel történő maratással végezhető el. A kívánt csatornamélység elérése után (általában µm), a kialakított csatornahálózatot megfelelően előkészített üveg, vagy műanyaglappal lefedjük, és hőkezeléssel (~600 C) vagy ragasztással (Na 2 SiO 3 ) rögzítjük. Az így kapott zárt csatornarendszer végein megfelelő átmérőjű (~1 2 mm) lyukakat fúrva oldhatjuk meg a makro -világgal való kommunikációt, elektródok, oldatok bevezetését, mintainjektálást, stb. [Khandurina és Guttman, 2002]. Mint korábban már említettem, az elektroforetikus mikrochip előállítására szolgáló két fő alapanyag-típus az üveg és a megfelelő műanyagok. Az üveg előnye jó optikai és hővezető tulajdonságai és a már nagyszámban rendelkezésre álló felületkezelési, illetve derivatizálási módszerek. Hátránya azonban az üvegből készült chipeknek, hogy még tömeges gyártás esetén is igen drágák. Ugyanakkor a műanyagból készült chipek optikai és hővezető tulajdonságai változóak, és bizonyos esetekben még autofluoreszcenciával is számolnunk kell. További hátránya a műanyag chipeknek, hogy a rendelkezésre álló kémiai felületkezelési és derivatizációs módszerek száma korlátozott. Kihangsúlyozom viszont, hogy a műanyag chipek előállítása kifejezetten olcsó, ami lehetővé teszi az egyszer használatos, eldobható chipek alkalmazását [Darvas, Guttman és Dorman, 2004]. A detektálás a mikrochipen főképpen lézerindukált fluoreszcencia (LIF) segítségével történik, de emellett más módszerek, mint ultraibolya fényelnyelés, elektrokémiai és tömeg-spektrometriai technikák is alkalmazhatók [Guttman és Khandurina, 2003]. A detektálás a HPLC-hez hasonlóan csaknem minden esetben on-line módon történik. Kutatólaboratóriumomban felépített és alkalmazott elektroforézis mikrochip detektor-rendszer 5
6 felépítésének sémáját a 4. ábra mutatja (Ronai, Sasvari-Szekely, Chovan és Guttman 2002). Lézer indukált fluoreszcens detektálás esetén a mikrochipet egy fordított konfokális mikroszkóp tárgyasztalán helyezzük, és a megfelelő hullámhosszúságú lézer sugarat az objektív segítségével a mikrochip elválasztó-csatornájának egy adott pontjára fókuszáljuk. 4. ábra. Az elektroforetikus mikrochip berendezés felépítésének vázlata: 1. lézer, 2. tükör, 3. kettőstörő tükör, 4. mikroszkóp objektív, 5. elektroforetikus mikrochip, 6. lencsék, 7. optikai szűrők, 8. detektor, 9. puffer tartályok, 10. nagyfeszültségű tápegység [Ronai, Sasvari-Szekely, Chovan és Guttman, 2002] A mintaadagolás két fő módja az úgynevezett elektrokinetikus és zárt kapus injektálás. Az 1. táblázatban bemutatott konfiguráció esetén a 4. mélyedés a mintát, az 1., 2. és 3. mélyedések pedig a futtató puffert tartalmazzák. Elektrokinetikus injektálás során a minta a mintatartó tartályból áramolva (1. táblázat, 4-es pozíció) megtölti a rövid mintatartó csatornát (4 => 2) és ennek megfelelően a rövid (mintatartó) és a hosszú (elválasztó) csatornák kereszteződését. Az ezt követő elektroforézis analízis során ténylegesen a mintának csak azt a kis részét injektáltuk, ami a mintatartó csatorna feltöltése után éppen a kereszteződésben van. Zárt kapus injektálás esetén ezzel szemben a kapocsfeszültségek változtatásával tetszés szerint állíthatjuk be az injektált minta térfogatát [Khandurina és Guttman, 2002]. Mindkét injektálási módot követően az elválasztás során a kapocsfeszültségeket úgy választjuk meg, hogy a kapillárisok kereszteződésében lévő molekulák az elválasztó csatornában az injektálási pont irányából mozogjanak a detektálási pont felé, ugyanakkor a futtató puffer egy része lassan visszaáramoljon az elválasztó csatornából a minta-, illetve a gyűjtőtartályok felé. Ez a beállítási mód a jó felbontású mikrochip-elektroforézis alapfeltétele, mivel ha a minta az elválasztási lépés során folyamatosan beszivárog az elválasztó csatornába, akkor éles csúcsok helyett elmosódott, emelkedő alapvonalú elektroferogramot kapunk. Az injektálás és az elválasztás során alkalmazott feszültségértékeket ennek megfelelően kell beállítani, amint azt az 1. táblázat mutatja [Ronai, Sasvari-Szekely, Chovan és Guttman, 2002]. Tartály Negatív töltésű részecskék vándorlása 6
7 Injektálás (V) Elválasztás (V) táblázat. Elektrokinetikai injektálás és elválasztás során alkalmazott feszültségértékek egyszerű keresztelrendezésű mikrochip esetén [Ronai, Sasvari-Szekely, Chovan és Guttman, 2002] A leggyakrabban használt egyszerű mikrochip-alkalmazások mellett (DNS-fragmentum analízis, fehérjék SDS gél elektroforézise, komplex szénhidrátok elválasztása, stb.) olyan integrált rendszereket is kidolgozhatunk, melyek korábban a konvencionális módszerek alkalmazásával elképzelhetetlenek voltak. Egyetlen folyamat részeként a mikrochip csatornáiban polimeráz láncreakció (PCR), mintakoncentrálás, valamint restrikciós emésztés (RFLP) is elvégezhető [Rathore és Guttman, 2003], így a módszer igen hatékonyan használható gyors DNSanalízisre, és egyszerűen alkalmazható mind egypontos nukleotid polimorfizmusok (SNP), mind pedig hosszúság-polimorfizmusok (VNTR) vizsgálatára és genotipizálásra (5. ábra) ahogy azt munkacsoportommal bemutattuk [Barta, Ronai és mtsi, 2001; Guttman, Khandurina és mtsi, 2003]. Megfelelő körülmények között olyan nagy felbontóképességet érhetünk el, hogy bizonyos mikrochip-konfigurációkat DNS-szekvenálásra is alkalmazhatunk [Karger és Guttman, 2003]. Az elektroforetikus mikrochipek ezen felül nagyszerűen alkalmazhatók a modern gyógyszerkutatásfejlesztésben nagykapacitású biológiai szűrésre, dózishatás elemzésre és tömeges mintaanalízis esetén [Darvas, Guttman és Dorman, 2004]. 5. ábra. A D4-es dopamin receptor DRD4 gén III. exon 48 bp VNTR gyors genotipizálása mikrochip elektroforézisse [Barta, Ronai, Nemoda, Szekely, Kovacs, Sasvari-Szekely és Guttman, 2001] 7
8 Az elektroforézis mikrochipek amellett, hogy kiválóan használhatók kismennyiségű biológiai minták analízisére, mikropreparatív célokra is alkalmazhatók. Különösen komplex DNS-minták esetén érdekes ez az elválasztási forma, mivel a polimeráz láncreakció elterjedése óta gyakorlatilag néhány DNS-molekula is elegendő ahhoz, hogy további szekvenálási vagy klónozási kísérletekhez megfelelő mennyiségű anyagot nyerjünk [Guttman, Fules és mtsi, 2003; Liu és Guttman, 2004]. Legegyszerűbben a már korábban említett és a 6. ábrán is bemutatott keresztelrendezés használható frakciószedésre [Khandurina, Chovan és Guttman, 2002]. Ebben az esetben a detektálási lézersugarat pontosan a kereszteződésre irányítjuk, miközben az elválasztási csatornában szétválasztott komponensek egyenként haladnak az elektromos erőtér hatására a csatornakereszteződés és ennek megfelelően a detektálási pont felé. 6. ábra. Preparatív mikrochip elektroforézis [Khandurina, Chovan és Guttman, 2002] Az első gyűjteni kívánt komponens detektálásakor a kereszteződés egyes végeire adott feszültségeket úgy állítjuk át, hogy az elválasztó csatornában a komponensek lehetőleg ne mozogjanak, ugyanakkor a frakciógyűjtő csatornában a kiválasztott komponens mielőbb elérje a gyűjtő edényt. Ezt a műveletet annyiszor ismételjük, ahány frakcióra van szükségünk. Külön kihangsúlyozandó, hogy ezzel a módszerrel nemcsak időben, hanem térben is jól elválaszthatók az egymáshoz egyébként közel vándorló mintakomponensek [Khandurina és Guttman, 2002]. A vázolt módszer remekül alkalmazható nagyszámú minta klónozása esetén (7. ábra), amikor különösen lényeges az egyes DNS-fragmentumok tisztasága a szintetizálandó fehérje minősége szempontjából [Ronai és Guttman, 2000]. 7. ábra. Mikrochip alapú klónozás főbb lépései [Ronai és Guttman, 2000] 8
9 Előadásomat összefoglalva szeretném kihangsúlyozni, hogy a kémiai és biológiai tudományok rohamos fejlődése új igényeket és ezeknek megfelelő új megoldásokat eredményezett az elektroforetikus elválasztási technikák területén is. Az egyik legújabb módszer gyors analízisek elvégzésére a mikroelektroforézis, az ún. elektroforézis mikrochip technika [Heller és Guttman, 2002]. Az elektroforézis mikrochip lényegében miniatürizált kapilláris elektroforézis berendezésnek tekinthető, így a már kidolgozott, valamint már részben beállítás alatt álló alkalmazások kiemelkedően széleskörűek. A miniatürizálás komoly előrelépést jelent, mivel nemcsak az elválasztás sebessége, hanem annak felbontóképessége is nagyságrendekkel emelkedik. Amennyiben szükséges, kémiai és biokémiai reakcióegységek és elválasztási csatornák integrálhatók egy monolitikus mikrochipre, akár oly módon is, hogy 96 egymástól független rendszer, illetve akár ennek többszöröse (384, 1536, stb.) ráférjen. Ez utóbbi esetben megfelelő folyadékadagoló automata segítségével az összes minta (96, 384, 1536, stb) egyszerre injektálható. Az eredmények kiértékelése megfelelően gyors és nagy kapacitású számítógép segítségével csupán másodperceket vesz igénybe. Ez a kémiai mikrochipekkel egyszerűen megoldható integráció jelentős idő-, költség- és munkamegtakarítást jelent különösen a rendszer biológia területén ideértve a genom-, proteom- és metabolomkutatási alkalmazásokat. Köszönetnyilvánítás Előadásom végén szeretnék köszönetet mondani mindazoknak, akik közvetlenül vagy közvetve hozzájárultak ahhoz, hogy ezt a székfoglalót ma megtarthattam. Elsősorban azoknak a hazai szakembereknek mondanék köszönetet, akik szakmai pályám fejlődésének elősegítésével járultak hozzá eredményeimhez. Középiskolai tanáraimról, Horváth Sándorról és Halász Györgyről való megemlékezés után egyetemi diplomáim témavezetőiről, dr. Pályi Gyuláról és dr. Lengyel Tamásról szeretnék említést tenni. Első munkahelyemen, a Semmelweis Orvostudományi Egyetem I. sz Kémiai és Biokémiai Intézetében dr. Staub Mária útmutatásai és dr. Sasvári Mária segítsége meghatározó jelentőségűek voltak későbbi tudományos pályafutásom során. Az elválasztástudomány alapjaiba dr. Kalász Huba és dr. Nagy János vezettek be, igazi kutatóvá pedig Magyar Kálmán akadémikus mellett váltam. Csaknem két évtizede élek az Amerikai Egyesült Államokban, ahová mint posztdoktori ösztöndíjas dr. Benedek Kálmán ajánlásával kerültem ki. Amerikai pályafutásomat dr. Barry L. Karger laboratóriumában kezdtem, aki a mai napig kitüntető figyelemmel kíséri szakmai fejlődésemet. Közvetlenül az Amerikai Egyesült Államokba érkezésem után volt szerencsém megismerni a Yale Egyetemen Horváth Csaba professzort, az elválasztástudomány egyik megteremtőjét, a HPLC atyját, aki egészen néhány hónappal ezelőtt bekövetkezett hirtelen haláláig segítette tudományos fejlődésemet. Nagy megtiszteltetés, hogy én vezethetem elsőként a róla elnevezett elválasztástudománnyal foglalkozó intézetet Innsbruckban, a Horváth Institute of Bioseparation Science-t. Külön köszönet illeti dr. Günther Bonnt, aki ezen intézet megalapításában nagy segítséget nyújtott. Feltétlen köszönettel tartozom Görög Sándor, Pungor Ernő, Kálmán Alajos, Benedek Pál és Hollósi Miklós akadémikusoknak, akik tudományos pályafutásomat évtizedek óta figyelemmel kísérték és segítették. Hálás köszönetemet fejezem ki dr. Sperling Editnek amerikai kutatási hátterem biztosításáért és dr. Botka Saroltának magyarországi tudományos kapcsolataim ápolásáért. Köszönettel tartozom továbbá dr. Darvas Ferencnek magyarországi utazásaim támogatásáért. 9
10 Végezetül az itt ismertetett kísérleti munkában közvetlenül is résztvevő és segítő munkatársaimnak mondok köszönetet, akik nélkül ez az előadás sem születhetett volna meg. Elsőként Magyarországról vendégprofesszorként: dr. Sasvári-Székely Mária, dr. Rónai Zsolt, dr. Takács László, dr. Chován Tibor, illetve akkor még doktoranduszként: dr. Barta Csaba, dr. Szőke Melinda, dr. Csapó Zsolt, dr. Lengyel Tímea, dr. Gerstner Árpad, látogató és hosszabb-rövidebb időt laboratóriumomban töltő kollégáimnak. Természetesen köszönet illeti amerikai munkatársaimat is: dr. Julia Khandurina, dr. Peter Domaille, dr. Aran Paulus, Mr. Robert Nelson, Mr. Eugene Berdichevsky, dr. Bart Wanders, Ms. Sarah Sandrick, dr. Paul Budworth és dr. Antonius Koller. Irodalomjegyzék Barta, C., Ronai, Z., Nemoda, Z., Szekely, A., Kovacs, E., Sasvari-Szekely, M. and Guttman, A. (2001): Analysis of the Dopamine D4 receptor gene polymorphism using microchip electrophoresis. Journal of Chromatography A., 924, Berdichevsky, Y., Khandurina, J., Guttman, A. and Y. H. Lo (2004): UV/ozone modification of poly(dimethylsiloxane) microfluidics channels. Sensors and Actuators B., 97, Chovan, T. and Guttman, A. (2001): Microfabricated reactor technology. In Integrated microfabricated biodevices. Eds.: Heller, M. and Guttman, A., New York, Marcel Dekker, Chovan, T. and Guttman, A. (2002): Microfabricated devices in biotechnology and chemical processing. Trends in Biotechnology, 20, Cohen, A. S., Najarian, D. R., Paulus, A., Guttman, A., Smith, J. A. and Karger B. L. (1988): Rapid separation and purification of oligonucleotides by high-performance capillary gel electrophoresis. PNAS, Proceedings of the National Academy of Sciences of the United States of America, 85 (24), Darvas, F., Guttman, A. and Dorman, G. (2004): Chemical Genomics. New York, Marcel Dekker. Ganzler, K., Greve, K. S., Cohen, A. S., Karger, B. L., Guttman, A and Cooke, N. C. (1992): High-performance capillary electrophoresis of SDS-protein complexes using UV-transparent polymer networks. Analytical Chemistry, 64 (22), Guttman, A. (1996): High-resolution carbohydrate profiling by capillary gel electrophoresis. Nature (London), 380 (6573), Guttman, A. (2000): Electric field mediated separation of bioplymers on planar glass microchips. In Planar Chromatography. Ed.: Nyiredy, Sz., Budakalász, Res. Inst. Med. Plans., Guttman, A. (2001): Integrated microfabricated device technologies in chromatography. In A century of discovery Eds.: Gehrke, C. W., Wixom, R. L. and Bayer, E., Amsterdam, Elsevier, Guttman, A. (2003): DNA sequencing: from capillaries to microchips. Journal of Chromatography Library, 68 (Emerging Technologies in Protein and Genomic Material Analysis), Guttman, A., Horvath, J. and Cooke, N. (1993): Influence of temperature on the sieving effect of different polymer matrixes in capillary SDS gel electrophoresis of proteins. Analytical Chemistry, 65 (3), Guttman, A. and Khandurina, J. (2003): Microfabricated bioanalytical devices. In Chromatography. Ed.: Heftmann, E., Amsterdam, Elsevier,
11 Guttman, A., Khandurina, J. Ronai, Z., Sasvari-Szekely, M. and Guttman, A. (2003): High throughput genotyping by microhip electrophoresis. Journal of Capillary Electrophoresis, 8, Guttman, M., Fules, P. and Guttman, A. (2003): Rapid analysis of site-directed mutagenesis constructs by capillary gel electrophoresis. Journal of Chromatography A, 1014, Heller, M. and Guttman, A. (2002): Integrated Microfabricated Biodevices. New York, Marcel Dekker. Karger, B. L., Cohen, A. S. and Guttman, A. (1989): High-performance capillary electrophoresis in the biological sciences. Journal of Chromatography, 492, Karger, B. L. and Guttman, A. (2003): Capillary electrophoresis and the human genome project. Genomic and Proteomic Technology, 3 (3), 12, Karger, B. L., Snyder, L. R. and Horváth, Cs. (1973): An Introduction to Separation Science. New York, Wiley-Interscience. Khandurina, J., Chovan, T. and Guttman, A. (2002): Micropreparative fraction collection in microfluidic devices. Analytical Chemistry, 74 (7), Khandurina, J. and Guttman, A. (2002): Bioanalysis in microfluidic devices. Journal of Chromatography A., 943, Khandurina, J. and Guttman, A. (2002): Microchip based high throughput screening analysis of combinatorial libraries. Current Opinion in Chemical Biology, 6, Khandurina, J. and Guttman, A. (2002): Micromachined capillary cross-connector for highprecision fraction collection. Journal of Chromatography A., 979, (1 2), Khandurina, J. and Guttman, A. (2003): Microscale separation and analysis. Current Opinion in Chemical Biology, 7, (5) Khandurina, J., Zhu, T. and Guttman, A. (2003): Microchip based HTS analysis of combinatorial libraries. In Chemical Genomics. Eds.: Darvas, F., Guttman, A. and Dorman, G., New York, Marcel Dekker, Liu, S. and Guttman A. (2004): Electrophoresis microchips for DNA analysis. TrAC, Trends in Analytical Chemistry, 23, Rathore, A. and Guttman, A. (2003): Electrokinetic Phenomena: Principles and Applications in Analytical Chemistry and Microchip Technology. New York, Marcel Dekker. Ronai, Z and Guttman, A. (2000): Analytical and micropreparative capillary gel electrophoresis of DNA fragments. American Laboratory, 32, Ronai, Z., Barta, C. Sasvari-Szekely, M. and Guttman, A. (2001): DNA analysis on electrophoretic microchips: effect of operational variables. Electrophoresis, 22 (2), Rónai Z., Sasvári-Székely M., Chován J. és Guttman A. (2002): Elektroforetikus mikrochipek alkalmazása gyors DNS analízisre. Biokémia, 26,
4.3. Mikrofluidikai csipek analitikai alkalmazásai
 367 4.3. Mikrofluidikai csipek analitikai alkalmazásai 4.3.1. DNS meghatározása A kettős szálú DNS példáján kiválóan demonstrálhatók a mikrofluidikai eszközökön (csip, lab-on-a-chip) elérhető gyors és
367 4.3. Mikrofluidikai csipek analitikai alkalmazásai 4.3.1. DNS meghatározása A kettős szálú DNS példáján kiválóan demonstrálhatók a mikrofluidikai eszközökön (csip, lab-on-a-chip) elérhető gyors és
Áttekintő tartalomjegyzék
 4 Áttekintő tartalomjegyzék Új trendek a kromatográfiában (Gyémánt Gyöngyi, Kurtán Tibor, Lázár István) 5 Új technikák és alkalmazási területek a tömegspektrometriában (Gyémánt Gyöngyi, Kéki Sándor, Kuki
4 Áttekintő tartalomjegyzék Új trendek a kromatográfiában (Gyémánt Gyöngyi, Kurtán Tibor, Lázár István) 5 Új technikák és alkalmazási területek a tömegspektrometriában (Gyémánt Gyöngyi, Kéki Sándor, Kuki
Elektroforetikus mikrochip
 Elektroforetikus mikrochip Összefoglalás Az elektroforetikus mikrochip technika a fehérjék méretének, mennyiségének, tisztaságának egyidejű meghatározására alkalmas, ezért fehérje analitikai és proteomikai
Elektroforetikus mikrochip Összefoglalás Az elektroforetikus mikrochip technika a fehérjék méretének, mennyiségének, tisztaságának egyidejű meghatározására alkalmas, ezért fehérje analitikai és proteomikai
ADATBÁNYÁSZAT I. ÉS OMICS
 Az élettudományi-klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére TÁMOP-4.1.1.C-13/1/KONV-2014-0001 ADATBÁNYÁSZAT
Az élettudományi-klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére TÁMOP-4.1.1.C-13/1/KONV-2014-0001 ADATBÁNYÁSZAT
AZ ELVÁLASZTÁSTECHNIKA KORSZERŰ MÓDSZEREI
 AZ ELVÁLASZTÁSTECHNIKA KORSZERŰ MÓDSZEREI A BIOANALITIKAI LABORGYAKORLAT ELMÉLETI HÁTTERE Készítette az A3 csoport: Kiss Bálint Mezei Pál Dániel Szkiba Ivett Szűcs Rózsa Varga Dániel 2010/2011 TAVASZI
AZ ELVÁLASZTÁSTECHNIKA KORSZERŰ MÓDSZEREI A BIOANALITIKAI LABORGYAKORLAT ELMÉLETI HÁTTERE Készítette az A3 csoport: Kiss Bálint Mezei Pál Dániel Szkiba Ivett Szűcs Rózsa Varga Dániel 2010/2011 TAVASZI
Engedélyszám: 18211-2/2011-EAHUF Verziószám: 1. 2460-06 Humángenetikai vizsgálatok követelménymodul szóbeli vizsgafeladatai
 1. feladat Ismertesse a gyakorlaton lévő szakasszisztens hallgatóknak a PCR termékek elválasztása céljából végzett analitikai agaróz gélelektroforézis során használt puffert! Az ismertetés során az alábbi
1. feladat Ismertesse a gyakorlaton lévő szakasszisztens hallgatóknak a PCR termékek elválasztása céljából végzett analitikai agaróz gélelektroforézis során használt puffert! Az ismertetés során az alábbi
Molekuláris biológiai eljárások alkalmazása a GMO analitikában és az élelmiszerbiztonság területén
 Molekuláris biológiai eljárások alkalmazása a GMO analitikában és az élelmiszerbiztonság területén Dr. Dallmann Klára A molekuláris biológia célja az élőlények és sejtek működésének molekuláris szintű
Molekuláris biológiai eljárások alkalmazása a GMO analitikában és az élelmiszerbiztonság területén Dr. Dallmann Klára A molekuláris biológia célja az élőlények és sejtek működésének molekuláris szintű
Fehérjék elválasztására alkalmazható mikrofludikai rendszerek Bioanalyzer, LabChip rendszerek. A készülékek működési elve, felépítésük, alkalmazásuk.
 Fehérjék elválasztására alkalmazható mikrofludikai rendszerek Bioanalyzer, LabChip rendszerek. A készülékek működési elve, felépítésük, alkalmazásuk. Kapilláris elektroforézis tömegspektrometriás detektálással
Fehérjék elválasztására alkalmazható mikrofludikai rendszerek Bioanalyzer, LabChip rendszerek. A készülékek működési elve, felépítésük, alkalmazásuk. Kapilláris elektroforézis tömegspektrometriás detektálással
Proteomkutatás egy új tudományág születése
 BIOTECHNOLÓGIAI FEJLESZTÉSI POLITIKA, KUTATÁSI IRÁNYOK Proteomkutatás egy új tudományág születése Tárgyszavak: humán genom; genomika; proteomika; kutatás; fehérjeszerkezet; háromdimenziós szerkezet; gyógyszeripar.
BIOTECHNOLÓGIAI FEJLESZTÉSI POLITIKA, KUTATÁSI IRÁNYOK Proteomkutatás egy új tudományág születése Tárgyszavak: humán genom; genomika; proteomika; kutatás; fehérjeszerkezet; háromdimenziós szerkezet; gyógyszeripar.
Doktori (PhD) értekezés tézisei. Olajos Marcell. Dr. Hajós Péter
 FEHÉRJÉK GLIKOZILÁCIÓJÁNAK NYOMON KÖVETÉSE ÉS PEPTIDEK ANALITIKAI ELVÁLASZTÁSÁNAK VIZSGÁLATA KAPILLÁRIS ELEKTROFORETIKUS MÓDSZEREKKEL Doktori (PhD) értekezés tézisei Készítette Olajos Marcell okleveles
FEHÉRJÉK GLIKOZILÁCIÓJÁNAK NYOMON KÖVETÉSE ÉS PEPTIDEK ANALITIKAI ELVÁLASZTÁSÁNAK VIZSGÁLATA KAPILLÁRIS ELEKTROFORETIKUS MÓDSZEREKKEL Doktori (PhD) értekezés tézisei Készítette Olajos Marcell okleveles
DNS-szekvencia meghatározás
 DNS-szekvencia meghatározás Gilbert 1980 (1958) Sanger 3-1 A DNS-polimerázok jellemzői 5'-3' polimeráz aktivitás 5'-3' exonukleáz 3'-5' exonukleáz aktivitás Az új szál szintéziséhez kell: templát DNS primer
DNS-szekvencia meghatározás Gilbert 1980 (1958) Sanger 3-1 A DNS-polimerázok jellemzői 5'-3' polimeráz aktivitás 5'-3' exonukleáz 3'-5' exonukleáz aktivitás Az új szál szintéziséhez kell: templát DNS primer
Nagyhatékonyságú folyadékkromatográfia (HPLC)
 Nagyhatékonyságú folyadékkromatográfia (HPLC) Kromatográfiás módszerek osztályba sorolása 2 Elúciós technika A mintabevitel ún. dugószerűen történik A mozgófázis a kromatogram kifejlesztése alatt folyamatosan
Nagyhatékonyságú folyadékkromatográfia (HPLC) Kromatográfiás módszerek osztályba sorolása 2 Elúciós technika A mintabevitel ún. dugószerűen történik A mozgófázis a kromatogram kifejlesztése alatt folyamatosan
Kapilláris elektroforézis lehetőségei. Szabó Zsófia Országos Gyógyintézeti Központ Immundiagnosztikai Osztály
 Kapilláris elektroforézis lehetőségei Szabó Zsófia Országos Gyógyintézeti Központ Immundiagnosztikai Osztály Elektroforetikus elválasztás alapja: az oldott anyagok elektromos térben különböző sebességgel
Kapilláris elektroforézis lehetőségei Szabó Zsófia Országos Gyógyintézeti Központ Immundiagnosztikai Osztály Elektroforetikus elválasztás alapja: az oldott anyagok elektromos térben különböző sebességgel
DR. FEKETE JENŐ. 1. ábra: Átviteli módok HPLC, GC ill. CE technikák esetén
 KÖRNYEZETI ANALITIKA I. DR. FEKETE JENŐ JEGYZET A 2003/04 ES TANÉV ŐSZI FÉLÉVÉNEK 3. ELŐADÁSÁHOZ. (02. 24) 1. KAPILLÁRIS ELEKTROFORÉZIS (CE) KÉSZÍTETTE: KELEMEN PÉTER, KORDA ANDRÁS A korábbi előadások
KÖRNYEZETI ANALITIKA I. DR. FEKETE JENŐ JEGYZET A 2003/04 ES TANÉV ŐSZI FÉLÉVÉNEK 3. ELŐADÁSÁHOZ. (02. 24) 1. KAPILLÁRIS ELEKTROFORÉZIS (CE) KÉSZÍTETTE: KELEMEN PÉTER, KORDA ANDRÁS A korábbi előadások
Röntgen-gamma spektrometria
 Röntgen-gamma spektrométer fejlesztése radioaktív anyagok elemi összetétele és izotópszelektív radioaktivitása egyidejű meghatározására Szalóki Imre, Gerényi Anita, Radócz Gábor Nukleáris Technikai Intézet
Röntgen-gamma spektrométer fejlesztése radioaktív anyagok elemi összetétele és izotópszelektív radioaktivitása egyidejű meghatározására Szalóki Imre, Gerényi Anita, Radócz Gábor Nukleáris Technikai Intézet
A proteomika új tudománya és alkalmazása a rákdiagnosztikában
 BIOTECHNOLÓGIAI FEJLESZTÉSI POLITIKA, KUTATÁSI IRÁNYOK A proteomika új tudománya és alkalmazása a rákdiagnosztikában Tárgyszavak: proteom; proteomika; rák; diagnosztika; molekuláris gyógyászat; biomarker;
BIOTECHNOLÓGIAI FEJLESZTÉSI POLITIKA, KUTATÁSI IRÁNYOK A proteomika új tudománya és alkalmazása a rákdiagnosztikában Tárgyszavak: proteom; proteomika; rák; diagnosztika; molekuláris gyógyászat; biomarker;
KAPILLÁRIS ELEKTROFORÉZIS. dolgozat az Elválasztási műveletek a biotechnológiai iparokban c. tárgyhoz
 KAPILLÁRIS ELEKTROFORÉZIS dolgozat az Elválasztási műveletek a biotechnológiai iparokban c. tárgyhoz DIENES DÓRA I. ÉVF. PHD HALLGATÓ 1999 Bevezetés - Elektroforézis Az elektroforézis olyan elválasztási
KAPILLÁRIS ELEKTROFORÉZIS dolgozat az Elválasztási műveletek a biotechnológiai iparokban c. tárgyhoz DIENES DÓRA I. ÉVF. PHD HALLGATÓ 1999 Bevezetés - Elektroforézis Az elektroforézis olyan elválasztási
TRIPSZIN TISZTÍTÁSA AFFINITÁS KROMATOGRÁFIA SEGÍTSÉGÉVEL
 TRIPSZIN TISZTÍTÁSA AFFINITÁS KROMATOGRÁFIA SEGÍTSÉGÉVEL Az egyes biomolekulák izolálása kulcsfontosságú a biológiai szerepük tisztázásához. Az affinitás kromatográfia egyszerűsége, reprodukálhatósága
TRIPSZIN TISZTÍTÁSA AFFINITÁS KROMATOGRÁFIA SEGÍTSÉGÉVEL Az egyes biomolekulák izolálása kulcsfontosságú a biológiai szerepük tisztázásához. Az affinitás kromatográfia egyszerűsége, reprodukálhatósága
Bioinformatika előadás
 10. előadás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat Genomika vs. proteomika A genomika módszereivel nem a tényleges fehérjéket vizsgáljuk,
10. előadás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat Genomika vs. proteomika A genomika módszereivel nem a tényleges fehérjéket vizsgáljuk,
Hogyan lesznek új gyógyszereink? Bevezetés a gyógyszerkutatásba
 Hogyan lesznek új gyógyszereink? Bevezetés a gyógyszerkutatásba Keserű György Miklós, PhD, DSc Magyar Tudományos Akadémia Természettudományi Kutatóközpont A gyógyszerkutatás folyamata Megalapozó kutatások
Hogyan lesznek új gyógyszereink? Bevezetés a gyógyszerkutatásba Keserű György Miklós, PhD, DSc Magyar Tudományos Akadémia Természettudományi Kutatóközpont A gyógyszerkutatás folyamata Megalapozó kutatások
10. Hét. Műszeres analitika Elektroforetikus analitikai technikák. Dr. Kállay Csilla (Dr. Andrási Melinda)
 Bioanalitika előadás 10. Hét Műszeres analitika Elektroforetikus analitikai technikák Dr. Kállay Csilla (Dr. Andrási Melinda) Elektroforézis Elektroforézis: Egy oldatban lévő különböző molekulatömegű és
Bioanalitika előadás 10. Hét Műszeres analitika Elektroforetikus analitikai technikák Dr. Kállay Csilla (Dr. Andrási Melinda) Elektroforézis Elektroforézis: Egy oldatban lévő különböző molekulatömegű és
Orvosi Genomtudomány 2014 Medical Genomics 2014. Április 8 Május 22 8th April 22nd May
 Orvosi Genomtudomány 2014 Medical Genomics 2014 Április 8 Május 22 8th April 22nd May Hét / 1st week (9. kalendariumi het) Takács László / Fehér Zsigmond Magyar kurzus Datum/ido Ápr. 8 Apr. 9 10:00 10:45
Orvosi Genomtudomány 2014 Medical Genomics 2014 Április 8 Május 22 8th April 22nd May Hét / 1st week (9. kalendariumi het) Takács László / Fehér Zsigmond Magyar kurzus Datum/ido Ápr. 8 Apr. 9 10:00 10:45
A genomikai oktatás helyzete a Debreceni Egyetemen
 A genomikai oktatás helyzete a Debreceni Egyetemen Bálint Bálint L. GNTP Oktatás és Tudásmenedzsment Munkabizottság, 2009. június 10. Tények Debreceni Egyetemről 21000 nappali és 33000 összes hallgató
A genomikai oktatás helyzete a Debreceni Egyetemen Bálint Bálint L. GNTP Oktatás és Tudásmenedzsment Munkabizottság, 2009. június 10. Tények Debreceni Egyetemről 21000 nappali és 33000 összes hallgató
Korszerű tömegspektrometria a. Szabó Pál MTA Kémiai Kutatóközpont
 Korszerű tömegspektrometria a biokémi miában Szabó Pál MTA Kémiai Kutatóközpont Tematika Bevezetés: ionizációs technikák és analizátorok összehasonlítása a biomolekulák szemszögéből Mikromennyiségek mintaelőkészítése
Korszerű tömegspektrometria a biokémi miában Szabó Pál MTA Kémiai Kutatóközpont Tematika Bevezetés: ionizációs technikák és analizátorok összehasonlítása a biomolekulák szemszögéből Mikromennyiségek mintaelőkészítése
Genomika. Mutációk (SNP-k) és vizsgálatuk egyszerű módszerekkel. DNS szekvenálási eljárások. DNS ujjlenyomat (VNTR)
 Genomika (A genom, génállomány vizsgálata) Mutációk (SNP-k) és vizsgálatuk egyszerű módszerekkel DNS szekvenálási eljárások DNS ujjlenyomat (VNTR) DNS chipek statikus és dinamikus információk vizsgálata
Genomika (A genom, génállomány vizsgálata) Mutációk (SNP-k) és vizsgálatuk egyszerű módszerekkel DNS szekvenálási eljárások DNS ujjlenyomat (VNTR) DNS chipek statikus és dinamikus információk vizsgálata
A fogorvostanhallgatók önálló orvosi kémia és biokémia képzésének kidolgozása
 Az élettudományi- klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére TÁMOP-4.1.1.C-13/1/KONV-2014-0001 A fogorvostanhallgatók
Az élettudományi- klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére TÁMOP-4.1.1.C-13/1/KONV-2014-0001 A fogorvostanhallgatók
Fotódokumentáció. Projektazonosító: KMOP-1.1.1-08/1-2008-0049
 Fotódokumentáció Projektazonosító: KMOP-1.1.1-08/1-2008-0049 Laborkísérletekhez használt reaktorrendszer előkészítése A laborkísérletek elvégzéséhez szükséges volt egy kisméretű FCR (food chain reactor
Fotódokumentáció Projektazonosító: KMOP-1.1.1-08/1-2008-0049 Laborkísérletekhez használt reaktorrendszer előkészítése A laborkísérletek elvégzéséhez szükséges volt egy kisméretű FCR (food chain reactor
mintasepcifikus mikrokapilláris elektroforézis Lab-on-Chip elektroforézis / elektrokinetikus elven DNS, RNS, mirns 12, fehérje 10, sejtes minta 6
 Agilent 2100 Bioanalyzer mikrokapilláris gélelektroforézis rendszer G2943CA 2100 Bioanalyzer system forgalmazó: Kromat Kft. 1112 Budapest Péterhegyi u. 98. t:36 (1) 248-2110 www.kromat.hu bio@kromat.hu
Agilent 2100 Bioanalyzer mikrokapilláris gélelektroforézis rendszer G2943CA 2100 Bioanalyzer system forgalmazó: Kromat Kft. 1112 Budapest Péterhegyi u. 98. t:36 (1) 248-2110 www.kromat.hu bio@kromat.hu
Mangalica specifikus DNS alapú módszer kifejlesztés és validálása a MANGFOOD projekt keretében
 Mangalica specifikus DNS alapú módszer kifejlesztés és validálása a MANGFOOD projekt keretében Szántó-Egész Réka 1, Mohr Anita 1, Sipos Rita 1, Dallmann Klára 1, Ujhelyi Gabriella 2, Koppányné Szabó Erika
Mangalica specifikus DNS alapú módszer kifejlesztés és validálása a MANGFOOD projekt keretében Szántó-Egész Réka 1, Mohr Anita 1, Sipos Rita 1, Dallmann Klára 1, Ujhelyi Gabriella 2, Koppányné Szabó Erika
Biomolekuláris nanotechnológia. Vonderviszt Ferenc PE MÜKKI Bio-Nanorendszerek Laboratórium
 Biomolekuláris nanotechnológia Vonderviszt Ferenc PE MÜKKI Bio-Nanorendszerek Laboratórium Az élő szervezetek példája azt mutatja, hogy a fehérjék és nukleinsavak kiválóan alkalmasak önszerveződő molekuláris
Biomolekuláris nanotechnológia Vonderviszt Ferenc PE MÜKKI Bio-Nanorendszerek Laboratórium Az élő szervezetek példája azt mutatja, hogy a fehérjék és nukleinsavak kiválóan alkalmasak önszerveződő molekuláris
Az áramlási citométer és sejtszorter felépítése és működése, diagnosztikai alkalmazásai
 Az áramlási citométer és sejtszorter felépítése és működése, diagnosztikai alkalmazásai Az áramlási citométer és sejtszorter felépítése és működése Kereskedelmi forgalomban kapható készülékek 1 Fogalmak
Az áramlási citométer és sejtszorter felépítése és működése, diagnosztikai alkalmazásai Az áramlási citométer és sejtszorter felépítése és működése Kereskedelmi forgalomban kapható készülékek 1 Fogalmak
Sztöchiometriai egyenletrendszerek minimális számú aktív változót tartalmazó megoldásainak meghatározása a P-gráf módszertan alkalmazásával
 Sztöchiometriai egyenletrendszerek minimális számú aktív változót tartalmazó megoldásainak meghatározása a P-gráf módszertan alkalmazásával * Pannon Egyetem, M szaki Informatikai Kar, Számítástudomány
Sztöchiometriai egyenletrendszerek minimális számú aktív változót tartalmazó megoldásainak meghatározása a P-gráf módszertan alkalmazásával * Pannon Egyetem, M szaki Informatikai Kar, Számítástudomány
Biotechnológia, egészség- és környezetvédelem. Műegyetem - Kutatóegyetem Biotechnológia, egészség-és környezetvédelem
 Biotechnológia, egészség- és környezetvédelem Kr.e. 6000 Kr.e. 5000 Ereky Károly (1878-1952) A biotechnológia a munkaszervezési tudomány, azaz technológia, élő szervezetekkel, más szóval biotechnológiai
Biotechnológia, egészség- és környezetvédelem Kr.e. 6000 Kr.e. 5000 Ereky Károly (1878-1952) A biotechnológia a munkaszervezési tudomány, azaz technológia, élő szervezetekkel, más szóval biotechnológiai
Bioinformatika 2 10.el
 10.el őadás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat 2009. 04. 24. Genomikavs. proteomika A genomika módszereivel nem a tényleges fehérjéket
10.el őadás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat 2009. 04. 24. Genomikavs. proteomika A genomika módszereivel nem a tényleges fehérjéket
Az elválasztás elméleti alapjai
 Az elválasztás elméleti alapjai Az elválasztás során, a kromatogram kialakulása közben végbemenő folyamatok matematikai leirása bonyolult, ezért azokat teljességgel nem tárgyaljuk. Cél: * megismerni az
Az elválasztás elméleti alapjai Az elválasztás során, a kromatogram kialakulása közben végbemenő folyamatok matematikai leirása bonyolult, ezért azokat teljességgel nem tárgyaljuk. Cél: * megismerni az
Biomassza alapú bioalkohol előállítási technológia fejlesztése metagenomikai eljárással
 Biomassza alapú bioalkohol előállítási technológia fejlesztése metagenomikai eljárással Kovács Zoltán ügyvezető DEKUT Debreceni Kutatásfejlesztési Közhasznú Nonprofit Kft. Problémadefiníció Első generációs
Biomassza alapú bioalkohol előállítási technológia fejlesztése metagenomikai eljárással Kovács Zoltán ügyvezető DEKUT Debreceni Kutatásfejlesztési Közhasznú Nonprofit Kft. Problémadefiníció Első generációs
JASCO FTIR KIEGÉSZÍTŐK - NE CSAK MÉRJ, LÁSS IS!
 JASCO FTIR KIEGÉSZÍTŐK - NE CSAK MÉRJ, LÁSS IS! Szakács Tibor, Szepesi Ildikó ABL&E-JASCO Magyarország Kft. 1116 Budapest, Fehérvári út 132-144. ablehun@ablelab.com www.ablelab.com JASCO SPEKTROSZKÓPIA
JASCO FTIR KIEGÉSZÍTŐK - NE CSAK MÉRJ, LÁSS IS! Szakács Tibor, Szepesi Ildikó ABL&E-JASCO Magyarország Kft. 1116 Budapest, Fehérvári út 132-144. ablehun@ablelab.com www.ablelab.com JASCO SPEKTROSZKÓPIA
A Kémiai Laboratórium feladata
 A Kémiai Laboratórium feladata Az új mérőeszközök felhasználási lehetőségei a gyakorlatban 2. Előadó: Csiki Tímea osztályvezető Nemzeti Munkaügyi Hivatal Munkaügyi és Munkavédelmi Igazgatóság Munkahigiénés
A Kémiai Laboratórium feladata Az új mérőeszközök felhasználási lehetőségei a gyakorlatban 2. Előadó: Csiki Tímea osztályvezető Nemzeti Munkaügyi Hivatal Munkaügyi és Munkavédelmi Igazgatóság Munkahigiénés
Kromatográfiás módszerek
 Kromatográfiás módszerek Mi a kromatográfia? Kromatográfia ugyanazon az elven működik, mint az extrakció, csak az egyik fázis rögzített ( állófázis ) és a másik elhalad mellette ( mozgófázis ). Az elválasztást
Kromatográfiás módszerek Mi a kromatográfia? Kromatográfia ugyanazon az elven működik, mint az extrakció, csak az egyik fázis rögzített ( állófázis ) és a másik elhalad mellette ( mozgófázis ). Az elválasztást
SZTE-ELTE PROTEOMIKAI INNOVÁCIÓ: KONCEPCIÓ, EREDMÉNYEK, JÖVŐKÉP
 SZTE-ELTE PROTEOMIKAI INNOVÁCIÓ: KONCEPCIÓ, EREDMÉNYEK, JÖVŐKÉP Minden elméletet úgy is meg lehet alkotni, hogy az általa sugallt kísérletek csak magát az elméletet erősítsék meg Konrad Lorenz A SEJTMŰKÖDÉS
SZTE-ELTE PROTEOMIKAI INNOVÁCIÓ: KONCEPCIÓ, EREDMÉNYEK, JÖVŐKÉP Minden elméletet úgy is meg lehet alkotni, hogy az általa sugallt kísérletek csak magát az elméletet erősítsék meg Konrad Lorenz A SEJTMŰKÖDÉS
Kromatográfia Bevezetés. Anyagszerkezet vizsgálati módszerek
 Kromatográfia Bevezetés Anyagszerkezet vizsgálati módszerek Pannon Egyetem Mérnöki Kar Anyagszerkezet vizsgálati módszerek Kromatográfia 1/ 37 Analitikai kémia kihívása Hagyományos módszerek Anyagszerkezet
Kromatográfia Bevezetés Anyagszerkezet vizsgálati módszerek Pannon Egyetem Mérnöki Kar Anyagszerkezet vizsgálati módszerek Kromatográfia 1/ 37 Analitikai kémia kihívása Hagyományos módszerek Anyagszerkezet
Diagnosztikai célú molekuláris biológiai vizsgálatok
 Diagnosztikai célú molekuláris biológiai vizsgálatok Dr. Patócs Attila, PhD MTA-SE Molekuláris Medicina Kutatócsoport, Semmelweis Egyetem II. sz. Belgyógyászati Klinika Laboratóriumi Medicina Intézet Genetikai
Diagnosztikai célú molekuláris biológiai vizsgálatok Dr. Patócs Attila, PhD MTA-SE Molekuláris Medicina Kutatócsoport, Semmelweis Egyetem II. sz. Belgyógyászati Klinika Laboratóriumi Medicina Intézet Genetikai
Élelmiszerek. mikroszennyezőinek. inek DR. EKE ZSUZSANNA. Elválasztástechnikai Kutató és Oktató Laboratórium. ALKÍMIA MA november 5.
 Élelmiszerek mikroszennyezőinek inek nyomában DR. EKE ZSUZSANNA Elválasztástechnikai Kutató és ktató Laboratórium ALKÍMIA MA 2009. november 5. Kémiai veszélyt lytényezők Természetesen előforduló mérgek
Élelmiszerek mikroszennyezőinek inek nyomában DR. EKE ZSUZSANNA Elválasztástechnikai Kutató és ktató Laboratórium ALKÍMIA MA 2009. november 5. Kémiai veszélyt lytényezők Természetesen előforduló mérgek
Abszorpciós spektroszkópia
 Tartalomjegyzék Abszorpciós spektroszkópia (Nyitrai Miklós; 2011 február 1.) Dolgozat: május 3. 18:00-20:00. Egész éves anyag. Korábbi dolgozatok nem számítanak bele. Felmentés 80% felett. A fény; Elektromágneses
Tartalomjegyzék Abszorpciós spektroszkópia (Nyitrai Miklós; 2011 február 1.) Dolgozat: május 3. 18:00-20:00. Egész éves anyag. Korábbi dolgozatok nem számítanak bele. Felmentés 80% felett. A fény; Elektromágneses
ATOMEMISSZIÓS SPEKTROSZKÓPIA
 ATOMEMISSZIÓS SPEKTROSZKÓPIA Elvi jellemzők, amelyek meghatározzák a készülék felépítését magas hőmérsékletű fényforrás (elsősorban plazma, szikra, stb.) kis méretű sugárforrás (az önabszorpció csökkentése
ATOMEMISSZIÓS SPEKTROSZKÓPIA Elvi jellemzők, amelyek meghatározzák a készülék felépítését magas hőmérsékletű fényforrás (elsősorban plazma, szikra, stb.) kis méretű sugárforrás (az önabszorpció csökkentése
Lab-on-a-chip technika alkalmazása búzafehérje vizsgálatokban
 Lab-on-a-chip technika alkalmazása búzafehérje vizsgálatokban Balázs Gábor, Nádosi Márta és Tömösközi Sándor Budapesti Műszaki és Gazdaságtudományi Egyetem Alkalmazott Biotechnológiai és Élelmiszertudományi
Lab-on-a-chip technika alkalmazása búzafehérje vizsgálatokban Balázs Gábor, Nádosi Márta és Tömösközi Sándor Budapesti Műszaki és Gazdaságtudományi Egyetem Alkalmazott Biotechnológiai és Élelmiszertudományi
Kvalitatív elemzésen alapuló reakciómechanizmus meghatározás
 Kvalitatív elemzésen alapuló reakciómechanizmus meghatározás Varga Tamás Pannon Egyetem, Folyamatmérnöki Intézeti Tanszék IX. Alkalmazott Informatika Konferencia ~ AIK 2011 ~ Kaposvár, Február 25. Tartalom
Kvalitatív elemzésen alapuló reakciómechanizmus meghatározás Varga Tamás Pannon Egyetem, Folyamatmérnöki Intézeti Tanszék IX. Alkalmazott Informatika Konferencia ~ AIK 2011 ~ Kaposvár, Február 25. Tartalom
9. Hét. Műszeres analitika Folyadékkromatográfia Ionkromatográfia Gélkromatográfia Affinitás kromatográfia Gázkromatográfia. Dr.
 Bioanalitika előadás 9. Hét Műszeres analitika Folyadékkromatográfia Ionkromatográfia Gélkromatográfia Affinitás kromatográfia Gázkromatográfia Dr. Andrási Melinda Kromatográfia Nagy hatékonyságú, dinamikus
Bioanalitika előadás 9. Hét Műszeres analitika Folyadékkromatográfia Ionkromatográfia Gélkromatográfia Affinitás kromatográfia Gázkromatográfia Dr. Andrási Melinda Kromatográfia Nagy hatékonyságú, dinamikus
Humán genom variációk single nucleotide polymorphism (SNP)
 Humán genom variációk single nucleotide polymorphism (SNP) A genom ~ 97 %-a két különböző egyedben teljesen azonos ~ 1% különbség: SNP miatt ~2% különbség: kópiaszámbeli eltérés, deléciók miatt 11-12 millió
Humán genom variációk single nucleotide polymorphism (SNP) A genom ~ 97 %-a két különböző egyedben teljesen azonos ~ 1% különbség: SNP miatt ~2% különbség: kópiaszámbeli eltérés, deléciók miatt 11-12 millió
Rövid ismertető. Modern mikroszkópiai módszerek. A mikroszkóp. A mikroszkóp. Az optikai mikroszkópia áttekintése
 Rövid ismertető Modern mikroszkópiai módszerek Nyitrai Miklós 2010. március 16. A mikroszkópok csoportosítása Alapok, ismeretek A működési elvek Speciális módszerek A mikroszkópia története ld. Pdf. Minél
Rövid ismertető Modern mikroszkópiai módszerek Nyitrai Miklós 2010. március 16. A mikroszkópok csoportosítása Alapok, ismeretek A működési elvek Speciális módszerek A mikroszkópia története ld. Pdf. Minél
A PET szerepe a gyógyszerfejlesztésben. Berecz Roland DE KK Pszichiátriai Tanszék
 A PET szerepe a gyógyszerfejlesztésben Berecz Roland DE KK Pszichiátriai Tanszék Gyógyszerfejlesztés Felfedezés gyógyszertár : 10-15 év Kb. 1 millárd USD/gyógyszer (beleszámolva a sikertelen fejlesztéseket)
A PET szerepe a gyógyszerfejlesztésben Berecz Roland DE KK Pszichiátriai Tanszék Gyógyszerfejlesztés Felfedezés gyógyszertár : 10-15 év Kb. 1 millárd USD/gyógyszer (beleszámolva a sikertelen fejlesztéseket)
Orvosi diagnosztika tenyérnyi eszközökön
 Iván Kristóf Orvosi diagnosztika tenyérnyi eszközökön Budai Ciszterci Szent Imre Gimnázium Budapest, 2013. január 6. www.meetthescientist.hu 1 26 Diagnosztikai eszközök : Laboratórium egy chipen! (Massachusetts
Iván Kristóf Orvosi diagnosztika tenyérnyi eszközökön Budai Ciszterci Szent Imre Gimnázium Budapest, 2013. január 6. www.meetthescientist.hu 1 26 Diagnosztikai eszközök : Laboratórium egy chipen! (Massachusetts
A Magyar Biokémiai Egyesület tájékoztatója Quarterly Bulletin of the Hungarian Biochemical Society
 BIOKÉMIA A Magyar Biokémiai Egyesület tájékoztatója Quarterly Bulletin of the Hungarian Biochemical Society Szerkesztôbizottság: ALKONYI ISTVÁN, BÁNFALVI GÁSPÁR, ELÔDI PÁL, FALUS ANDRÁS, FÉSÜS LÁSZLÓ,
BIOKÉMIA A Magyar Biokémiai Egyesület tájékoztatója Quarterly Bulletin of the Hungarian Biochemical Society Szerkesztôbizottság: ALKONYI ISTVÁN, BÁNFALVI GÁSPÁR, ELÔDI PÁL, FALUS ANDRÁS, FÉSÜS LÁSZLÓ,
Felhő használata mindennapi alkalmazások futtatására. Németh Zsolt MTA SZTAKI
 Felhő használata mindennapi alkalmazások futtatására Németh Zsolt MTA SZTAKI Legyőzni a maláriát 45 másodpercenként meghal egy gyerek maláriában Évente 216 millió ember fertőződik meg és 650000 meghal
Felhő használata mindennapi alkalmazások futtatására Németh Zsolt MTA SZTAKI Legyőzni a maláriát 45 másodpercenként meghal egy gyerek maláriában Évente 216 millió ember fertőződik meg és 650000 meghal
Genomadatbázisok Ld. Entrez Genome: Összes ismert genom, hierarchikus szervezésben (kromoszóma, térképek, gének, stb.)
 Genomika Új korszak, paradigmaváltás, forradalom: a teljes genomok ismeretében a biológia adatokban gazdag tudománnyá válik. Új kutatási módszerek, új szemlélet. Hajtóerõk: Genomszekvenálási projektek
Genomika Új korszak, paradigmaváltás, forradalom: a teljes genomok ismeretében a biológia adatokban gazdag tudománnyá válik. Új kutatási módszerek, új szemlélet. Hajtóerõk: Genomszekvenálási projektek
Radionuklidok meghatározása környezeti mintákban induktív csatolású plazma tömegspektrometria segítségével lehetőségek és korlátok
 Radionuklidok meghatározása környezeti mintákban induktív csatolású plazma tömegspektrometria segítségével lehetőségek és korlátok Stefánka Zsolt, Varga Zsolt, Széles Éva MTA Izotópkutató Intézet 1121
Radionuklidok meghatározása környezeti mintákban induktív csatolású plazma tömegspektrometria segítségével lehetőségek és korlátok Stefánka Zsolt, Varga Zsolt, Széles Éva MTA Izotópkutató Intézet 1121
Baranyáné Dr. Ganzler Katalin Osztályvezető
 Budapesti Műszaki és Gazdaságtudományi Egyetem Biokémiai és Élelmiszertechnológiai Tanszék Kapilláris elektroforézis alkalmazása búzafehérjék érésdinamikai és fajtaazonosítási vizsgálataira c. PhD értekezés
Budapesti Műszaki és Gazdaságtudományi Egyetem Biokémiai és Élelmiszertechnológiai Tanszék Kapilláris elektroforézis alkalmazása búzafehérjék érésdinamikai és fajtaazonosítási vizsgálataira c. PhD értekezés
Németh Anikó 1,2, Kosáry Judit 1, Fodor Péter 1, Dernovics Mihály 1
 Németh Anikó 1,2, Kosáry Judit 1, Fodor Péter 1, Dernovics Mihály 1 1 Budapesti Corvinus Egyetem Élelmiszertudomány Kar, Alkalmazott Kémia Tanszék 2 Wessling Hungary Kft., Élelmiszervizsgáló Laboratórium
Németh Anikó 1,2, Kosáry Judit 1, Fodor Péter 1, Dernovics Mihály 1 1 Budapesti Corvinus Egyetem Élelmiszertudomány Kar, Alkalmazott Kémia Tanszék 2 Wessling Hungary Kft., Élelmiszervizsgáló Laboratórium
A TÖMEGSPEKTROMETRIA ALAPJAI
 A TÖMEGSPEKTROMETRIA ALAPJAI web.inc.bme.hu/csonka/csg/oktat/tomegsp.doc alapján tömeg-töltés arány szerinti szétválasztás a legérzékenyebb módszerek közé tartozik (Nagyon kis anyagmennyiség kimutatására
A TÖMEGSPEKTROMETRIA ALAPJAI web.inc.bme.hu/csonka/csg/oktat/tomegsp.doc alapján tömeg-töltés arány szerinti szétválasztás a legérzékenyebb módszerek közé tartozik (Nagyon kis anyagmennyiség kimutatására
E (total) = E (translational) + E (rotation) + E (vibration) + E (electronic) + E (electronic
 Abszorpciós spektroszkópia Abszorpciós spektrofotometria 29.2.2. Az abszorpciós spektroszkópia a fényabszorpció jelenségét használja fel híg oldatok minőségi és mennyiségi vizsgálatára. Abszorpció Az elektromágneses
Abszorpciós spektroszkópia Abszorpciós spektrofotometria 29.2.2. Az abszorpciós spektroszkópia a fényabszorpció jelenségét használja fel híg oldatok minőségi és mennyiségi vizsgálatára. Abszorpció Az elektromágneses
Genetikai panel kialakítása a hazai tejhasznú szarvasmarha állományok hasznos élettartamának növelésére
 Genetikai panel kialakítása a hazai tejhasznú szarvasmarha állományok hasznos élettartamának növelésére Dr. Czeglédi Levente Dr. Béri Béla Kutatás-fejlesztés támogatása a megújuló energiaforrások és agrár
Genetikai panel kialakítása a hazai tejhasznú szarvasmarha állományok hasznos élettartamának növelésére Dr. Czeglédi Levente Dr. Béri Béla Kutatás-fejlesztés támogatása a megújuló energiaforrások és agrár
Genomikai Medicina és Ritka Betegségek Intézete Semmelweis Egyetem
 Tisztelt Hölgyem, Tisztelt Uram! Örömmel jelentjük be Önöknek, hogy a Genomikai Medicina és Ritka Betegségek Intézetének egyik új projektje azon betegségek genetikai hátterének feltérképezésére irányul,
Tisztelt Hölgyem, Tisztelt Uram! Örömmel jelentjük be Önöknek, hogy a Genomikai Medicina és Ritka Betegségek Intézetének egyik új projektje azon betegségek genetikai hátterének feltérképezésére irányul,
A bioinformatika gyökerei
 A bioinformatika gyökerei 1944: Avery a transforming principle a DNS 1952: Hershey és Chase perdöntő bizonyíték: a bakteriofágok szaporodásakor csak a DNS jut be a sejtbe 1953: Watson és Crick a DNS szerkezete
A bioinformatika gyökerei 1944: Avery a transforming principle a DNS 1952: Hershey és Chase perdöntő bizonyíték: a bakteriofágok szaporodásakor csak a DNS jut be a sejtbe 1953: Watson és Crick a DNS szerkezete
VÍZGŐZKONCENTRÁCIÓ-MÉRÉS DIÓDALÉZERES FOTOAKUSZTIKUS MÓDSZERREL
 VÍZGŐZKONCENTRÁCIÓ-MÉRÉS DIÓDALÉZERES FOTOAKUSZTIKUS MÓDSZERREL BOZÓKI ZOLTÁN, MOHÁCSI ÁRPÁD, SZAKÁLL MIKLÓS, FARKAS ZSUZSA, VERES ANIKÓ, SZABÓ GÁBOR, BOR ZSOLT Szegedi Tudományegyetem Optikai és Kvantum
VÍZGŐZKONCENTRÁCIÓ-MÉRÉS DIÓDALÉZERES FOTOAKUSZTIKUS MÓDSZERREL BOZÓKI ZOLTÁN, MOHÁCSI ÁRPÁD, SZAKÁLL MIKLÓS, FARKAS ZSUZSA, VERES ANIKÓ, SZABÓ GÁBOR, BOR ZSOLT Szegedi Tudományegyetem Optikai és Kvantum
Peptidek LC-MS/MS karakterisztikájának javítása fluoros kémiai módosítással, proteomikai alkalmazásokhoz
 Peptidek LC-MS/MS karakterisztikájának javítása fluoros kémiai módosítással, proteomikai alkalmazásokhoz Dr. Schlosser Gitta tudományos munkatárs MTA-ELTE Peptidkémiai Kutatócsoport MedInProt Tavaszi Konferencia
Peptidek LC-MS/MS karakterisztikájának javítása fluoros kémiai módosítással, proteomikai alkalmazásokhoz Dr. Schlosser Gitta tudományos munkatárs MTA-ELTE Peptidkémiai Kutatócsoport MedInProt Tavaszi Konferencia
SOLiD Technology. library preparation & Sequencing Chemistry (sequencing by ligation!) Imaging and analysis. Application specific sample preparation
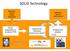 SOLiD Technology Application specific sample preparation Application specific data analysis library preparation & emulsion PCR Sequencing Chemistry (sequencing by ligation!) Imaging and analysis SOLiD
SOLiD Technology Application specific sample preparation Application specific data analysis library preparation & emulsion PCR Sequencing Chemistry (sequencing by ligation!) Imaging and analysis SOLiD
Abszorpciós fotometria
 abszorpció Abszorpciós fotometria Spektroszkópia - Színképvizsgálat Spektro-: görög; jelente kép/szín -szkópia: görög; néz/látás/vizsgálat Ujfalusi Zoltán PTE ÁOK Biofizikai Intézet 2012. február Vizsgálatok
abszorpció Abszorpciós fotometria Spektroszkópia - Színképvizsgálat Spektro-: görög; jelente kép/szín -szkópia: görög; néz/látás/vizsgálat Ujfalusi Zoltán PTE ÁOK Biofizikai Intézet 2012. február Vizsgálatok
PhD DISSZERTÁCIÓ TÉZISEI
 Budapesti Muszaki és Gazdaságtudományi Egyetem Fizikai Kémia Tanszék MTA-BME Lágy Anyagok Laboratóriuma PhD DISSZERTÁCIÓ TÉZISEI Mágneses tér hatása kompozit gélek és elasztomerek rugalmasságára Készítette:
Budapesti Muszaki és Gazdaságtudományi Egyetem Fizikai Kémia Tanszék MTA-BME Lágy Anyagok Laboratóriuma PhD DISSZERTÁCIÓ TÉZISEI Mágneses tér hatása kompozit gélek és elasztomerek rugalmasságára Készítette:
GLUCAGONUM HUMANUM. Humán glükagon
 01/2008:1635 GLUCAGONUM HUMANUM Humán glükagon C 153 H 225 N 43 O 49 S M r 3483 DEFINÍCIÓ A humán glükagon 29 aminosavból álló polipeptid; szerkezete megegyezik az emberi hasnyálmirígy α-sejtjei által
01/2008:1635 GLUCAGONUM HUMANUM Humán glükagon C 153 H 225 N 43 O 49 S M r 3483 DEFINÍCIÓ A humán glükagon 29 aminosavból álló polipeptid; szerkezete megegyezik az emberi hasnyálmirígy α-sejtjei által
Az SZTE KDI képzési terve
 Az SZTE KDI képzési terve Doktori képzési/kutatási programok: 1. Analitikai kémia 2. Bioorganikus kémia 3. Elméleti kémia 4. Fizikai Kémia 5. Katalízis, kolloidika, felület- és anyagtudomány 6. Komplex
Az SZTE KDI képzési terve Doktori képzési/kutatási programok: 1. Analitikai kémia 2. Bioorganikus kémia 3. Elméleti kémia 4. Fizikai Kémia 5. Katalízis, kolloidika, felület- és anyagtudomány 6. Komplex
Immunológiai módszerek a klinikai kutatásban
 Immunológiai módszerek a klinikai kutatásban 8. előadás Immunszerológia, immunkémia Az immunoassay-k érzékenysége A fő szérumfehérje frakciók és az ahhoz tartozó fehérjék Az Ig valencia és aviditás viszonya
Immunológiai módszerek a klinikai kutatásban 8. előadás Immunszerológia, immunkémia Az immunoassay-k érzékenysége A fő szérumfehérje frakciók és az ahhoz tartozó fehérjék Az Ig valencia és aviditás viszonya
Szedimentáció, Biofizika szeminárium 2. szemeszter
 Szedimentáció, Elektroforézis Biofizika szeminárium 2. szemeszter Makromolekulák analízise és elválasztása Szedimentáció Szedimentáció Miért van szükség centrifugálásra? A nehézségi erőtérben való ülepítés
Szedimentáció, Elektroforézis Biofizika szeminárium 2. szemeszter Makromolekulák analízise és elválasztása Szedimentáció Szedimentáció Miért van szükség centrifugálásra? A nehézségi erőtérben való ülepítés
3/11/2015 SZEDIMENTÁCIÓ ELEKTROFORÉZIS. Szedimentáció, elektroforézis. Alkalmazások hematológia - vér frakcionálása
 PÉCSI TUDOMÁNYEGYETEM ÁLTALÁNOS ORVOSTUDOMÁNYI KAR hematológia - vér frakcionálása Példa: teljes vérkép www.aok.pte.hu SZÉTVÁLASZTÁSI MÓDSZEREK: SZEDIMENTÁCIÓ ELEKTROFORÉZIS vérplazma (55 %) BIOFIZIKA
PÉCSI TUDOMÁNYEGYETEM ÁLTALÁNOS ORVOSTUDOMÁNYI KAR hematológia - vér frakcionálása Példa: teljes vérkép www.aok.pte.hu SZÉTVÁLASZTÁSI MÓDSZEREK: SZEDIMENTÁCIÓ ELEKTROFORÉZIS vérplazma (55 %) BIOFIZIKA
Környezetvédelmi analitika II. (BMEVESAM108) Immunanalitika, Lab-on-a-chip
 Környezetvédelmi analitika II. (BMEVESAM108) Immunanalitika, Lab-on-a-chip Helyszín: Ch 1.emelet 106. Gyakorlatvezetők: Hajas Lívia és Török Kitti Email: ktorok@mail.bme.hu Lab-on-a-chip (LOC) technika
Környezetvédelmi analitika II. (BMEVESAM108) Immunanalitika, Lab-on-a-chip Helyszín: Ch 1.emelet 106. Gyakorlatvezetők: Hajas Lívia és Török Kitti Email: ktorok@mail.bme.hu Lab-on-a-chip (LOC) technika
Anyagszerkezet vizsgálati módszerek
 Kromatográfia Folyadékkromatográfia-tömegspektrometria Anyagszerkezet vizsgálati módszerek Pannon Egyetem Mérnöki Kar Anyagszerkezet vizsgálati módszerek Kromatográfia 1/ 25 Folyadékkromatográfia-tömegspektrometria
Kromatográfia Folyadékkromatográfia-tömegspektrometria Anyagszerkezet vizsgálati módszerek Pannon Egyetem Mérnöki Kar Anyagszerkezet vizsgálati módszerek Kromatográfia 1/ 25 Folyadékkromatográfia-tömegspektrometria
Új temékek az UD- GenoMed Kft. kínálatában!
 Új temékek az UD- GenoMed Kft. kínálatában! Szolgáltatásaink: Medical Genomic Technologies Kft. Betegtoborzás és biobanking Bioinformatika o Adatelemzés/adatbányászás o Integrált adatbázis készítés Sejtvonal
Új temékek az UD- GenoMed Kft. kínálatában! Szolgáltatásaink: Medical Genomic Technologies Kft. Betegtoborzás és biobanking Bioinformatika o Adatelemzés/adatbányászás o Integrált adatbázis készítés Sejtvonal
Endogén szteroidprofil vizsgálata folyadékkromatográfiával és tandem tömegspektrométerrel. Karvaly Gellért
 Endogén szteroidprofil vizsgálata folyadékkromatográfiával és tandem tömegspektrométerrel Karvaly Gellért Miért hasznos a vegyületprofilok vizsgálata? 1 mintából, kis mintatérfogatból, gyorsan nyerhető
Endogén szteroidprofil vizsgálata folyadékkromatográfiával és tandem tömegspektrométerrel Karvaly Gellért Miért hasznos a vegyületprofilok vizsgálata? 1 mintából, kis mintatérfogatból, gyorsan nyerhető
1. A megyében végzett jelentősebb kutatási témák, projektek ráfordításainak ágazati megoszlása (összesen 4 859 millió Ft-ról áll rendelkezésre adat):
 Megyei statisztikai profil a Smart Specialisation Strategy (S3) megalapozásához c. dokumentum kiegészítése a Magyar Tudományos Akadémia adataival Csongrád megye Az alábbi dokumentum a Smart Specialisation
Megyei statisztikai profil a Smart Specialisation Strategy (S3) megalapozásához c. dokumentum kiegészítése a Magyar Tudományos Akadémia adataival Csongrád megye Az alábbi dokumentum a Smart Specialisation
MEDINPROT Gépidő Pályázat támogatásával elért eredmények
 A kisszögű röntgenszórási módszer fejlesztése fehérjék oldatfázisú mérésére Bóta Attila, Wacha András, Varga Zoltán MTA TTK Biológiai Nanokémia Kutatócsoport 1117 Bp. Magyar Tudósok krt. 2. MEDINPROT Gépidő
A kisszögű röntgenszórási módszer fejlesztése fehérjék oldatfázisú mérésére Bóta Attila, Wacha András, Varga Zoltán MTA TTK Biológiai Nanokémia Kutatócsoport 1117 Bp. Magyar Tudósok krt. 2. MEDINPROT Gépidő
Gamma-röntgen spektrométer és eljárás kifejlesztése anyagok elemi összetétele és izotópszelektív radioaktivitása egyidejű elemzésére
 Gamma-röntgen spektrométer és eljárás kifejlesztése anyagok elemi összetétele és izotópszelektív radioaktivitása egyidejű elemzésére OAH-ABA-23/16-M Dr. Szalóki Imre, fizikus, egyetemi docens Radócz Gábor,
Gamma-röntgen spektrométer és eljárás kifejlesztése anyagok elemi összetétele és izotópszelektív radioaktivitása egyidejű elemzésére OAH-ABA-23/16-M Dr. Szalóki Imre, fizikus, egyetemi docens Radócz Gábor,
A műanyag csomagolóanyagok nem szándékosan hozzáadott összetevőinek kioldódásvizsgálata
 Budapest, 2017.04.26. A műanyag csomagolóanyagok nem szándékosan hozzáadott összetevőinek kioldódásvizsgálata Kosdi Bence WESSLING Hungary Kft. Amiről szó lesz A vizsgálat áttekintése Analitikai módszer
Budapest, 2017.04.26. A műanyag csomagolóanyagok nem szándékosan hozzáadott összetevőinek kioldódásvizsgálata Kosdi Bence WESSLING Hungary Kft. Amiről szó lesz A vizsgálat áttekintése Analitikai módszer
ELEKTROFORÉZIS TECHNIKÁK
 11. fejezet ELEKTROFORÉZIS TECHNIKÁK ELEKTROFORÉZIS Olyan elválasztási technikák, amelyben a molekulák elektromos erőtér hatására különbözőképpen mozdulnak el, és ezáltal szétválaszthatók. Dr. Pécs Miklós
11. fejezet ELEKTROFORÉZIS TECHNIKÁK ELEKTROFORÉZIS Olyan elválasztási technikák, amelyben a molekulák elektromos erőtér hatására különbözőképpen mozdulnak el, és ezáltal szétválaszthatók. Dr. Pécs Miklós
Sugárzáson, és infravörös sugárzáson alapuló hőmérséklet mérés.
 Sugárzáson, és infravörös sugárzáson alapuló hőmérséklet mérés. A sugárzáson alapuló hőmérsékletmérés (termográfia),azt a fizikai jelenséget használja fel, hogy az abszolút nulla K hőmérséklet (273,16
Sugárzáson, és infravörös sugárzáson alapuló hőmérséklet mérés. A sugárzáson alapuló hőmérsékletmérés (termográfia),azt a fizikai jelenséget használja fel, hogy az abszolút nulla K hőmérséklet (273,16
Gyakorlati Forduló Válaszlap Fizika, Kémia, Biológia
 Gyakorlati Forduló Válaszlap Fizika, Kémia, Biológia Töltsd ki az alábbiakat! A DIÁKOK NEVEI: CSOPORT JELE: ORSZÁG: ALÁÍRÁSOK: 1 Milyen változás(oka)t figyeltetek meg az alkoholnak a DNS-oldathoz adása
Gyakorlati Forduló Válaszlap Fizika, Kémia, Biológia Töltsd ki az alábbiakat! A DIÁKOK NEVEI: CSOPORT JELE: ORSZÁG: ALÁÍRÁSOK: 1 Milyen változás(oka)t figyeltetek meg az alkoholnak a DNS-oldathoz adása
Hagyományos HPLC. Powerpoint Templates Page 1
 Hagyományos HPLC Page 1 Elválasztás sík és térbeli ábrázolása Page 2 Elválasztás elvi megoldásai 3 kromatográfiás technika: frontális kiszorításos elúciós Page 3 Kiszorításos technika minta diszkrét mennyisége
Hagyományos HPLC Page 1 Elválasztás sík és térbeli ábrázolása Page 2 Elválasztás elvi megoldásai 3 kromatográfiás technika: frontális kiszorításos elúciós Page 3 Kiszorításos technika minta diszkrét mennyisége
CLOXACILLINUM NATRICUM. Kloxacillin-nátrium
 Cloxacillinum natricum Ph.Hg.VIII. Ph.Eur.5.7-1 04/2007:0661 CLOXACILLINUM NATRICUM Kloxacillin-nátrium C 19 H 17 ClN 3 NaO 5 S.H 2 O M r 475,9 DEFINÍCIÓ Nátrium-[(2S,5R,6R)-6-[[[3-(2-klórfenil)-5-metilizoxazol-4-il]karbonil]amino]-
Cloxacillinum natricum Ph.Hg.VIII. Ph.Eur.5.7-1 04/2007:0661 CLOXACILLINUM NATRICUM Kloxacillin-nátrium C 19 H 17 ClN 3 NaO 5 S.H 2 O M r 475,9 DEFINÍCIÓ Nátrium-[(2S,5R,6R)-6-[[[3-(2-klórfenil)-5-metilizoxazol-4-il]karbonil]amino]-
10. Genomika 2. Microarrayek és típusaik
 10. Genomika 2. 1. Microarray technikák és bioinformatikai vonatkozásaik Microarrayek és típusaik Korrelált génexpresszió mint a funkcionális genomika eszköze 2. Kombinált megközelítés a funkcionális genomikában
10. Genomika 2. 1. Microarray technikák és bioinformatikai vonatkozásaik Microarrayek és típusaik Korrelált génexpresszió mint a funkcionális genomika eszköze 2. Kombinált megközelítés a funkcionális genomikában
Továbbadása, sokszorosítása írásos engedélyhez kötött.
 PÉCSI TUDOMÁNYEGYETEM MINTA VÉTELE VIZELET VIZSGÁLATÁHOZ FELHASZNÁLÓI KÉZIKÖNYV 2. MELLÉKLETE Készítette: A dokumentum kódja: Lamár Ibolya 2012. április 10. Kiadás száma: Változat száma: 2 2 Ellenőrizte:
PÉCSI TUDOMÁNYEGYETEM MINTA VÉTELE VIZELET VIZSGÁLATÁHOZ FELHASZNÁLÓI KÉZIKÖNYV 2. MELLÉKLETE Készítette: A dokumentum kódja: Lamár Ibolya 2012. április 10. Kiadás száma: Változat száma: 2 2 Ellenőrizte:
Közvetlen ionizációs tömegspektrometriás módszerek fejlesztése Biomedicinális alkalmazások
 Közvetlen ionizációs tömegspektrometriás módszerek fejlesztése Biomedicinális alkalmazások Doktori értekezés tézisei Dénes Júlia Eötvös Loránd Tudományegyetem, Természettudományi Kar, Kémia Doktori Iskola
Közvetlen ionizációs tömegspektrometriás módszerek fejlesztése Biomedicinális alkalmazások Doktori értekezés tézisei Dénes Júlia Eötvös Loránd Tudományegyetem, Természettudományi Kar, Kémia Doktori Iskola
Engedélyszám: 18211-2/2011-EAHUF Verziószám: 1. 2446-06 Műszer és méréstechnika követelménymodul szóbeli vizsgafeladatai
 1. feladat Csoporttársával szóbeli beszámolóra készülnek spektrofotometria témakörből. Ismertesse a mai kémiai automatákba épített fotométerek fő részeit, a lehetséges mérési tartományt! Ismertetőjében
1. feladat Csoporttársával szóbeli beszámolóra készülnek spektrofotometria témakörből. Ismertesse a mai kémiai automatákba épített fotométerek fő részeit, a lehetséges mérési tartományt! Ismertetőjében
Molekuláris biológiai módszerek alkalmazása a biológiai környezeti kármentesítésben
 Molekuláris biológiai módszerek alkalmazása a biológiai környezeti kármentesítésben Dr. Kovács Tamás, Kovács Árpád László Kármentesítés Aktuális Kérdései 2013 Budapest, 2013.03.21-22 Bioremediáció során
Molekuláris biológiai módszerek alkalmazása a biológiai környezeti kármentesítésben Dr. Kovács Tamás, Kovács Árpád László Kármentesítés Aktuális Kérdései 2013 Budapest, 2013.03.21-22 Bioremediáció során
Szerves kémiai analízis TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ
 BSC ANYAGMÉRNÖK SZAK VEGYIPARI TECHNOLÓGIAI SZÁMÁRA KÖTELEZŐ TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŰSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI INTÉZET Miskolc, 2016 1 Tartalomjegyzék 1. Tantárgyleírás,
BSC ANYAGMÉRNÖK SZAK VEGYIPARI TECHNOLÓGIAI SZÁMÁRA KÖTELEZŐ TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŰSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI INTÉZET Miskolc, 2016 1 Tartalomjegyzék 1. Tantárgyleírás,
10. CSI. A molekuláris biológiai technikák alkalmazásai
 10. CSI. A molekuláris biológiai technikák alkalmazásai A DNS mint azonosító 3 milliárd bázispár az emberi DNS-ben (99.9%-ban azonos) 0.1%-nyi különbség elegendő az egyedek megkülönböztetéséhez Genetikai
10. CSI. A molekuláris biológiai technikák alkalmazásai A DNS mint azonosító 3 milliárd bázispár az emberi DNS-ben (99.9%-ban azonos) 0.1%-nyi különbség elegendő az egyedek megkülönböztetéséhez Genetikai
A Lengyelországban bányászott lignitek alkalmazása újraégető tüzelőanyagként
 ENERGIATERMELÉS, -ÁTALAKÍTÁS, -SZÁLLÍTÁS ÉS -SZOLGÁLTATÁS 2.1 1.6 A Lengyelországban bányászott lignitek alkalmazása újraégető tüzelőanyagként Tárgyszavak: NO x -emisszió csökkentése; újraégetés; lignit;
ENERGIATERMELÉS, -ÁTALAKÍTÁS, -SZÁLLÍTÁS ÉS -SZOLGÁLTATÁS 2.1 1.6 A Lengyelországban bányászott lignitek alkalmazása újraégető tüzelőanyagként Tárgyszavak: NO x -emisszió csökkentése; újraégetés; lignit;
Új temékek az UD-GenoMed Kft. kínálatában!
 Új temékek az UD-GenMed Kft. kínálatában! Műanyag termékek: SARSTEDT műanyag termékek teljes választéka Egyszer használats labratóriumi műanyag eszközök szövet és sejttenyésztéshez Vérvételi és diagnsztikai
Új temékek az UD-GenMed Kft. kínálatában! Műanyag termékek: SARSTEDT műanyag termékek teljes választéka Egyszer használats labratóriumi műanyag eszközök szövet és sejttenyésztéshez Vérvételi és diagnsztikai
BIOMOLEKULÁK ANALÍZISE KAPILLÁRIS ELEKTROFORÉZISSEL MÓDSZERTANI TANULMÁNYOK. PhD értekezés tézisei. Végvári Ákos
 BIOMOLEKULÁK ANALÍZISE KAPILLÁRIS ELEKTROFORÉZISSEL MÓDSZERTANI TANULMÁNYOK PhD értekezés tézisei Végvári Ákos Program megnevezése: Alprogram megnevezése: Alprogramvezető: Témavezető: Bioanalitika Fehérje
BIOMOLEKULÁK ANALÍZISE KAPILLÁRIS ELEKTROFORÉZISSEL MÓDSZERTANI TANULMÁNYOK PhD értekezés tézisei Végvári Ákos Program megnevezése: Alprogram megnevezése: Alprogramvezető: Témavezető: Bioanalitika Fehérje
azonos sikban fekszik. A vezetőhurok ellenállása 2 Ω. Számítsuk ki a hurok teljes 4.1. ábra ábra
 4. Gyakorlat 31B-9 A 31-15 ábrán látható, téglalap alakú vezetőhurok és a hosszúságú, egyenes vezető azonos sikban fekszik. A vezetőhurok ellenállása 2 Ω. Számítsuk ki a hurok teljes 4.1. ábra. 31-15 ábra
4. Gyakorlat 31B-9 A 31-15 ábrán látható, téglalap alakú vezetőhurok és a hosszúságú, egyenes vezető azonos sikban fekszik. A vezetőhurok ellenállása 2 Ω. Számítsuk ki a hurok teljes 4.1. ábra. 31-15 ábra
Gyógyszerrezisztenciát okozó fehérjék vizsgálata
 Gyógyszerrezisztenciát okozó fehérjék vizsgálata AKI kíváncsi kémikus kutatótábor 2017.06.25-07.01. Témavezetők : Telbisz Ágnes, Horváth Tamás Kutatók : Dobolyi Zsófia, Bereczki Kristóf, Horváth Ákos Gyógyszerrezisztencia
Gyógyszerrezisztenciát okozó fehérjék vizsgálata AKI kíváncsi kémikus kutatótábor 2017.06.25-07.01. Témavezetők : Telbisz Ágnes, Horváth Tamás Kutatók : Dobolyi Zsófia, Bereczki Kristóf, Horváth Ákos Gyógyszerrezisztencia
Tipizálási módszerek alkalmazása methicillin-rezisztens Staphylococcus aureus (MRSA) törzsek molekuláris epidemiológiai vizsgálatai során
 Tipizálási módszerek alkalmazása methicillin-rezisztens Staphylococcus aureus (MRSA) törzsek molekuláris epidemiológiai vizsgálatai során Ungvári Erika, Tóth Ákos Magyar Infektológiai és Klinikai Mikrobiológiai
Tipizálási módszerek alkalmazása methicillin-rezisztens Staphylococcus aureus (MRSA) törzsek molekuláris epidemiológiai vizsgálatai során Ungvári Erika, Tóth Ákos Magyar Infektológiai és Klinikai Mikrobiológiai
Grade I és Grade II vízminőséget előállító víztisztító berendezések víztisztító berendezések
 Grade I és Grade II vízminőséget előállító víztisztító berendezések víztisztító berendezések CB-2301 B30 Trace Grade I és II vízminőség - szervetlen analitikai kísérletekre TOC: 5-10 ppb CB-2303 B30 HPLC
Grade I és Grade II vízminőséget előállító víztisztító berendezések víztisztító berendezések CB-2301 B30 Trace Grade I és II vízminőség - szervetlen analitikai kísérletekre TOC: 5-10 ppb CB-2303 B30 HPLC
