1. A genomika alapjai - A humán genom Genomika
|
|
|
- Attila Boros
- 8 évvel ezelőtt
- Látták:
Átírás
1 1. A genomika alapjai - A humán genom Genomika Humán Genom Projekt DNS szekvenálás Résztvevők a humán genom projektben A HGP néhány eredménye A humán genom variációi Junk DNS a humán genomban Komparatív genomika Irodalom Fejezethez tartozó kérdések A genomika alapjai - A humán genom Genomika Bár a genomika tudománya már több évtizedes múltra tekint vissza, tulajdonképpen csak az elmúlt két évtizedben vált még az élő természettudományokkal foglalkozók között is igazán ismertté. Annak ellenére azonban, hogy jelenleg is a leggyorsabban fejlődő tudományágak közé tartozik, a hétköznapi emberek túlnyomó többsége, sőt például a régebben végzett orvosok, gyógyszerészek számára is gyakorlatilag ismeretlen fogalmat takar. Éppen ezért a bevezetőben néhány fogalmat definiálok. Először is: Mi az a genom? A genom: Egy diploid sejt teljes haploid DNS tartalma, plusz a mitokondriális DNS. Mivel a férfiak és a nők genomja különbözik abban, hogy a férfiaknak kétféle nemi kromoszómájuk van (X és Y), a genom meghatározásnál ezt is figyelembe kell venni. A következő fontos kérdés, hogy mivel foglalkozik a genomika? Igazából erre többféle definíciót is lehet adni, ezek közül talán a legegyszerűbb: A genom működésének, szerkezetének, kölcsönhatásainak vizsgálata és az ezekhez tartozó módszerek. A DNS vizsgálatán túl azonban ide tartoznak az RNS-ek vizsgálatai (transzkriptomika), a fehérjék vizsgálatai (proteomika), bioinformatika, rendszerbiológia is. Egyes meghatározásokban a genomikát a molekuláris rendszerbiológia szinonimájának is definiálják, amelyben a genom szintű szerveződések alapján ismerjük meg a világot. Valójában a genomika inkább a rendszerbiológia részének tekinthető. A genomika vizsgálatának tárgya alapján különböző alcsoportokra osztható. Lehet például: strukturális genomika; komparatív genomika; funkcionális genomika; humán genomika; farmakogenomika; orvosi genomika, stb. Ebben a könyvben főleg az utolsó hárommal foglalkozom. Van még egy fontos kérdés, ami sokak számára problémát jelent. Mi a különbség a genetika és a genomika között? Igazából nem húzható éles határvonal a két tudományág közé, mindenesetre általánosságban elmondható, hogy ha egy gént, vagy genetikai variációt vizsgálunk, akkor genetikáról szoktunk beszélni, ha több gént, vagy az egész genomot mint rendszert vizsgáljuk akkor genomikáról beszélünk. Ebből következik, hogy a genomika, mivel a rendszerbiológia témakörbe tartozik, általában jóval összetettebb módszereket igényel. Azonban, még a tudományos szóhasználatban is, a két szó használata erős átfedést mutat Humán Genom Projekt A genomika tudomány ugrásszerű fejlődését a Humán Genom Projektnek (HGP) köszönhette. A következőkben a teljesség igénye nélkül röviden ismertetem a HGP történetét, célkitűzéseit és néhány eredményét (1). Érdekes módon a HGP az amerikai Energiaiügyi Minisztérium (Department of Energy, DOE) kezdeményezésére indult el. Ennek a minisztériumnak az elődjei voltak ugyanis az atombomba kifejlesztésének irányítói. Miután Japánban az amerikaiak ledobták a két
2 atombombát, az amerikai kongresszus azzal bízta meg a DOE elődjét, hogy tanulmányozza a genomot, hiszen a nukleáris sugárzás hosszú távú károsító hatásának az oka a genom sérülése. Mivel a genomot úgy lehet legjobban tanulmányozni, ha megismerjük annak felépítését, 1986-ban a DOE az NIH-el (National Institute of Health) összefogva elhatározta a HGP elindítását. A szervezőmunka 4 évig tartott, és október 1-én hivatalosan is elindult a HGP. A projektre 15 évet és 3 milliárd dollárt szántak. A projekt fő céljai a következők voltak: Azonosítani a kb gént a humán genomban; Meghatározni a humán genomot felépítő 3 milliárd bázist; Nyilvános adatbázisokban tárolni az információkat, és szoftvereket fejleszteni az elemzéshez; Bevonni a magánszektort; Etikai, törvényi és társadalmi problémákat tisztázni; Modell szervezetek megszekvenálása (pl. egér, csimpánz, háziállatok; növények, mikroorganizmusok, patogének stb.). Ez utóbbival választ kaphatunk olyan kérdésekre mint pl: Miért ember az ember (csimpánz vs. ember)? Melyek az élethez nélkülözhetetlen gének (konzervált gének, amelyek minden élőlényben megtalálhatók)? Patogének, háziállatok, növények megszekvenálása. A HGP nem ment teljesen zökkenőmentesen ban, a projekt tervezett idejének a felénél, még csak az emberi genom 5%-a volt ismert, és reménytelennek látszott a projekt sikeres teljesítése. Craig Venter a projekt egyik vezető alakja egy új módszer bevezetését javasolta. Ez az ún. shotgun sequencing lényege az volt, hogy a genomot rövid darabokra felszabdalták, ezeket a darabokat megszekvenálták, majd az átfedő szekvenciák segítségével összeillesztették őket. A módszer bizonyítottan működött kisebb (bakteriális) genomoknál, azonban a HGP vezetői úgy gondolták, hogy a nagyságrendekkel nagyobb emberi genomnál ez a módszer nem fog működni. Venter ezért kilépett a HGP-ből és saját céget (Celera) alapított, és magántőke bevonásával be akarta bizonyítani, hogy jól működik a módszere. Ez a kiválás katalizátorként hatott az eseményekre. A gyorsuláshoz persze az is hozzájárult, hogy a 8 év alatt rengeteg olyan fejlesztés történt, amelyek hatása ekkora érett meg. A szekvenálást a Sanger által kifejlesztett didedoxi módszerrel végezték, amelynek egyik hátránya az volt, hogy a DNS-t felépítő négy nukleotid sorrendjét 4 külön zajló reakció segítségével állapították meg, melyek termékeit egymás mellett 4 külön csíkban kellett elektroforézis segítségével futtatni. Ezzel kapcsolatban kifejlesztették, hogyha 4 féle fluorescens festékkel jelölik meg a 4 terméket, azok egyszerre, egyetlen kapilláris elfo segítségével is futtathatók. Ráadásul, pl. az Applied Biosystem olyan szekvenáló automatát is kifejlesztett, amely egyszerre 96 kapillárissal tudott dolgozni és mindössze napi 15 perc beavatkozást igényelt. De kifejlesztették például a bakteriális mesterséges kromoszóma vektort, amelyekbe a korábbiaknál lényegesen nagyobb ( kilobázis) genom darabot lehetett klónozni. Az egyéb jelentős fejlesztések mellett kiemelkedik a számítástechnika fejlődése. A humán genomot felépítő több mint 3 milliárd betű tárolása, kezelése, annotálása a 90-es évek elején még méregdrága szuperkomputereket igényelt, manapság már bármelyik személyi számítógép is könnyedén megbirkózik a feladattal. Ezzel kapcsolatban rengeteg új bioinformatikai módszer került kifejlesztésre és számos nyilvános, felhasználóbarát, on-line adatbázist alakítottak ki. Mindezek hatására 1999-től 15 hónap alatt 10%-ról 94%-ra nőtt a megismert humán szekvencia aránya. A szekvenálásokat nagy, gyárszerű épületekben végezték. A szekvenálás sebességére jellemző, hogy 1999-ben a HGP havonta 7 millió mintát dolgozott fel, és másodpercenként 1000 nukleotidot szekvenált meg. A Celera teljesítménye még lenyűgözőbb. A mindössze 65 fős személyzetből álló szervezet 1999 szeptember 8-a és 2000 június 17-e között 14.9 milliárd bázist szekvenált meg, ami a teljes humán genom közel 5- szörös lefedését tette lehetővé. A Celera és a HGP végül egymással megegyezve, egyszerre, 2001 februárjában, ugyanazon a héten közölték eredményeiket a világ két vezető tudományos lapjában a Nature-ben és a Science-ben (2,3). A közölt eredmények még csak a humán genom ún. draft szekvenciáját tartalmazták, azaz számos lyuk (gap) volt még benne, illetve sok
3 szekvenálási hibát tartalmazott. Ebben egy szekvencia 4-5-szörös lefedéssel volt megszekvenálva. A HGP hivatalosan 2003 áprilisában zárult, amikorra elkészült a lyuk nélküli, magas minőségű, 8-9-szeres lefedettségű humán genom szekvenciája (4) DNS szekvenálás A DNS szekvenálás fejlődése a HGP befejezése óta is töretlen. A humán genom szekvenciáját a HGP-ben Sanger módszerével a didedoxi szevenálással határozták meg. A HGP összköltsége 3 milliárd $ volt, Craig Venter genomjának megszekvenálása összesen 70 millió $-ba került ben egy humán genom megszekvenálása minimum egy évbe tellett. Nyilvánvaló ekkora költség és ennyi idő nem alkalmas arra, hogy a genom szekvenálás a mindennapi rutinná váljon, de még arra sem, hogy sok ember genomját megismerjük, összehasonlítsuk. Az is lassan világossá vált, hogy ennek a módszernek a továbbfejlesztésével nem lehet jelentősen csökkenteni a költségeket, illetve az időt. Azonban a szakértők számára nyilvánvaló volt, hogy ha olcsóvá és gyorssá lehetne tenni a szekvenálást, az óriási előrelépést jelentene például a gyógyszerkutatásban, vagy a személyre szabott gyógyászatban, de a felhasználási lehetőségek száma szintén végtelen. Hogy a fejlesztéseket elősegítsék, létrehozták az Archon X díjat a genomikáért (1. ábra) (5). Ezt a díjat, 10 millió $-ral együtt az a cég kapja, amelyik képes 100 emberi genomot, maximum 10 nap alatt, maximum 1 hibával 100 ezer bázisonként, és nem többért, mint 10 ezer $/genom költségért megszekvenálni. Ez a felhívás 2006-ban sokak számára még kicsit utópisztikus vágyálomnak tűnt, azonban hamarosan kiderült, hogy a célt valószínűleg hamarabb fogják elérni, mint ahogy azt sejtették. Abban mindenki egyetértett, hogy nem is a kitűzött 10 millió $ az igazi tét, hiszen, ha egy cég jelentős piaci előnyhöz jut ezen a piacon, az ennél nagyságrendekkel nagyobb hasznot fog elérni. Mindenesetre számos cég, illetve szervezet egymással párhuzamosan olyan radikálisan új fejlesztéseket, újításokba fogott, hogy rövidesen többen is a cél közelébe kerültek. A didedoxi szekvenálás helyett olyan módszereket fejlesztettek ki, mint pl. a szekvenálás ligálással (Solid technológia, Applied Biosystem), a piroszekvenálás (454 technológia, Roche), vagy a szekvenálás reverzibilis terminátorral (Solexa technológia, Illumina). A módszerek annyira sikeresek voltak, hogy a szekvenálást 2007-ben megválasztották az év módszerének (6). Az új módszerek közül először 2007-ben a 454 technológiával James Watson genomját szekvenálták meg 2 hónap alatt 1 millió $-ért, ami még ugyan messze volt a kitűzött céltól, de máris óriási előrelépést jelentett a korábbiakhoz képest. Sőt az összes cég folyamatos fejlesztésben van, és egyre lejjebb szorítják mind az időt, mind a költségeket. Például az Applied Biosystem 2008-ban 60 ezer $-ért szekvenált meg egy genomot ben az Illumina HiSeq 2000 rendszerével 30x-os lefedettséggel két emberi genom megszekvenálása 8 nap alatt történik, 6 ezer $ dollár/genom költséggel. A Complete Genomics nevű cég egy cikkében 40x-es lefedettséggel már $-ról írt. De a verseny tovább folyik, új technikákkal, vagy a régiek tökéletesítésével szinte havonta jelennek meg újabb hírek a szekvenálás árának csökkenéséről és sebességének növekedéséről (2. ábra). A szekvenálás fejlődését kihasználva olyan projektek indultak, mint pl. az 1000 genom projekt, amely különböző etnikumú populációkhoz tartozó, összesen 2500 ember megszekvenálását tervezi. A projekt 2008-ban indult és első eredményeit már 2010 októberében közölték (7,8). De ilyen projektek például a Genome 10k projekt, amely 10 ezer gerinces faj megszekvenálását tervezi ( vagy a márciusában indult i5k projekt, amely 5000 rovar megszekvenálását tűzte ki célul
4 1.4. Résztvevők a humán genom projektben Először is érdekes kérdés, hogy kiket szekvenáltak meg először? A Celera a Science-ben megjelent cikkében ezt írta: 21 kevert etnikumú önkéntes donort választottak ki (kor, nem önmeghatározott etnikum). Mindenkitől vettek ml vért, a férfiaktól 5 adag sperma 6 hét alatt. Végül a minták minősége és az etnikumok diverzitását figyelembe véve 2 férfit és 3 nőt választottak ki: 1 afrikait, 1 kínait, 1 spanyol-mexikóit és 2 kaukázusit (3). A hivatalos HGP 2 centrumban gyűjtötte a donorokat, hasonló elvek alapján. Érdekesség azonban, hogy később kiderült, hogy a szépen hangzó szempontokkal szemben a Celera végül Craig Venter genomját szekvenálta meg. A HGP-ben összesen 18 ország vett részt, de közülük messze kiemelkedett az USA. A nemzetközi genom projektet a HUGO (Human Genome Organization) koordinálta. A HGPről és eredményeiről részletesen olvashatunk a HGP hivatalos honlapján ( illetve számos más, az interneten fellelhető forrásból pl.: A HGP néhány eredménye A HGP/Celera számos érdekes, sokszor váratlan eredményt hozott, amelyeket a tudományos világ azóta is folyamatosan frissít, illetve bővít. Talán a legmeglepőbb eredmény az volt, hogy a várt, 100 ezres nagyságrendű génszám helyett alig több mint 20 ezer gént tartalmaz a humán genom Az 1. táblázatban látható néhány statisztikai adat a humán genomról. Néhány érdekesebb eredményt az alábbiakban láthatók, kiegészítve/kijavítva újabb eredményekkel, pl. az 1000 genom projektből: Legnagyobb gén: Dystrophin (DMD): 2,2Mb ( bp) Leghosszabb kódoló szekvencia: titin: bp, < aminosav) Leghosszabb exon: titin: bp Legtöbb exon titin gén: 351 db 20%-a a genomnak (605 Mb) génsivatag = >500 kb gén nélkül Géngazdag kromoszómák: 17,19,22 Leggazdagabb: 19-es: 63,8Mb = 1450 gén (Ensembl): 22,4 gén/mb Génszegény kromoszómák: 4,13,18,X, Y Y a leggénszegényebb összesen 62 gén; 1,0 gén/mb Az intronoknak a 98,12% GT bázisok vannak az 5 végén és AG 3 végén; 0,76% GC- AG Rekombináció magasabb a nőkben, mint a férfiakban, de a mutációk száma magasabb a férfi meiózisban, azaz az emberekben található öröklődő mutációk többsége a férfiakban keletkezik. Minden újszülött 60 új mutációt kap szüleitől. Minden ember átlagosan funkcióvesztése mutációval rendelkezik az ismert (annotált) génekben, melyek közül olyan gén, amely valamilyen öröklődő betegségben szerepet játszik. Ez többek között jelzi, hogy miért veszélyes, ha egymással rokonságban élő párnak gyermeke születik. Ilyenkor nagy az esély, hogy a szülőpárban heterozigóta formában jelenlévő, recesszív betegség a gyermekekben megjelenjen. Illetve, a funkcióvesztéses mutációnál, mivel egyes létfontosságú fehérjék kisebb mennyiségben vannak jelen, megnövelheti bizonyos betegségekre való hajlamot, vagy legalábbis befolyásolja a hordozók fenotípusát. Érdekes megjegyezni, azonban, hogy ennek ellentétes hatása is lehet, amit majd a gén-környezet
5 kölcsönhatás részben tárgyalunk, azaz bizonyos környezeti tényezőkkel szemben (pl. fertőzés) növelheti az ellenálló képességet. A humán genom 46%-a ismétlődő szekvenciákból áll. Ezek közül sok a transzpozon, azaz ugráló gén, amelyek viszont kb. 40 millió év óta inaktívak. A leggyakoribb ismétlődő szekvenciát Alu-nak hívják, mely a teljes genomunk 10,6%-át foglalja el. Több száz génünk származik baktériumokból horizontális gén-transzferből. A pericentromerikus és a subtelomerikus régiókban nagy szakaszok ismétlődnek Jelenleg 156 imprintált gént (Genetikai imprinting: az apai és az anyai gének kifejeződése különböző) ismerünk, azaz ezek közül vagy csak az anyai (56%), vagy csak az apai (44%) aktív. Ha valami oknál fogva ebben a rendszerben hiba következik be, tehát pl. ha mindkét gén aktív, súlyos betegségekhez vezet (pl. Beckwith- Wiedemann és Angelman szindrómák). CpG szigetek olyan szekvenciák ahol a CG dinukleotid arány magasabb a vártnál. Ezekből db található az ismétlődésmentes részeken; sokszor egybeesnek a gének 5 végével (40%). Metilálálódhatnak, amivel befolyásolhatják a gének expresszióját, szerepet játszanak a gén inaktivációjában és az imprintingben. Viszont őssejteken a metiláció 25% nem CG-n történik, hanem CA-n (szemben a normál sejtekkel, ahol ez az arány csak 1%). Az AT-gazdag régiók génszegények Detektáltak 298 db paralógot, egy exonos gént (processed paralog), ebből 97 igazoltan működik. Paralóg = génduplikáció eredménye, működnek, intronos vagy intronnélküli változat, funkciója lehet ugyanaz, vagy hasonló, de más is mint az eredeti génnek (vs. ortológ). Mivel a szelekciós nyomás a duplikálódott génen kisebb, vagy hiányozhat, szabadon mutálódhat, így nyerve új funkciókat. Eddig (2011. november) pszeudogént találtak. Ezek, szemben a paralogokkal inaktív gének: lehetnek nem expresszálódó másolatok: processed (intronnélküli), unprocessed duplicated (intronos) változata az eredeti génnek; de átíródhatnak RNS-sé is. Korábban semmilyen szerepet nem tulajdonítottak nekik, azonban újabb kutatások alapján, az átíródó pszeudogének kompetícióba kerülhetnek a gén expresszió szabályozásban fontos szerepet betöltő mirns-ekkel, így befolyásolhatják a velük rokon gének működését. A génexpresszió szabályozásában fontos szerepet játszik a nukleinsavak metilációja. Ennek tanulmányozására indították el a Human Epigenome Projectet (8,9). Ebből egy új tudományág nőtt ki, az epigenomika, amely a genom, illetve a genom mellett található fehérjék olyan módosulataival foglalkozik (pl. metiláció, acetiláció, hiszton módosulások), amely nem érintik közvetlenül a DNS szekvenciát, a bázissorrendet, de működésében fontos szerepet játszanak, sőt tovább is örökíthetőek. A metilációs mintázat hibái is vezethetnek betegségekhez. Ide tartoznak az imprintált géneknél említett szindrómák (az imprintáltság is a metiláció révén szabályozott), vagy pl. egyes tumorok, fragilis X vagy a Rett szindróma. A humán és más élőlényének genomjáról számos web oldalon gyűjthetünk információkat, pl.: A genetikai variációkkal, témánkban betöltött jelentős szerepük miatt a következő alfejezetben foglalkozom. A humán genom feltérképezése a HGP hivatalos lezárása után sem fejeződött be. Megalakult a Genome Reference Consortium, amelynek fő feladata, hogy a genomban még megtalálható hiányokat ( gap -ek) feltérképezze, illetve az esetleges hibákat korrigálja. A
6 gap-ek a genom nehezen megszekvenálható, főleg ismétlődéseket tartalmazó régióiban találhatók. Becslések szerint a HGP befejezésekor, 350 ilyen gap volt, a szerkezei variációk egy része ezekben a gap-ekben található. Ez a régió nem kicsi, a teljes genom kb. 5%-ának felel meg. A feladat nehézségére jellemző, hogy 6 évvel később, 2009-ben még csak 50 ilyen gap-et sikerült megszekvenálni A humán genom variációi Az emberi genom megismerését célzó Human Genome Project (HGP) része volt a humán genom variációinak a vizsgálata is, ami témánk szempontjából olyan nagy jelentőségű, hogy lényegét külön ismertetem (2,3). A genom leggyakoribb variációja az egy nukleotidot érintő polimorfizmus, angol rövidítéssel SNP (single nucleotide polymorphism). Általában SNP-ről beszélünk akkor, ha a variáció populációs gyakorisága meghaladja az 1%-ot. Az ennél kisebb gyakoriságban előforduló variációt általában mutációnak szoktuk nevezni, bár ez utóbbi kifejezést főleg akkor használjuk, ha a variációnak fenotípusosan is megjelenő, funkciót módosító hatása is van. Azonban az elmúlt időben, az SNP-k meghatározása óriásit változott (ld. módszerek), és SNP-nek neveznek általában mindenféle egy nukleotidot érintő variációt, azzal hogy hozzáteszik, hogy mekkora a ritka allél gyakorisága, azaz a MAF-ja (minor allele frequency). Ennek a pontos definícióját még nem adták meg, de általában gyakorinak mondják, ha a MAF > 5%, alacsonynak, ha a MAF 0,5-5% között van, és ritkának ha < 0,5%, néhány publikációban ez utóbbi 0,3%. A legtöbb SNP az intronokban található, utánuk következnek az intragenikus régiók, és végül legritkább az SNP az exonokban. Általában, átlagosan minden 1000 nukleotid polimorf, viszont az összes SNP-nek csak a 0,12-0,17%-a változtat meg aminosav kódot, és ennek is csak 40-47%-a non-konzervatív. A többi SNP első ránézésre semleges, azonban a legújabb vizsgálatok rámutatnak arra, hogy fenotípusos megjelenés szempontjából (ide tartozik pl. a betegségekre való hajlam, környezeti tényezőkre, gyógyszerekre való reagálás is) nem meghatározó, hogy az illető SNP változtat-e meg aminosav kódot vagy nem. Sőt az utóbbi időkben felfedezett betegségekhez kapcsolható SNP-k túlnyomó többsége nem változtat meg aminosav kódot (4). Már a HGP során is találtak nagyobb szekvencia variációkat a genomban, azonban ezek jelentőségét populációs szinten, az SNP-kel összehasonlítva elhanyagolhatónak mondták. Azonban 2006 végén, ahogy egyre javultak a genom vizsgálati módszerei, rájöttek, hogy a genomban rengeteg kisebb nagyobb méretű kópia szám variáció fordul elő (10). Azaz vannak olyan től akár több megabázis nagyságú nukleotid szekvenciák, amelyek, ha a genomokat összehasonlítjuk, különböző kópia számban fordulnak elő. Ezekből ugyan nincs olyan sok, mint az SNP-kből, azonban, mivel nagyobb genomterületeket érintenek, összességében két ember között nagyobb variációért felelnek, mint az SNP-k. Ezt a típusú variációt elnevezték copy number variation-nak azaz CNV-nek (10). Legtöbbször a genom szerkezeti variánsait általában a CNV-khez szokták sorolni. A 3. ábra mutatja be a lehetséges szerkezeti variánsokat. Becslések szerint a teljes genom 12%-át érintik ezek a variációk, és eddig gént (a gének 13%-a) találtak, amely érintett. Ez azt jelenti, hogy egyes emberek különbözhetnek abban, hogy egy génből hány kópia található meg bennük. Az esetek többségében ez semmilyen látható tünetet nem okoz, de már számos betegségben igazolták a CNV-k szerepét. Ilyen pl. a skizofrénia, a HIV/AIDS hajlam, Crohn betegség, vesebetegségek, Alzheimer kór vagy az obezitás. Az SNP mintájára, ahol a polimorfizmus szó arra utal, hogy a variáció gyakorisága nagyobb mint 1%, bevezették a copy number polymorphism (CNP) kifejezést is a gyakori CNV-kre.
7 A betegségek mellett pl. a transzplantációban is szerepet játszhatnak a CNV-k. Például, vannak populációs szinten is gyakori, egész géneket érintő deléciók. Ilyenkor, ha a beültetést kapó szervezetből hiányzik egy gén, és így az abból expresszálódó fehérje, akkor, ha a donor szervben megtalálható ez a fehérje, az akceptor szervezet immunválaszt adhat a beültetett szerv ellen az MHC egyezés ellenére, pl. csontvelői őssejt átültetésnél graft versus host betegség léphet fel (11). A CNV-kel kapcsolatban még egy érdekes felfedezést tettek. Általánosan elfogadott, hogy az egypetéjű ikrek genetikailag teljesen egyformák. Ezt a dogmát változtathatja meg az a felfedezés, hogy különbséget találtak a CNV-k tekintetében egypetéjű ikrek között (12). Ez utóbbi azt is mutatja, hogy szomatikusan is keletkezhetnek, pl. a magzati fejlődés során. A CNV-k kimutatása szempontjából fontos, hogy a CNV-k egy részénél található olyan SNP, amely kapcsoltan öröklődik, azaz ezeknek a CNV-knek a kimutatásához elégséges a sokkal egyszerűbben (ld. módszerek fejezet) kimutatható SNP-ket detektálni. A CNV-ket is figyelembe véve egy ember két genomja (itt a két szülőtől kapott kromoszómakészlete) átlagosan 0,5%-ban különbözik egymástól, azaz a CNV-k körülbelül 4x akkora különbségért felelnek, mint az SNP-k. Ezt az elsőnek megszekvenált ember, Craig Venter genomjából állapították meg ((13) 2. táblázat). Azonban a különbség történelmileg régen elvállt embercsoportok között akár a 3%-ot is elérheti. Érdekesség, hogy ezek a különbségek egy része véletlenszerű mutációk révén alakult ki (és ún. random drift, azaz véletlen sodródás során halmozódhat fel lokálisan), másik részük kialakulásában viszont a természetes szelekció játszott szerepet. Ide tartoznak pl. a bőrszínt, vagy az immunválaszt befolyásoló (baktériumok, vírusok által formált) genetikai variációk, melyek egy részét már sikerült beazonosítani (ld. gén-környezet fejezet). A modern ember-genom fejlődéséről alkotott elképzelésünk jelentős változásokon ment keresztül az elmúlt években májusában Scante Pääbo és munkatársai először a Neandervölgyi ember, majd egy nemrégiben felfedezett ember-populáció a Denisova-i (magyaros írással gyenyiszovai) ember genomját szekvenálta meg (14,15). Itt kell megjegyezni, hogy jelenleg még nem eldöntött kérdés, hogy ezek az embertől külön fajként definiálhatók-e, vagy ugyanannak a fajnak egy alfajának? Korábban az elmélet az volt, hogy a modern ember egy csoportja kb évvel ezelőtt elhagyta Afrikát, és benépesítette a Földet. Azonban, ezekben a vizsgálatokban azt találták, hogy a modern ember a Közel- Keleten részben keveredett a Neandervölgyi emberrel, illetve bizonyos embercsoportok a Denisova-i emberrel. Ennek következtében bizonyos ma élő embercsoportok 1-4%-ban a Neandervölgyi, a Pápua Új Guinea-n és egyes szigeteken élők, ausztrál őslakosok, óceániaiak stb. pedig a Denisova-i ember genomjának 4-6%-át hordozzák. Pl., a melanézek, mindkét populációtól hordoznak genom-nyomokat, genomjuk kb. 8%-ában. Ezek nyilván hozzájárulnak két ember genomja közötti különbségekhez (16,17). Érdekességként itt lehet megjegyezni, hogy egyes kutatások alapján ez a hozzákeveredés, vagy angolul admixture, pozitív hatással volt a ma élő ember immunrendszerére. Becslések szerint a ma élő ember HLA alléljainak kb. 50% az archaikus emberektől származik, növelve ezzel a patogének felismerésében fontos szerepet betöltő HLA variációinak számát, így populációs szinten a faj stabilitását (ld. gén-környezet kölcsönhatás fejezet). A HGP után a HapMap projektek és az 1000 genom projekt járultak hozzá jelentős mértékben az emberi genom variációinak feltérképezéséhez. Például a hét populációt vizsgáló 1000 genom projekt első eredményeit bemutató pilot cikkében 15 millió SNP-t, 1 millió rövid inzerciót, vagy deléciót és 20 ezer szerkezeti variánst közöltek. Ezek többsége új variáció volt. Becslések szerint azonosították az ezekben a populációkban található összes variáció 95%-át (8). A variációk és a gének száma szempontjából kiemelkedik az emberi genom 6p21.3 régiójában található MHC (vagy HLA) régió. Ezen a 7,6 Mb szakaszon kódolódnak az
8 immunválaszban, transzplantációban, véradásnál létfontosságú szerepet betöltő MHC, vagy HLA gének. Ennek a genomterületnek az ún. class III régiójában található a legnagyobb génsűrűség (58 expresszálódó gén), illetve az egész régióra jellemző a nagyfokú diverzitás. Egy vizsgálatban ennek egy 4 Mb-nyi régiójában 37 ezer SNP-t és 7 ezer szerkezeti variánst találtak, ami kb. egy nagyságrenddel nagyobb variáció sűrűség, mint a genom többi részén Junk DNS a humán genomban Az alacsony génszám még a szakembereket is meglepte, sőt szinte sokként érte. Erre jellemező, hogy még 2000-ben a Cold Spring Harbor Laboratory Genome Meeting-en a terület specialistái fogadtak a humán genom génszámára. A számok 26 ezer és több mint 150 ezer között terjedtek, így végül a legalacsonyabb számot tippelő nyerte a fogadást, pedig még ő is kb. 20%-kal magasabb számot tippelt a valóságosnál. Az eredmény azért is meglepte a szakembereket, mert például az alig 1 mm nagyságú, szabad szemmel gyakorlatilag láthatatlan, igen egyszerű felépítésű Caenorhabditis elegans nevű fonálféreg, amely az egyik legnépszerűbb modell állat biológiai kísérletekben, nagyságrendileg hasonló számú gént tartalmaz. Ebből az alacsony génszámból következik, hogy a humán genom fehérjét kódoló részének aránya mindössze 1,2%-a a teljes genomnak. Mivel korábban úgy gondolták, hogy a genom fő feladata az, hogy fehérjéket kódoljon, a fehérjét nem kódoló részt a genom hulladékának, angolul junk -nak nevezték (18). A szakemberek azonban nyilvánvalóan érezték, hogy az emberi genom egyszerűen nem állhat 98,8%-ban szemétből, felesleges szekvenciából! Hogy tisztázzák ezt az ellentmondást, 2003-ban elindították a Encyclopedia of DNA elements (ENCODE) projektet: amely az első fázisban azt tűzte ki maga elé, hogy a genom 1%-ban felderíti az összes funkcionális egységet (19). Ez a projekt 2007-ben lezárult, de 2008-ban 80 millió $-os költségvetéssel további 4 évre meghosszabbították. Az eredmények lényege, hogy az emberi genom kb. 5%-a evolúciósan konzervált, azaz tőlünk igen távoli fajokkal szinte tökéletesen megegyezik, azaz a nem-fehérjekódoló régióknak is nyilvánvalóan van valamilyen funkciója (pl. transzkripciós faktor kötőhely, regulátor szekvencia, mirns kötőhely, RNS-t kódol stb.), illetve a genom 3 dimenziós szerkezetének és kromatin struktúrájának is fontos jelentősége van. Ez utóbbira is történtek vizsgálatok. Eszerint, ha olyan algoritmussal hasonlították össze a különböző fajok genomját, hogy az azokat alkotó nukleinsavak milyen 3D szerkezetet vesznek fel, akkor a humán genom 12%-át találták konzerváltnak (20). Egyes elméletek szerint, építőipari hasonlatot használva a genomban kódolt fehérjéket nevezhetjük építőköveknek, míg az azon kívüli részek tartalmazzák azt az információt, hogy ezeket a köveket hogyan kell úgy összerakni, hogy azokból egy működőképes szervezet jöjjön létre. Erre egyfajta bizonyíték az is, hogy bár az élet már 4 milliárd évvel ezelőtt kialakult a Földön, a többsejtű élőlények mindössze 525 millió évvel ezelőtt jelentek meg. Valószínűnek tűnik, hogy ez a 3,5 milliárd éves evolúció kellett ahhoz, hogy egy olyan szabályozó mechanizmus alakuljon ki, amely lehetővé tette a bonyolultabb életformák létrejöttét. Nyilvánvaló, hogy a szabályozáshoz szükséges információ nem a fehérjéket kódoló génekben található, azaz elvileg minél több ilyen szekvencia van egy genomban, annál több szabályozó mechanizmus férhet bele (18). Az alacsony génszám-bonyolult szervezet ellentmondást némileg feloldja az a felfedezés is, hogy génjeink 94%-a nemcsak egy fehérjét kódol, azaz például alternatív splicing útján a különböző szövetekben ugyanabból a génből más-más szerkezetű és funkciójú fehérjék íródnak át. Egyszerűbb szervezeteknél ilyen mechanizmus nincs, vagy csak jóval kisebb mértékű. Továbbá, a fehérjék poszt-transzlációs módosításaival rengeteg különböző fehérje jöhet létre. Egyes becslések szerint az ember fehérjéinek száma eléri a 2 milliót.
9 2001-ben még úgy gondolták, hogy a genom fő funkcionális részei a fehérjéket kódoló gének. Az RNS-eket egyfajta segédszereplőknek gondolták, azaz fő funkciójuk, hogy (mrns, t-rns, rrns formában) a fehérjére való átíródásban segédkezzenek. Azonban az utóbbi években egyre másra fedezik fel, hogy az RNS-eknek milyen funkcióik vannak még, főleg a szabályozásban. A leghíresebb példa az RNS interferencia és a mikro RNS-ek (mirns) felfedezése, amelyért 2006-ban Nobel-díjat is adtak (21). Kiderült, hogy a gének > 60%-ának a szabályozásában játszanak szerepet, egy mirns akár több száz génében is, lehetővé téve egy igen bonyolult, összehangolt szabályozást. De ide tartoznak a főleg a spermatogenezis szabályozásában szerepet játszó piwi-interacting (pi) RNS-ek, vagy a pszeudégenről átíródó competitive endogenous RNS-ek (cerns), vagy antisense terminiassociated short RNS-ek (atasrs), Large intervening noncoding RNS (lincrns), stb. (22). Általában ezek fő szerepe a transzkripción, ritkábban a transzláción keresztüli géncsendesítés. Korábban szintén nem gondolták, hogy a teljes genom 74-93%-a átíródik RNS-sé, és valószínű, hogy ez nem történik véletlenül Komparatív genomika A junk-nak nevezett, fehérjére nem átíródó szekvenciák fontos szerepét mutatják a komparatív genomika eredményei. A komparatív genomikában különböző fajok genomját hasonlítják össze, és olyan kérdésekre keresik a választ, mint pl.: Milyen gének jellemzőek egy fajra (pl. csimpánz vs. ember)? Milyen szekvenciák nélkülözhetetlenek az emlős élethez (pl. egér vs. ember vs. gyümölcslégy)? Melyek a többsejtűek alapfehérjéi (féreg vs. ember vs. egysejtűek)? stb. Ezek a mi témánk szempontjából olyan eredményeket hoztak, mint pl., hogy az egér hasonlósága az emberrel 90%, génjeinek 99%-ának van humán megfelelője, csak kb. 300 génben különbözünk, azaz az egér jól használható mint modell élőlény emberi gének funkciójának, vagy betegségek vizsgálatában (23). Az egér az evolúciós fejlődésben kb. 75 millió évvel (420 millió egérgeneráció) vált el tőlünk. Érdekes módon, a kutyától régebben váltunk el, azonban, tekintve a kutya lényegesen hosszabb generációs idejét, gén-szinten kisebb a különbség. Az emberi genomot ezzel a két állatfajjal összehasonlítva 7-7,5%-ban találtak konzervált régiókat a fehérjéket kódoló géneken kívül (24). Konzervált régiók: Ha két genomikai régió egymással csaknem teljesen megegyezik két, egymástól már régen elvált fajban, akkor ez a régió szelekciós nyomás alatt van, azaz valamilyen olyan funkciója van, amelynek változása életképtelenné teszi az élőlényt (a mutáns kiszelektálódik). Nyilvánvalóan az ember legközelebbi rokonánál, a csimpánznál, melytől >6.3 millió évvel, és mindössze kb. 250 ezer embergenerációval ezelőtt váltunk el még több azonosságot találtak. Ennek közelségét egy olyan, kicsit humoros példával szokták demonstrálni, hogy képzeljük el, hogy egy ember ha megfogja az anyja kezét, és az is az ő anyjáét, és így tovább, akkor ha a mai ember Budapesten van, akkor kb. Debrecenben már egy csimpánz-szerű anya fog állni. A csimpánzzal hasonlóságunk 99%, ha az egymáshoz illeszthető szekvenciákat nézzük, összességében a hasonlóság 96%. A különbségekért főleg inzerciók/deléciók ( indelek ) a felelősek. Érdekes módon a legnagyobb a különbség az Y kromoszómában, ahol a két faj 30%-ban különbözik. Az X kromoszóma hasonlósága miatt viszont, egy akkoriban nagy port felvert feltételezés is történt, azaz 1,2 millió évvel a két faj szétválása után kimutatható még genomcsere, azaz utódokat eredményező párosodás történt a két faj között. Egy másik érdekesség, hogy találtak egy, amúgy nagyon konzervált gént (FOXP2), amely különbözött az ember és a csimpánz között, de nem az ember és a neandervölgyi ember (Homo neanderthalensis) között. A FOXP2 mutációja emberben egy sajátos beszédzavart
10 okoz, azaz a mutáció hordozója képtelen a nyelvtan legalapvetőbb szabályait is megtanulni. Ezt annak idején elnevezték (nyilván helytelenül) nyelvtan génnek. Ha a ma élő ember genomját a régen kihalt neandervölgyi ember genomjával hasonlították össze, aminosav szekvenciában mindössze különbséget találtak, a különbség a csimpánzokhoz képest 20-50x kevesebb. Igaz, ahogy előzőekben már tárgyaltuk, a korábbi tudományos vélekedéssel ellentétben a két faj szétválása után (amely 500 ezer évvel ezelőtt történt) párosodott egymással, azaz mind az európaiak, mind az ázsiaiak genomjának 1-4%-n kimutatható a két faj keveredése. 78 olyan fehérjeváltozást okozó különbséget találtak az emberi genomban, amely ez idő alatt alakult ki, illetve jó néhány olyan változást, amely az emberben pozitív szelekciónak minősülhet. Ilyenek pl. a sperma mozgékonyságot, a sebgyógyulást, a bőr működését, vagy a kognitív képességeket befolyásoló ( javító ) mutációk (17, 25).
11 Legutolsó frissítés szeptember Genom nagysága (bázispár) Ismert fehérjét kódoló gén (darab) Pszeudogén (darab) RNS gén (darab) Gén exon (darab) Rövid variánsok, pl. SNP (darab) Szerkezeti variáns táblázat Néhány statisztikai adat a humán genomról. Forrás:
12 SNP-k száma J. Craig Venter genomja 3,213,401 James Watson genomja 3,322,093 Ázsiai genom 3,074,097 Yoruban (afrikai) genom 4,139,196 Szerkezeti variánsok Venter genomjában Darab Hossz (bp) CNV Inzerció/deléció Blokk szubsztitúció Inverzió táblázat Genetikai variációk aránya különböző megszekvenált humán genomokban (13).
13 1. ábra A genomikai X díjnak az emblémája (5)
14 2. ábra DNS szekvenálás árának (piros vonal) és az adatbázisokban tárolt befejezett DNS szekvenciák mennyiségének (kék vonal) változása 2000 és 2010 között logaritmikus skálán környékén egy millió bázispár megszekvenálása 10 ezer $-ba került, amely 2010-re már 1 $-ra csökkent. A befejezett DNS szekvencia mennyisége 2000-ben 8 milliárd bázispárral indult, és kb. minden 18. hónapban megduplázódott a mennyisége re 270 milliárd bázispárra nőtt. Ez azonban eltörpül a nyers adatok mennyisége mellett, amelyet a Trace archive and Sequence Read Archive (SRA)-ban tárolnak. Az itt tárolt mennyiség 25 trillió bázispár volt 2010-ben, amit, ha ebben a koordináta rendszerben akarnánk ábrázolni, 12 méterre lógna ki a könyvből, ami kétszerese egy átlag zsiráf magasságának. A Nature 2010:464:671 cikk ábrája alapján.
15 3. ábra A genomban előforduló szerkezeti variánsok
16 1.9. Irodalom International Human Genome Sequencing Consortium: Initial sequencing and analysis of the human genome. Nature 2001;409: Venter JC et al. The sequence of the Human Genome. Science 2001;291: International Human Genome Sequencing Consortium: Finishing the euchromatic sequence of the human genome Nature 431, (21 October 2004) Rusk N, Kiermer V.Primer: Sequencing the next generation. Nature Methods 2008;5: Pennisi E Genomes Project Gives New Map Of Genetic Diversity. Science 2010; 330: ) Redon R. és mtsai.:global variation in copy number in the human genome. Nature 2006; 444: Armour JA. Copy number variation and antigenic repertoire. Nat Genet. 2009;41(12): Bruder CE, és mtsai.: Phenotypically concordant and discordant monozygotic twins display different DNA copy-number-variation profiles. Am J Hum Genet. 2008;82: Ng PC, et al. Genetic variation in an individual human exome. PLoS Genet Aug 15;4(8):e Reich D, et al. Genetic history of an archaic hominin group from Denisova Cave in Siberia. Nature Dec 23;468(7327): Green RE, et al. A draft sequence of the Neandertal genome. Science May 7;328(5979): Reich D, et al.denisova admixture and the first modern human dispersals into southeast Asia and oceania. Am J Hum Genet Oct 7;89(4): Burbano HA, et al. Targeted investigation of the Neandertal genome by array-based sequence capture. Science May 7;328(5979): Gibbs W.W. (2003) "The unseen genome: gems among the junk", Scientific American, 289(5): The ENCODE Project Consortium. Identification and analysis of functional elements in 1% of the human genome by the ENCODE pilot project. Nature 2007; 447: Parker SC, Hansen L, Abaan HO, Tullius TD, Margulies EH. Local DNA Topography Correlates with Functional Noncoding Regions of the Human Genome. Science. 2009; 324: Fire A, Xu S, Montgomery M, Kostas S, Driver S, Mello C (1998). "Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans". Nature 391 (6669): Swami M. RNA world: A new class of small RNAs Nature Reviews Genetics 2009;10, Waterston RH. Et al. Initial sequencing and comparative analysis of the mouse genome. Nature 2002; 420 (6915) Kirkness EF et al. The Dog Genome: Survey Sequencing and Comparative Analysis. Science. 2003; 301: Krause J et al. The Derived FOXP2 Variant of Modern Humans Was Shared with Neandertals. Current Biology 2007; 17:
17 1.10. Fejezethez tartozó kérdések 1. Mi az a genom? 2. Mivel foglalkozik a genomika? 3. Mi a különbség a genetika és a genomika között? 4. Mikor indult a Humán Genom Projekt? 5. Melyik szervezet koordinálta a nemzetközi Humán Genom Projektet? 6. Mondjon néhányat a Humán Genom Projekt fő céljai közül! 7. Mi annak a cégnek a neve, amely 1998-ban kezdte meg a humán genom szekvenálását? 8. Miért adják az Archon X díjat a genomikáért? 9. Mondjon példát genom projektekre! 10. Mekkora kb. a humán genom mérete? 11. Hány fehérjét kódoló gént tartalmaz körülbelül a humán genom? 12. Hány százaléka körülbelül a fehérjekódoló rész a teljes genomnak? 13. Melyik a legnagyobb humán gén? 14. Melyik fehérjének van a leghosszabb kódoló szekvenciája? 15. Melyik kromoszómán legnagyobb a génsűrűség? 16. Melyik a leggénszegényebb kromoszóma? 17. Mikor keletkezik a legtöbb öröklődő mutáció? 18. Mit jelent az 1 cm? 19. Mit nevezünk CpG szigeteknek? 20. Mi az a genetikai imprinting? 21. Hogy hívják a leggyakoribb ismétlődő szekvenciát? 22. A humán genom kb. hány százaléka tartalmaz ismétlődő szekvenciát? 23. Egy ember átlagosan hány olyan gént hordoz, melyben funkcióvesztéses mutáció van? 24. Mi az az SNP? 25. Minek a rövidítése a MAF? 26. Mi az a Copy Number Variations (CNV)? 27. Mi az a CNP? 28. Átlagosan mennyire különbözik két ember egymástól genetikai szinten? 29. Keveredett-e a homo sapiens más emberfajokkal/alfajokkal? 30. Melyik a humán genom legvariábilisabb régiója? 31. Mit nevezünk pszeudogénnek és lehet-e funkcionális szerepe? 32. Hogyan keletkeznek a paralógok? 33. Mivel foglalkozik az epigenomika? 34. Hol gyakoribb a polimorfizmus az intronban vagy az exonban? 35. Mi az a junk DNS és mi a jelentősége? 36. Milyen szerepei lehetnek az RNS-eknek? 37. Mivel foglalkozik a komparatív genomika? 38. Mik azok a konzervált genomrégiók, és mi a jelentőségük?
Orvosi genomika és bioinformatika. Gyakori betegségek genetikai és genomikai háttere
 Orvosi genomika és bioinformatika Gyakori betegségek genetikai és genomikai háttere Orvosi genomika és bioinformatika Gyakori betegségek genetikai és genomikai háttere Szerkesztette: Szalai Csaba Írták:
Orvosi genomika és bioinformatika Gyakori betegségek genetikai és genomikai háttere Orvosi genomika és bioinformatika Gyakori betegségek genetikai és genomikai háttere Szerkesztette: Szalai Csaba Írták:
A genetikai lelet értelmezése monogénes betegségekben
 A genetikai lelet értelmezése monogénes betegségekben Tory Kálmán Semmelweis Egyetem, I. sz. Gyermekklinika A ~20 ezer fehérje-kódoló gén a 23 pár kromoszómán A kromoszómán található bázisok száma: 250M
A genetikai lelet értelmezése monogénes betegségekben Tory Kálmán Semmelweis Egyetem, I. sz. Gyermekklinika A ~20 ezer fehérje-kódoló gén a 23 pár kromoszómán A kromoszómán található bázisok száma: 250M
Human genome project
 Human genome project Pataki Bálint Ármin 2017.03.14. Pataki Bálint Ármin Human genome project 2017.03.14. 1 / 14 Agenda 1 Biológiai bevezető 2 A human genome project lefolyása 3 Alkalmazások, kitekintés
Human genome project Pataki Bálint Ármin 2017.03.14. Pataki Bálint Ármin Human genome project 2017.03.14. 1 / 14 Agenda 1 Biológiai bevezető 2 A human genome project lefolyása 3 Alkalmazások, kitekintés
Többgénes jellegek. 1. Klasszikus (poligénes) mennyiségi jellegek. 2.Szinte minden jelleg több gén irányítása alatt áll
 Többgénes jellegek Többgénes jellegek 1. 1. Klasszikus (poligénes) mennyiségi jellegek Multifaktoriális jellegek: több gén és a környezet által meghatározott jellegek 2.Szinte minden jelleg több gén irányítása
Többgénes jellegek Többgénes jellegek 1. 1. Klasszikus (poligénes) mennyiségi jellegek Multifaktoriális jellegek: több gén és a környezet által meghatározott jellegek 2.Szinte minden jelleg több gén irányítása
Human Genome Project, 1990-2005 5 évvel a tervezett befezés előtt The race is over, victory for Craig Venter. The genome is mapped* - now what?
 2000 június 26 Új út kezdete, vagy egy út vége? Human Genome Project, 1990-2005 5 évvel a tervezett befezés előtt The race is over, victory for Craig Venter. The genome is mapped* - now what? 2000 június
2000 június 26 Új út kezdete, vagy egy út vége? Human Genome Project, 1990-2005 5 évvel a tervezett befezés előtt The race is over, victory for Craig Venter. The genome is mapped* - now what? 2000 június
I. A sejttől a génekig
 Gén A gének olyan nukleinsav-szakaszok a sejtek magjainak kromoszómáiban, melyek a szervezet működését és növekedését befolyásoló fehérjék szabályozásához és előállításához szükséges információkat tartalmazzák.
Gén A gének olyan nukleinsav-szakaszok a sejtek magjainak kromoszómáiban, melyek a szervezet működését és növekedését befolyásoló fehérjék szabályozásához és előállításához szükséges információkat tartalmazzák.
Az X kromoszóma inaktívációja. A kromatin szerkezet befolyásolja a génexpressziót
 Az X kromoszóma inaktívációja A kromatin szerkezet befolyásolja a génexpressziót Férfiak: XY Nők: XX X kromoszóma: nagy méretű több mint 1000 gén Y kromoszóma: kis méretű, kevesebb, mint 100 gén Kompenzációs
Az X kromoszóma inaktívációja A kromatin szerkezet befolyásolja a génexpressziót Férfiak: XY Nők: XX X kromoszóma: nagy méretű több mint 1000 gén Y kromoszóma: kis méretű, kevesebb, mint 100 gén Kompenzációs
TÉMAKÖRÖK. Ősi RNS világ BEVEZETÉS. RNS-ek tradicionális szerepben
 esirna mirtron BEVEZETÉS TÉMAKÖRÖK Ősi RNS világ RNS-ek tradicionális szerepben bevezetés BIOLÓGIAI MOLEKULÁK FEHÉRJÉK NUKLEINSAVAK DNS-ek RNS-ek BIOLÓGIAI MOLEKULÁK FEHÉRJÉK NUKLEINSAVAK DNS-ek RNS-ek
esirna mirtron BEVEZETÉS TÉMAKÖRÖK Ősi RNS világ RNS-ek tradicionális szerepben bevezetés BIOLÓGIAI MOLEKULÁK FEHÉRJÉK NUKLEINSAVAK DNS-ek RNS-ek BIOLÓGIAI MOLEKULÁK FEHÉRJÉK NUKLEINSAVAK DNS-ek RNS-ek
A HUMÁN GENOM PROJEKT Sasvári-Székely Mária* Semmelweis Egyetem, Orvosi Vegytani, Molekuláris Biológiai és Pathobiokémiai Intézet
 A HUMÁN GENOM PROJEKT Sasvári-Székely Mária* Semmelweis Egyetem, Orvosi Vegytani, Molekuláris Biológiai és Pathobiokémiai Intézet *Levelezési cím: Dr. Sasvári-Székely Mária, Semmelweis Egyetem, Orvosi
A HUMÁN GENOM PROJEKT Sasvári-Székely Mária* Semmelweis Egyetem, Orvosi Vegytani, Molekuláris Biológiai és Pathobiokémiai Intézet *Levelezési cím: Dr. Sasvári-Székely Mária, Semmelweis Egyetem, Orvosi
A DNS szerkezete. Genom kromoszóma gén DNS genotípus - allél. Pontos méretek Watson genomja. J. D. Watson F. H. C. Crick. 2 nm C G.
 1955: 46 emberi kromoszóma van 1961: mrns 1975: DNS szekvenálás 1982: gén-bank adatbázisok 1983: R (polymerase chain reaction) Mérföldkövek 1 J. D. Watson F. H.. rick 2008 1953 2003 Watson genomja DNS
1955: 46 emberi kromoszóma van 1961: mrns 1975: DNS szekvenálás 1982: gén-bank adatbázisok 1983: R (polymerase chain reaction) Mérföldkövek 1 J. D. Watson F. H.. rick 2008 1953 2003 Watson genomja DNS
Hazai méhészeti genomikai és genetikai vizsgálatok
 AKÁCKÖRÚTON Hazai méhészeti genomikai és genetikai vizsgálatok Előző cikkünkben arról írtunk, milyen új eszköztárral rendelkezünk a XXI. században a genetikai vizsgálatok területén, és mit adhat a molekuláris
AKÁCKÖRÚTON Hazai méhészeti genomikai és genetikai vizsgálatok Előző cikkünkben arról írtunk, milyen új eszköztárral rendelkezünk a XXI. században a genetikai vizsgálatok területén, és mit adhat a molekuláris
A kromoszómák kialakulása előtt a DNS állomány megkettőződik. A két azonos információ tartalmú DNS egymás mellé rendeződik és egy kromoszómát alkot.
 Kromoszómák, Gének A kromoszóma egy hosszú DNS szakasz, amely a sejt életének bizonyos szakaszában (a sejtosztódás előkészítéseként) tömörödik, így fénymikroszkóppal láthatóvá válik. A kromoszómák két
Kromoszómák, Gének A kromoszóma egy hosszú DNS szakasz, amely a sejt életének bizonyos szakaszában (a sejtosztódás előkészítéseként) tömörödik, így fénymikroszkóppal láthatóvá válik. A kromoszómák két
HAPMAP -2010 Nemzetközi HapMap Projekt. SNP GWA Haplotípus: egy kromoszóma szegmensen lévő SNP mintázat
 HAPMAP -2010 Nemzetközi HapMap Projekt A Nemzetközi HapMap Project célja az emberi genom haplotípus* térképének(hapmap; haplotype map) megszerkesztése, melynek segítségével katalogizálni tudjuk az ember
HAPMAP -2010 Nemzetközi HapMap Projekt A Nemzetközi HapMap Project célja az emberi genom haplotípus* térképének(hapmap; haplotype map) megszerkesztése, melynek segítségével katalogizálni tudjuk az ember
7. SOKFÉLESÉG. Sokféleség
 Sokféleség DIA 1 Egy populáció egyedei fenotípusos jegyeikben különböznek egymástól. Az egypetéjű ikreket leszámítva, nincs két egyforma egyed. A fenotípusos változékonyságot a genetikai változékonyság
Sokféleség DIA 1 Egy populáció egyedei fenotípusos jegyeikben különböznek egymástól. Az egypetéjű ikreket leszámítva, nincs két egyforma egyed. A fenotípusos változékonyságot a genetikai változékonyság
Tudománytörténeti visszatekintés
 GENETIKA I. AZ ÖRÖKLŐDÉS TÖRVÉNYSZERŰSÉGEI Minek köszönhető a biológiai sokféleség? Hogyan történik a tulajdonságok átörökítése? Tudománytörténeti visszatekintés 1. Keveredés alapú öröklődés: (1761-1766,
GENETIKA I. AZ ÖRÖKLŐDÉS TÖRVÉNYSZERŰSÉGEI Minek köszönhető a biológiai sokféleség? Hogyan történik a tulajdonságok átörökítése? Tudománytörténeti visszatekintés 1. Keveredés alapú öröklődés: (1761-1766,
AZ EMBERI MIKROBIOM: AZ EGYÉN, MINT SAJÁTOS ÉLETKÖZÖSSÉG Duda Ernő
 AZ EMBERI MIKROBIOM: AZ EGYÉN, MINT SAJÁTOS ÉLETKÖZÖSSÉG Duda Ernő Az NIH, az Egyesült Államok Nemzeti Egészségügyi Hivatala (az orvosi- és biológiai kutatásokat koordináló egyik intézmény) 2007 végén
AZ EMBERI MIKROBIOM: AZ EGYÉN, MINT SAJÁTOS ÉLETKÖZÖSSÉG Duda Ernő Az NIH, az Egyesült Államok Nemzeti Egészségügyi Hivatala (az orvosi- és biológiai kutatásokat koordináló egyik intézmény) 2007 végén
Kromoszómák, Gének centromer
 Kromoszómák, Gének A kromoszóma egy hosszú DNS szakasz, amely a sejt életének bizonyos szakaszában (a sejtosztódás előkészítéseként) tömörödik, így fénymikroszkóppal láthatóvá válik. A kromoszómák két
Kromoszómák, Gének A kromoszóma egy hosszú DNS szakasz, amely a sejt életének bizonyos szakaszában (a sejtosztódás előkészítéseként) tömörödik, így fénymikroszkóppal láthatóvá válik. A kromoszómák két
Bakteriális identifikáció 16S rrns gén szekvencia alapján
 Bakteriális identifikáció 16S rrns gén szekvencia alapján MOHR ANITA SIPOS RITA, SZÁNTÓ-EGÉSZ RÉKA, MICSINAI ADRIENN 2100 Gödöllő, Szent-Györgyi Albert út 4. info@biomi.hu, www.biomi.hu TÖRZS AZONOSÍTÁS
Bakteriális identifikáció 16S rrns gén szekvencia alapján MOHR ANITA SIPOS RITA, SZÁNTÓ-EGÉSZ RÉKA, MICSINAI ADRIENN 2100 Gödöllő, Szent-Györgyi Albert út 4. info@biomi.hu, www.biomi.hu TÖRZS AZONOSÍTÁS
Molekuláris genetikai vizsgáló. módszerek az immundefektusok. diagnosztikájában
 Molekuláris genetikai vizsgáló módszerek az immundefektusok diagnosztikájában Primer immundefektusok A primer immundeficiencia ritka, veleszületett, monogénes öröklődésű immunhiányos állapot. Családi halmozódást
Molekuláris genetikai vizsgáló módszerek az immundefektusok diagnosztikájában Primer immundefektusok A primer immundeficiencia ritka, veleszületett, monogénes öröklődésű immunhiányos állapot. Családi halmozódást
Orvosi Genomtudomány 2014 Medical Genomics 2014. Április 8 Május 22 8th April 22nd May
 Orvosi Genomtudomány 2014 Medical Genomics 2014 Április 8 Május 22 8th April 22nd May Hét / 1st week (9. kalendariumi het) Takács László / Fehér Zsigmond Magyar kurzus Datum/ido Ápr. 8 Apr. 9 10:00 10:45
Orvosi Genomtudomány 2014 Medical Genomics 2014 Április 8 Május 22 8th April 22nd May Hét / 1st week (9. kalendariumi het) Takács László / Fehér Zsigmond Magyar kurzus Datum/ido Ápr. 8 Apr. 9 10:00 10:45
A T sejtes immunválasz egy evolúciós szempontból váratlan helyzetben: Szervtranszplantáció
 A T sejtes immunválasz egy evolúciós szempontból váratlan helyzetben: Szervtranszplantáció Autotranszplantáció: saját szövet átültetése, pl. autológ bőrtranszplantáció, autológ őssejt-transzplantáció.
A T sejtes immunválasz egy evolúciós szempontból váratlan helyzetben: Szervtranszplantáció Autotranszplantáció: saját szövet átültetése, pl. autológ bőrtranszplantáció, autológ őssejt-transzplantáció.
Fehérje expressziós rendszerek. Gyógyszerészi Biotechnológia
 Fehérje expressziós rendszerek Gyógyszerészi Biotechnológia Expressziós rendszerek Cél: rekombináns fehérjék előállítása nagy tisztaságban és nagy mennyiségben kísérleti ill. gyakorlati (therapia) felhasználásokra
Fehérje expressziós rendszerek Gyógyszerészi Biotechnológia Expressziós rendszerek Cél: rekombináns fehérjék előállítása nagy tisztaságban és nagy mennyiségben kísérleti ill. gyakorlati (therapia) felhasználásokra
A genomikai oktatás helyzete a Debreceni Egyetemen
 A genomikai oktatás helyzete a Debreceni Egyetemen Bálint Bálint L. GNTP Oktatás és Tudásmenedzsment Munkabizottság, 2009. június 10. Tények Debreceni Egyetemről 21000 nappali és 33000 összes hallgató
A genomikai oktatás helyzete a Debreceni Egyetemen Bálint Bálint L. GNTP Oktatás és Tudásmenedzsment Munkabizottság, 2009. június 10. Tények Debreceni Egyetemről 21000 nappali és 33000 összes hallgató
A Hardy-Weinberg egyensúly. 2. gyakorlat
 A Hardy-Weinberg egyensúly 2. gyakorlat A Hardy-Weinberg egyensúly feltételei: nincs szelekció nincs migráció nagy populációméret (nincs sodródás) nincs mutáció pánmixis van allélgyakoriság azonos hímekben
A Hardy-Weinberg egyensúly 2. gyakorlat A Hardy-Weinberg egyensúly feltételei: nincs szelekció nincs migráció nagy populációméret (nincs sodródás) nincs mutáció pánmixis van allélgyakoriság azonos hímekben
Evolúció. Dr. Szemethy László egyetemi docens Szent István Egyetem VadVilág Megőrzési Intézet
 Evolúció Dr. Szemethy László egyetemi docens Szent István Egyetem VadVilág Megőrzési Intézet Mi az evolúció? Egy folyamat: az élőlények tulajdonságainak változása a környezethez való alkalmazkodásra Egy
Evolúció Dr. Szemethy László egyetemi docens Szent István Egyetem VadVilág Megőrzési Intézet Mi az evolúció? Egy folyamat: az élőlények tulajdonságainak változása a környezethez való alkalmazkodásra Egy
A humán mitokondriális genom: Evolúció, mutációk, polimorfizmusok, populációs vonatkozások. Egyed Balázs ELTE Genetikai Tanszék
 A humán mitokondriális genom: Evolúció, mutációk, polimorfizmusok, populációs vonatkozások Egyed Balázs ELTE Genetikai Tanszék Endoszimbiotikus gén-transzfer (Timmis et al., 2004, Nat Rev Gen) Endoszimbiotikus
A humán mitokondriális genom: Evolúció, mutációk, polimorfizmusok, populációs vonatkozások Egyed Balázs ELTE Genetikai Tanszék Endoszimbiotikus gén-transzfer (Timmis et al., 2004, Nat Rev Gen) Endoszimbiotikus
Evolúció. Dr. Szemethy László egyetemi docens Szent István Egyetem VadVilág Megőrzési Intézet
 Evolúció Dr. Szemethy László egyetemi docens Szent István Egyetem VadVilág Megőrzési Intézet Mi az evolúció? Egy folyamat: az élőlények tulajdonságainak változása a környezethez való alkalmazkodásra Egy
Evolúció Dr. Szemethy László egyetemi docens Szent István Egyetem VadVilág Megőrzési Intézet Mi az evolúció? Egy folyamat: az élőlények tulajdonságainak változása a környezethez való alkalmazkodásra Egy
Humán Genom Project:
 Humán Genom Project: Humán Genom Projekt: teljes emberi genom meghatározása 1953 áprilisában DNS szerkezete: Watson és Crick (Nature) 70-es évek közepe: DNS szekvenálás 2003 teljes emberi genom meghatározása
Humán Genom Project: Humán Genom Projekt: teljes emberi genom meghatározása 1953 áprilisában DNS szerkezete: Watson és Crick (Nature) 70-es évek közepe: DNS szekvenálás 2003 teljes emberi genom meghatározása
A genetikai sodródás
 A genetikai sodródás irányított, nem véletlenszerű Mindig a jobb nyer! természetes szelekció POPULÁCIÓ evolúció POPULÁCIÓ A kulcsszó: változékonyság a populáción belül POPULÁCIÓ nem irányított, véletlenszerű
A genetikai sodródás irányított, nem véletlenszerű Mindig a jobb nyer! természetes szelekció POPULÁCIÓ evolúció POPULÁCIÓ A kulcsszó: változékonyság a populáción belül POPULÁCIÓ nem irányított, véletlenszerű
A magyarok genetikai vizsgálata. Dr. Pamzsav Horolma (ISZKI)
 A magyarok genetikai vizsgálata Dr. Pamzsav Horolma (ISZKI) BEVEZETÉS Kérdés? DNS szerkezet Genetikai örökség Sejt és szervecskéi KROMOSZÓMA KÉSZLET Kariotípus: 23 pár kromoszóma 50 Mb GENOM GENOM = DNS
A magyarok genetikai vizsgálata Dr. Pamzsav Horolma (ISZKI) BEVEZETÉS Kérdés? DNS szerkezet Genetikai örökség Sejt és szervecskéi KROMOSZÓMA KÉSZLET Kariotípus: 23 pár kromoszóma 50 Mb GENOM GENOM = DNS
Populációgenetikai. alapok
 Populációgenetikai alapok Populáció = egyedek egy adott csoportja Az egyedek eltérnek egymástól morfológiailag, de viselkedésüket tekintve is = genetikai különbségek Fenotípus = külső jellegek morfológia,
Populációgenetikai alapok Populáció = egyedek egy adott csoportja Az egyedek eltérnek egymástól morfológiailag, de viselkedésüket tekintve is = genetikai különbségek Fenotípus = külső jellegek morfológia,
ADATBÁNYÁSZAT I. ÉS OMICS
 Az élettudományi-klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére TÁMOP-4.1.1.C-13/1/KONV-2014-0001 ADATBÁNYÁSZAT
Az élettudományi-klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére TÁMOP-4.1.1.C-13/1/KONV-2014-0001 ADATBÁNYÁSZAT
A replikáció mechanizmusa
 Az öröklődés molekuláris alapjai A DNS megkettőződése, a replikáció Szerk.: Vizkievicz András A DNS-molekula az élőlények örökítő anyaga, kódolt formában tartalmazza mindazon információkat, amelyek a sejt,
Az öröklődés molekuláris alapjai A DNS megkettőződése, a replikáció Szerk.: Vizkievicz András A DNS-molekula az élőlények örökítő anyaga, kódolt formában tartalmazza mindazon információkat, amelyek a sejt,
10. Genomika 2. Microarrayek és típusaik
 10. Genomika 2. 1. Microarray technikák és bioinformatikai vonatkozásaik Microarrayek és típusaik Korrelált génexpresszió mint a funkcionális genomika eszköze 2. Kombinált megközelítés a funkcionális genomikában
10. Genomika 2. 1. Microarray technikák és bioinformatikai vonatkozásaik Microarrayek és típusaik Korrelált génexpresszió mint a funkcionális genomika eszköze 2. Kombinált megközelítés a funkcionális genomikában
Proteomkutatás egy új tudományág születése
 BIOTECHNOLÓGIAI FEJLESZTÉSI POLITIKA, KUTATÁSI IRÁNYOK Proteomkutatás egy új tudományág születése Tárgyszavak: humán genom; genomika; proteomika; kutatás; fehérjeszerkezet; háromdimenziós szerkezet; gyógyszeripar.
BIOTECHNOLÓGIAI FEJLESZTÉSI POLITIKA, KUTATÁSI IRÁNYOK Proteomkutatás egy új tudományág születése Tárgyszavak: humán genom; genomika; proteomika; kutatás; fehérjeszerkezet; háromdimenziós szerkezet; gyógyszeripar.
A PKU azért nem hal ki, mert gyógyítják, és ezzel növelik a mutáns allél gyakoriságát a Huntington kór pedig azért marad fenn, mert csak későn derül
 1 Múlt órán: Genetikai alapelvek, monogénes öröklődés Elgondolkodtató feladat Vajon miért nem halnak ki az olyan mendeli öröklődésű rendellenességek, mint a Phenylketonuria, vagy a Huntington kór? A PKU
1 Múlt órán: Genetikai alapelvek, monogénes öröklődés Elgondolkodtató feladat Vajon miért nem halnak ki az olyan mendeli öröklődésű rendellenességek, mint a Phenylketonuria, vagy a Huntington kór? A PKU
A géntechnológia genetikai alapjai (I./3.)
 Az I./2. rész (Gének és funkciójuk) rövid összefoglalója A gének a DNS információt hordozó szakaszai, melyekben a 4 betű (ATCG) néhány ezerszer, vagy százezerszer ismétlődik. A gének önálló programcsomagként
Az I./2. rész (Gének és funkciójuk) rövid összefoglalója A gének a DNS információt hordozó szakaszai, melyekben a 4 betű (ATCG) néhány ezerszer, vagy százezerszer ismétlődik. A gének önálló programcsomagként
Genetika. Tartárgyi adatlap: tantárgy adatai
 Genetika Előadás a I. éves Génsebészet szakos hallgatók számára Tartárgyi adatlap: tantárgy adatai 2.1. Tantárgy címe Genetika 2.2. Előadás felelőse Dr. Mara Gyöngyvér, docens 2.3. Egyéb oktatási tevékenységek
Genetika Előadás a I. éves Génsebészet szakos hallgatók számára Tartárgyi adatlap: tantárgy adatai 2.1. Tantárgy címe Genetika 2.2. Előadás felelőse Dr. Mara Gyöngyvér, docens 2.3. Egyéb oktatási tevékenységek
Sodródás Evolúció neutrális elmélete
 Sodródás Evolúció neutrális elmélete Egy kísérlet Drosophila Drosophila pseudoobscura 8 hím + 8 nőstény/tenyészet 107 darab tenyészet Minden tenyészet csak heterozigóta egyedekkel indul a neutrális szemszín
Sodródás Evolúció neutrális elmélete Egy kísérlet Drosophila Drosophila pseudoobscura 8 hím + 8 nőstény/tenyészet 107 darab tenyészet Minden tenyészet csak heterozigóta egyedekkel indul a neutrális szemszín
Az emberi erőforrás értéke
 Szabó László SZABÓ LÁSZLÓ Az emberi erőforrás értéke A génvizsgálat, mint egészségügyi prevenció Az emberi tényező fontos elem a stratégiai kezdeményezésekben, a versenyelőny megszerzésében és megtartásában.
Szabó László SZABÓ LÁSZLÓ Az emberi erőforrás értéke A génvizsgálat, mint egészségügyi prevenció Az emberi tényező fontos elem a stratégiai kezdeményezésekben, a versenyelőny megszerzésében és megtartásában.
Cserző Miklós Bioinformatika és genomanalízis az orvostudományban. Integrált biológiai adatbázisok
 Bioinformatika és genomanalízis az orvostudományban Integrált biológiai adatbázisok Cserző Miklós 2018 A mai előadás A genom annotálás jelentősége Genome Reference Consortium Gene Ontology Az ensembl pipeline
Bioinformatika és genomanalízis az orvostudományban Integrált biológiai adatbázisok Cserző Miklós 2018 A mai előadás A genom annotálás jelentősége Genome Reference Consortium Gene Ontology Az ensembl pipeline
A HUMÁNGENETIKA LEGÚJABB EREDMÉNYEI Péterfy Miklós
 A HUMÁNGENETIKA LEGÚJABB EREDMÉNYEI Péterfy Miklós Összefoglalás A humángenetika korunk egyik legdinamikusabban fejlődő tudományága. Ennek a fejlődésnek legfőbb mozgatórugója az, hogy a humángenetika,
A HUMÁNGENETIKA LEGÚJABB EREDMÉNYEI Péterfy Miklós Összefoglalás A humángenetika korunk egyik legdinamikusabban fejlődő tudományága. Ennek a fejlődésnek legfőbb mozgatórugója az, hogy a humángenetika,
Humán genom variációk single nucleotide polymorphism (SNP)
 Humán genom variációk single nucleotide polymorphism (SNP) A genom ~ 97 %-a két különböző egyedben teljesen azonos ~ 1% különbség: SNP miatt ~2% különbség: kópiaszámbeli eltérés, deléciók miatt 11-12 millió
Humán genom variációk single nucleotide polymorphism (SNP) A genom ~ 97 %-a két különböző egyedben teljesen azonos ~ 1% különbség: SNP miatt ~2% különbség: kópiaszámbeli eltérés, deléciók miatt 11-12 millió
Hamar Péter. RNS világ. Lánczos Kornél Gimnázium, Székesfehérvár, 2014. október 21. www.meetthescientist.hu 1 26
 Hamar Péter RNS világ Lánczos Kornél Gimnázium, Székesfehérvár, 2014. október 21. 1 26 Főszereplők: DNS -> RNS -> fehérje A kód lefordítása Dezoxy-ribo-Nuklein-Sav: DNS az élet kódja megkettőződés (replikáció)
Hamar Péter RNS világ Lánczos Kornél Gimnázium, Székesfehérvár, 2014. október 21. 1 26 Főszereplők: DNS -> RNS -> fehérje A kód lefordítása Dezoxy-ribo-Nuklein-Sav: DNS az élet kódja megkettőződés (replikáció)
10. CSI. A molekuláris biológiai technikák alkalmazásai
 10. CSI. A molekuláris biológiai technikák alkalmazásai A DNS mint azonosító 3 milliárd bázispár az emberi DNS-ben (99.9%-ban azonos) 0.1%-nyi különbség elegendő az egyedek megkülönböztetéséhez Genetikai
10. CSI. A molekuláris biológiai technikák alkalmazásai A DNS mint azonosító 3 milliárd bázispár az emberi DNS-ben (99.9%-ban azonos) 0.1%-nyi különbség elegendő az egyedek megkülönböztetéséhez Genetikai
Diagnosztikai célú molekuláris biológiai vizsgálatok
 Diagnosztikai célú molekuláris biológiai vizsgálatok Dr. Patócs Attila, PhD MTA-SE Molekuláris Medicina Kutatócsoport, Semmelweis Egyetem II. sz. Belgyógyászati Klinika Laboratóriumi Medicina Intézet Genetikai
Diagnosztikai célú molekuláris biológiai vizsgálatok Dr. Patócs Attila, PhD MTA-SE Molekuláris Medicina Kutatócsoport, Semmelweis Egyetem II. sz. Belgyógyászati Klinika Laboratóriumi Medicina Intézet Genetikai
Johann Gregor Mendel Az olmüci (Olomouc) és bécsi egyetem diákja Brünni ágostonrendi apát (nem szovjet tudós) Tudatos és nagyon alapos kutat
 10.2.2010 genmisk1 1 Áttekintés Mendel és a mendeli törvények Mendel előtt és körül A genetika törvényeinek újbóli felfedezése és a kromoszómák Watson és Crick a molekuláris biológoa központi dogmája 10.2.2010
10.2.2010 genmisk1 1 Áttekintés Mendel és a mendeli törvények Mendel előtt és körül A genetika törvényeinek újbóli felfedezése és a kromoszómák Watson és Crick a molekuláris biológoa központi dogmája 10.2.2010
MUTÁCIÓK. A mutáció az örökítő anyag spontán, maradandó megváltozása, amelynek során új genetikai tulajdonság keletkezik.
 MUTÁCIÓK A mutáció az örökítő anyag spontán, maradandó megváltozása, amelynek során új genetikai tulajdonság keletkezik. Pontmutáció: A kromoszóma egy génjében pár nukleotidnál következik be változás.
MUTÁCIÓK A mutáció az örökítő anyag spontán, maradandó megváltozása, amelynek során új genetikai tulajdonság keletkezik. Pontmutáció: A kromoszóma egy génjében pár nukleotidnál következik be változás.
Poligénes v. kantitatív öröklődés
 1. Öröklődés komplexebb sajátosságai 2. Öröklődés molekuláris alapja Poligénes v. kantitatív öröklődés Azok a tulajdonságokat amelyek mértékegységgel nem, vagy csak nehezen mérhetők, kialakulásuk kevéssé
1. Öröklődés komplexebb sajátosságai 2. Öröklődés molekuláris alapja Poligénes v. kantitatív öröklődés Azok a tulajdonságokat amelyek mértékegységgel nem, vagy csak nehezen mérhetők, kialakulásuk kevéssé
RNS-ek. 1. Az ősi RNS Világ: - az élet hajnalán. 2. Egy már ismert RNS Világ: - a fehérjeszintézis ben résztvevő RNS-ek
 RNS-ek RNS-ek 1. Az ősi RNS Világ: - az élet hajnalán 2. Egy már ismert RNS Világ: - a fehérjeszintézis ben résztvevő RNS-ek 3. Egy újonnan felfedezett RNS Világ: - szabályozó RNS-ek 4. Transzkripció Ősi
RNS-ek RNS-ek 1. Az ősi RNS Világ: - az élet hajnalán 2. Egy már ismert RNS Világ: - a fehérjeszintézis ben résztvevő RNS-ek 3. Egy újonnan felfedezett RNS Világ: - szabályozó RNS-ek 4. Transzkripció Ősi
Prenatalis diagnosztika lehetőségei mikor, hogyan, miért? Dr. Almássy Zsuzsanna Heim Pál Kórház, Budapest Toxikológia és Anyagcsere Osztály
 Prenatalis diagnosztika lehetőségei mikor, hogyan, miért? Dr. Almássy Zsuzsanna Heim Pál Kórház, Budapest Toxikológia és Anyagcsere Osztály Definíció A prenatális diagnosztika a klinikai genetika azon
Prenatalis diagnosztika lehetőségei mikor, hogyan, miért? Dr. Almássy Zsuzsanna Heim Pál Kórház, Budapest Toxikológia és Anyagcsere Osztály Definíció A prenatális diagnosztika a klinikai genetika azon
Juhász Angéla MTA ATK MI Alkalmazott Genomikai Osztály SZEKVENCIA ADATBÁZISOK
 Juhász Angéla MTA ATK MI Alkalmazott Genomikai Osztály SZEKVENCIA ADATBÁZISOK Fehérjét kódol? Tulajdonságai? -Hol lokalizálódik? -Oldható? -3D szerkezete? -Accession #? -Annotációja elérhető? Már benne
Juhász Angéla MTA ATK MI Alkalmazott Genomikai Osztály SZEKVENCIA ADATBÁZISOK Fehérjét kódol? Tulajdonságai? -Hol lokalizálódik? -Oldható? -3D szerkezete? -Accession #? -Annotációja elérhető? Már benne
A gidrán fajta genetikai változatosságának jellemzése mitokondriális DNS polimorfizmusokkal Kusza Szilvia Sziszkosz Nikolett Mihók Sándor,
 1 A gidrán fajta genetikai változatosságának jellemzése mitokondriális DNS polimorfizmusokkal Kusza Szilvia Sziszkosz Nikolett Mihók Sándor, (Debreceni Egyetem Állattenyésztéstani Tanszék) A bármilyen
1 A gidrán fajta genetikai változatosságának jellemzése mitokondriális DNS polimorfizmusokkal Kusza Szilvia Sziszkosz Nikolett Mihók Sándor, (Debreceni Egyetem Állattenyésztéstani Tanszék) A bármilyen
NUKLEINSAVAK. Nukleinsav: az élő szervezetek sejtmagvában és a citoplazmában található, az átöröklésben szerepet játszó, nagy molekulájú anyag
 NUKLEINSAVAK Nukleinsav: az élő szervezetek sejtmagvában és a citoplazmában található, az átöröklésben szerepet játszó, nagy molekulájú anyag RNS = Ribonukleinsav DNS = Dezoxi-ribonukleinsav A nukleinsavak
NUKLEINSAVAK Nukleinsav: az élő szervezetek sejtmagvában és a citoplazmában található, az átöröklésben szerepet játszó, nagy molekulájú anyag RNS = Ribonukleinsav DNS = Dezoxi-ribonukleinsav A nukleinsavak
Hátterükben egyetlen gén áll, melynek általában számottevő a viselkedésre gyakorolt hatása, öröklési mintázata jellegzetes.
 Múlt órán: Lehetséges tesztfeladatok: Kitől származik a variáció-szelekció paradigma, mely szerint az egyéni, javarészt öröklött különbségek között a társadalmi harc válogat? Fromm-Reichmann Mill Gallton
Múlt órán: Lehetséges tesztfeladatok: Kitől származik a variáció-szelekció paradigma, mely szerint az egyéni, javarészt öröklött különbségek között a társadalmi harc válogat? Fromm-Reichmann Mill Gallton
A genetikai vizsgálatok jelene, jövője a Ritka Betegségek vonatkozásában
 Budapest, 2014. február 22. Ritka Betegségek Világnapja A genetikai vizsgálatok jelene, jövője a Ritka Betegségek vonatkozásában dr. Kósa János PentaCore Laboratórium, Budapest Semmelweis Egyetem I. sz.
Budapest, 2014. február 22. Ritka Betegségek Világnapja A genetikai vizsgálatok jelene, jövője a Ritka Betegségek vonatkozásában dr. Kósa János PentaCore Laboratórium, Budapest Semmelweis Egyetem I. sz.
Az evolúció folyamatos változások olyan sorozata, melynek során bizonyos populációk öröklődő jellegei nemzedékről nemzedékre változnak.
 Evolúció Az evolúció folyamatos változások olyan sorozata, melynek során bizonyos populációk öröklődő jellegei nemzedékről nemzedékre változnak. Latin eredetű szó, jelentése: kibontakozás Időben egymást
Evolúció Az evolúció folyamatos változások olyan sorozata, melynek során bizonyos populációk öröklődő jellegei nemzedékről nemzedékre változnak. Latin eredetű szó, jelentése: kibontakozás Időben egymást
Genomadatbázisok Ld. Entrez Genome: Összes ismert genom, hierarchikus szervezésben (kromoszóma, térképek, gének, stb.)
 Genomika Új korszak, paradigmaváltás, forradalom: a teljes genomok ismeretében a biológia adatokban gazdag tudománnyá válik. Új kutatási módszerek, új szemlélet. Hajtóerõk: Genomszekvenálási projektek
Genomika Új korszak, paradigmaváltás, forradalom: a teljes genomok ismeretében a biológia adatokban gazdag tudománnyá válik. Új kutatási módszerek, új szemlélet. Hajtóerõk: Genomszekvenálási projektek
TEMATIKA Biokémia és molekuláris biológia IB kurzus (bb5t1301)
 Biokémia és molekuláris biológia I. kurzus (bb5t1301) Tematika 1 TEMATIKA Biokémia és molekuláris biológia IB kurzus (bb5t1301) 0. Bevezető A (a biokémiáról) (~40 perc: 1. heti előadás) A BIOkémia tárgya
Biokémia és molekuláris biológia I. kurzus (bb5t1301) Tematika 1 TEMATIKA Biokémia és molekuláris biológia IB kurzus (bb5t1301) 0. Bevezető A (a biokémiáról) (~40 perc: 1. heti előadás) A BIOkémia tárgya
Immunológia 4. A BCR diverzitás kialakulása
 Immunológia 4. A BCR diverzitás kialakulása 2017. október 4. Bajtay Zsuzsa A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja
Immunológia 4. A BCR diverzitás kialakulása 2017. október 4. Bajtay Zsuzsa A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja
Példák a független öröklődésre
 GENETIKAI PROBLÉMÁK Példák a független öröklődésre Az amelogenesis imperfecta egy, a fogzománc gyengeségével és elszíneződésével járó öröklődő betegség, a 4-es kromoszómán lévő enam gén recesszív mutációja
GENETIKAI PROBLÉMÁK Példák a független öröklődésre Az amelogenesis imperfecta egy, a fogzománc gyengeségével és elszíneződésével járó öröklődő betegség, a 4-es kromoszómán lévő enam gén recesszív mutációja
Evolúcióelmélet és az evolúció mechanizmusai
 Evolúcióelmélet és az evolúció mechanizmusai Az élet Darwini szemlélete Melyek az evolúció bizonyítékai a világban? EVOLÚCIÓ: VÁLTOZATOSSÁG Mutáció Horizontális géntranszfer Genetikai rekombináció Rekombináció
Evolúcióelmélet és az evolúció mechanizmusai Az élet Darwini szemlélete Melyek az evolúció bizonyítékai a világban? EVOLÚCIÓ: VÁLTOZATOSSÁG Mutáció Horizontális géntranszfer Genetikai rekombináció Rekombináció
ÚJ GENERÁCIÓS SZEKVENÁLÁS
 VÍZMIKROBIOLÓGUSOK XI. ORSZÁGOS KONFERENCIÁJA - 2012 ÚJ GENERÁCIÓS SZEKVENÁLÁS LEHETŐSÉG, VAGY NEHÉZSÉG? MÁRIALIGETI KÁROLY EÖTVÖS LORÁND TUDOMÁNYEGYETEM, BUDAPEST 1953 JAMES D. WATSON, FRANCIS CRICK:
VÍZMIKROBIOLÓGUSOK XI. ORSZÁGOS KONFERENCIÁJA - 2012 ÚJ GENERÁCIÓS SZEKVENÁLÁS LEHETŐSÉG, VAGY NEHÉZSÉG? MÁRIALIGETI KÁROLY EÖTVÖS LORÁND TUDOMÁNYEGYETEM, BUDAPEST 1953 JAMES D. WATSON, FRANCIS CRICK:
A genomiális medicina szép új világa
 A genomiális medicina szép új világa HALADÁS A REUMATOLÓGIA, IMMUNOLÓGIA ÉS OSTEOLÓGIA TERÜLETÉN 2012 2014 2015. ÁPRILIS 16. Falus András Semmelweis Egyetem Genetikai Sejt és Immunbiológiai Intézet A medicina
A genomiális medicina szép új világa HALADÁS A REUMATOLÓGIA, IMMUNOLÓGIA ÉS OSTEOLÓGIA TERÜLETÉN 2012 2014 2015. ÁPRILIS 16. Falus András Semmelweis Egyetem Genetikai Sejt és Immunbiológiai Intézet A medicina
TARTALOM. Előszó 9 BEVEZETÉS A BIOLÓGIÁBA
 Előszó 9 BEVEZETÉS A BIOLÓGIÁBA A biológia tudománya, az élőlények rendszerezése 11 Vizsgálati módszerek, vizsgálati eszközök 12 Az élet jellemzői, az élő rendszerek 13 Szerveződési szintek 14 EGYED ALATTI
Előszó 9 BEVEZETÉS A BIOLÓGIÁBA A biológia tudománya, az élőlények rendszerezése 11 Vizsgálati módszerek, vizsgálati eszközök 12 Az élet jellemzői, az élő rendszerek 13 Szerveződési szintek 14 EGYED ALATTI
A proteomika új tudománya és alkalmazása a rákdiagnosztikában
 BIOTECHNOLÓGIAI FEJLESZTÉSI POLITIKA, KUTATÁSI IRÁNYOK A proteomika új tudománya és alkalmazása a rákdiagnosztikában Tárgyszavak: proteom; proteomika; rák; diagnosztika; molekuláris gyógyászat; biomarker;
BIOTECHNOLÓGIAI FEJLESZTÉSI POLITIKA, KUTATÁSI IRÁNYOK A proteomika új tudománya és alkalmazása a rákdiagnosztikában Tárgyszavak: proteom; proteomika; rák; diagnosztika; molekuláris gyógyászat; biomarker;
Zárójelentés. Állati rotavírusok összehasonlító genomvizsgálata. c. OTKA kutatási programról. Bányai Krisztián (MTA ATK ÁOTI)
 Zárójelentés Állati rotavírusok összehasonlító genomvizsgálata c. OTKA kutatási programról Bányai Krisztián (MTA ATK ÁOTI) 2012 1 Az Állati rotavírusok összehasonlító genomvizsgálata c. programban azt
Zárójelentés Állati rotavírusok összehasonlító genomvizsgálata c. OTKA kutatási programról Bányai Krisztián (MTA ATK ÁOTI) 2012 1 Az Állati rotavírusok összehasonlító genomvizsgálata c. programban azt
GENOMIKA TÖBBFÉLE MAKROMOLEKULA VIZSGÁLATA EGYIDŐBEN
 GENOMIKA TÖBBFÉLE MAKROMOLEKULA VIZSGÁLATA EGYIDŐBEN Strukturális genomika Genomkönyvtárak DNS szekvenálás Genom programok Polimorfizmusok RFLP DNS könyvtár készítés humán genom 1. Emésztés RE-kal Emberi
GENOMIKA TÖBBFÉLE MAKROMOLEKULA VIZSGÁLATA EGYIDŐBEN Strukturális genomika Genomkönyvtárak DNS szekvenálás Genom programok Polimorfizmusok RFLP DNS könyvtár készítés humán genom 1. Emésztés RE-kal Emberi
A funkcionális genomikai eszköztár szerepe az onkológiai kutatásokban
 Összefoglaló közlemény 21 A funkcionális genomikai eszköztár szerepe az onkológiai kutatásokban Bálint Bálint L. 1, Nagy László 1,2 1 Debreceni Egyetem Orvos- és Egészségtudományi Centrum, Biokémiai és
Összefoglaló közlemény 21 A funkcionális genomikai eszköztár szerepe az onkológiai kutatásokban Bálint Bálint L. 1, Nagy László 1,2 1 Debreceni Egyetem Orvos- és Egészségtudományi Centrum, Biokémiai és
Génkifejeződési vizsgálatok. Kocsy Gábor
 Génkifejeződési vizsgálatok MTA Mezőgazdasági Kutatóintézete Növényi Molekuláris Biológia Osztály A génkifejeződés A sejtmag géneket tartalmaz; (fehérjéket, RNSeket kódoló); A gének átíródnak mrns; Pre-mRNS
Génkifejeződési vizsgálatok MTA Mezőgazdasági Kutatóintézete Növényi Molekuláris Biológia Osztály A génkifejeződés A sejtmag géneket tartalmaz; (fehérjéket, RNSeket kódoló); A gének átíródnak mrns; Pre-mRNS
Genetika 2. előadás. Bevezető
 Genetika 2. előadás Genetikai alapelvek: hogyan öröklődnek a tulajdonságok Mendeli genetika Bevezető Mi okozza a hasonlóságokat és különbségeket a családtagok között? Gének: biológiai információ alapegysége
Genetika 2. előadás Genetikai alapelvek: hogyan öröklődnek a tulajdonságok Mendeli genetika Bevezető Mi okozza a hasonlóságokat és különbségeket a családtagok között? Gének: biológiai információ alapegysége
4. A humorális immunválasz október 12.
 4. A humorális immunválasz 2016. október 12. A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja a limfocitát A keletkező
4. A humorális immunválasz 2016. október 12. A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja a limfocitát A keletkező
3. Általános egészségügyi ismeretek az egyes témákhoz kapcsolódóan
 11. évfolyam BIOLÓGIA 1. Az emberi test szabályozása Idegi szabályozás Hormonális szabályozás 2. Az érzékelés Szaglás, tapintás, látás, íz érzéklés, 3. Általános egészségügyi ismeretek az egyes témákhoz
11. évfolyam BIOLÓGIA 1. Az emberi test szabályozása Idegi szabályozás Hormonális szabályozás 2. Az érzékelés Szaglás, tapintás, látás, íz érzéklés, 3. Általános egészségügyi ismeretek az egyes témákhoz
Mit tud a genetika. Génterápiás lehetőségek MPS-ben. Dr. Varga Norbert
 Mit tud a genetika Génterápiás lehetőségek MPS-ben Dr. Varga Norbert Oki terápia Terápiás lehetőségek MPS-ben A kiváltó okot gyógyítja meg ERT Enzimpótló kezelés Őssejt transzplantáció Genetikai beavatkozások
Mit tud a genetika Génterápiás lehetőségek MPS-ben Dr. Varga Norbert Oki terápia Terápiás lehetőségek MPS-ben A kiváltó okot gyógyítja meg ERT Enzimpótló kezelés Őssejt transzplantáció Genetikai beavatkozások
Epigenetikai Szabályozás
 Epigenetikai Szabályozás Kromatin alapegysége a nukleoszóma 1. DNS Linker DNS Nukleoszóma mag H1 DNS 10 nm 30 nm Nukleoszóma gyöngy (4x2 hiszton molekula + 146 nukleotid pár) 10 nm-es szál 30 nm-es szál
Epigenetikai Szabályozás Kromatin alapegysége a nukleoszóma 1. DNS Linker DNS Nukleoszóma mag H1 DNS 10 nm 30 nm Nukleoszóma gyöngy (4x2 hiszton molekula + 146 nukleotid pár) 10 nm-es szál 30 nm-es szál
SOLiD Technology. library preparation & Sequencing Chemistry (sequencing by ligation!) Imaging and analysis. Application specific sample preparation
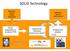 SOLiD Technology Application specific sample preparation Application specific data analysis library preparation & emulsion PCR Sequencing Chemistry (sequencing by ligation!) Imaging and analysis SOLiD
SOLiD Technology Application specific sample preparation Application specific data analysis library preparation & emulsion PCR Sequencing Chemistry (sequencing by ligation!) Imaging and analysis SOLiD
Dobzhansky: In Biology nothing makes sense except in the light of Evolution.
 Dobzhansky: In Biology nothing makes sense except in the light of Evolution. Az Evolúcióbiológia Története Molnár István im54@invitel.hu Mai témák 1. Mi az evolúció? 2. Hogyan alakult ki a mai evolúciós
Dobzhansky: In Biology nothing makes sense except in the light of Evolution. Az Evolúcióbiológia Története Molnár István im54@invitel.hu Mai témák 1. Mi az evolúció? 2. Hogyan alakult ki a mai evolúciós
INCZÉDY GYÖRGY SZAKKÖZÉPISKOLA, SZAKISKOLA ÉS KOLLÉGIUM
 INCZÉDY GYÖRGY SZAKKÖZÉPISKOLA, SZAKISKOLA ÉS KOLLÉGIUM Szakközépiskola Tesztlapok Biológia - egészségtan tantárgy 12. évfolyam Készítette: Perinecz Anasztázia Név: Osztály: 1. témakör: Az élet kódja.
INCZÉDY GYÖRGY SZAKKÖZÉPISKOLA, SZAKISKOLA ÉS KOLLÉGIUM Szakközépiskola Tesztlapok Biológia - egészségtan tantárgy 12. évfolyam Készítette: Perinecz Anasztázia Név: Osztály: 1. témakör: Az élet kódja.
BIOLÓGIA HÁZIVERSENY 1. FORDULÓ BIOKÉMIA, GENETIKA BIOKÉMIA, GENETIKA
 BIOKÉMIA, GENETIKA 1. Nukleinsavak keresztrejtvény (12+1 p) 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 1. A nukleinsavak a.-ok összekapcsolódásával kialakuló polimerek. 2. Purinvázas szerves bázis, amely az
BIOKÉMIA, GENETIKA 1. Nukleinsavak keresztrejtvény (12+1 p) 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 1. A nukleinsavak a.-ok összekapcsolódásával kialakuló polimerek. 2. Purinvázas szerves bázis, amely az
BIOLÓGIA OSZTÁLYOZÓ VIZSGA ÉS JAVÍTÓVIZSGA KÖVETELMÉNYEK (2016)
 BIOLÓGIA OSZTÁLYOZÓ VIZSGA ÉS JAVÍTÓVIZSGA KÖVETELMÉNYEK (2016) 1 Biológia tantárgyból mindhárom évfolyamon (10.-11.-12.) írásbeli és szóbeli vizsga van. A vizsga részei írásbeli szóbeli Írásbeli Szóbeli
BIOLÓGIA OSZTÁLYOZÓ VIZSGA ÉS JAVÍTÓVIZSGA KÖVETELMÉNYEK (2016) 1 Biológia tantárgyból mindhárom évfolyamon (10.-11.-12.) írásbeli és szóbeli vizsga van. A vizsga részei írásbeli szóbeli Írásbeli Szóbeli
Biológiai feladatbank 12. évfolyam
 Biológiai feladatbank 12. évfolyam A pedagógus neve: A pedagógus szakja: Az iskola neve: Műveltségi terület: Tantárgy: A tantárgy cél és feladatrendszere: Tantárgyi kapcsolatok: Osztály: 12. Felhasznált
Biológiai feladatbank 12. évfolyam A pedagógus neve: A pedagógus szakja: Az iskola neve: Műveltségi terület: Tantárgy: A tantárgy cél és feladatrendszere: Tantárgyi kapcsolatok: Osztály: 12. Felhasznált
Immunitás és evolúció
 Immunitás és evolúció (r)evolúció az immunrendszerben Az immunrendszer evolúciója Müller Viktor ELTE Növényrendszertani, Ökológiai és Elméleti Biológiai Tanszék http://ramet.elte.hu/~viktor Az immunitás
Immunitás és evolúció (r)evolúció az immunrendszerben Az immunrendszer evolúciója Müller Viktor ELTE Növényrendszertani, Ökológiai és Elméleti Biológiai Tanszék http://ramet.elte.hu/~viktor Az immunitás
Biológus MSc. Molekuláris biológiai alapismeretek
 Biológus MSc Molekuláris biológiai alapismeretek A nukleotidok építőkövei A nukleotidok szerkezete Nukleotid = N-tartalmú szerves bázis + pentóz + foszfát N-glikozidos kötés 5 1 4 2 3 (Foszfát)észter-kötés
Biológus MSc Molekuláris biológiai alapismeretek A nukleotidok építőkövei A nukleotidok szerkezete Nukleotid = N-tartalmú szerves bázis + pentóz + foszfát N-glikozidos kötés 5 1 4 2 3 (Foszfát)észter-kötés
++ mm. +m +m +m +m. Hh,fF Hh,fF hh,ff hh,ff. ff Ff. Hh hh. ff ff ff ff. Hh Hh hh hh
 Múlt órán: Genetikai alapelvek, monogénes öröklődés Elgondolkodtató feladat Vajon miért nem halnak ki az olyan mendeli öröklődésű rendellenességek, mint a Phenylketonuria, vagy a Huntington kór? A PKU
Múlt órán: Genetikai alapelvek, monogénes öröklődés Elgondolkodtató feladat Vajon miért nem halnak ki az olyan mendeli öröklődésű rendellenességek, mint a Phenylketonuria, vagy a Huntington kór? A PKU
Intelligens Rendszerek Elmélete. Párhuzamos keresés genetikus algoritmusokkal
 Intelligens Rendszerek Elmélete Dr. Kutor László Párhuzamos keresés genetikus algoritmusokkal http://mobil.nik.bmf.hu/tantargyak/ire.html login: ire jelszó: IRE0 IRE / A természet általános kereső algoritmusa:
Intelligens Rendszerek Elmélete Dr. Kutor László Párhuzamos keresés genetikus algoritmusokkal http://mobil.nik.bmf.hu/tantargyak/ire.html login: ire jelszó: IRE0 IRE / A természet általános kereső algoritmusa:
transzláció DNS RNS Fehérje A fehérjék jelenléte nélkülözhetetlen minden sejt számára: enzimek, szerkezeti fehérjék, transzportfehérjék
 Transzláció A molekuláris biológia centrális dogmája transzkripció transzláció DNS RNS Fehérje replikáció Reverz transzkriptáz A fehérjék jelenléte nélkülözhetetlen minden sejt számára: enzimek, szerkezeti
Transzláció A molekuláris biológia centrális dogmája transzkripció transzláció DNS RNS Fehérje replikáció Reverz transzkriptáz A fehérjék jelenléte nélkülözhetetlen minden sejt számára: enzimek, szerkezeti
Miben különbözünk az egértől? Szabályozás a molekuláris biológiában
 Az atomoktól a csillagokig, 2010. október 28., ELTE Fizikai Intézet Miben különbözünk az egértől? Szabályozás a molekuláris biológiában brainmaps.org Homo sapiens (Miroslav Klose) Mus musculus Farkas Illés
Az atomoktól a csillagokig, 2010. október 28., ELTE Fizikai Intézet Miben különbözünk az egértől? Szabályozás a molekuláris biológiában brainmaps.org Homo sapiens (Miroslav Klose) Mus musculus Farkas Illés
DNS-szekvencia meghatározás
 DNS-szekvencia meghatározás Gilbert 1980 (1958) Sanger 3-1 A DNS-polimerázok jellemzői 5'-3' polimeráz aktivitás 5'-3' exonukleáz 3'-5' exonukleáz aktivitás Az új szál szintéziséhez kell: templát DNS primer
DNS-szekvencia meghatározás Gilbert 1980 (1958) Sanger 3-1 A DNS-polimerázok jellemzői 5'-3' polimeráz aktivitás 5'-3' exonukleáz 3'-5' exonukleáz aktivitás Az új szál szintéziséhez kell: templát DNS primer
- Conrad Hal Waddington számára a gének fizikai háttere még ismeretlen volt (Watson-Crick-Franklin 1953), így próbálta leírni a sejt specializációt=>
 1 - Conrad Hal Waddington számára a gének fizikai háttere még ismeretlen volt (Watson-Crick-Franklin 1953), így próbálta leírni a sejt specializációt=> a sejtek sorsa meg van határozva, mint egy üveggolyó,
1 - Conrad Hal Waddington számára a gének fizikai háttere még ismeretlen volt (Watson-Crick-Franklin 1953), így próbálta leírni a sejt specializációt=> a sejtek sorsa meg van határozva, mint egy üveggolyó,
Bioinformatika és genomanalízis az orvostudományban. Biológiai adatbázisok. Cserző Miklós 2018
 Bioinformatika és genomanalízis az orvostudományban Biológiai adatbázisok Cserző Miklós 2018 A mai előadás Mi az adatbázis A biológia kapcsolata az adatbázisokkal Az adatbázisok típusai Adatbázis formátumok,
Bioinformatika és genomanalízis az orvostudományban Biológiai adatbázisok Cserző Miklós 2018 A mai előadás Mi az adatbázis A biológia kapcsolata az adatbázisokkal Az adatbázisok típusai Adatbázis formátumok,
12/4/2014. Genetika 7-8 ea. DNS szerkezete, replikáció és a rekombináció. 1952 Hershey & Chase 1953!!!
 Genetika 7-8 ea. DNS szerkezete, replikáció és a rekombináció 1859 1865 1869 1952 Hershey & Chase 1953!!! 1879 1903 1951 1950 1944 1928 1911 1 1. DNS szerkezete Mi az örökítő anyag? Friedrich Miescher
Genetika 7-8 ea. DNS szerkezete, replikáció és a rekombináció 1859 1865 1869 1952 Hershey & Chase 1953!!! 1879 1903 1951 1950 1944 1928 1911 1 1. DNS szerkezete Mi az örökítő anyag? Friedrich Miescher
Közös stratégia kifejlesztése molekuláris módszerek alkalmazásával a rák kezelésére Magyarországon és Norvégiában
 Norvég Finanszírozási Mechanizmus által támogatott projekt Közös stratégia kifejlesztése molekuláris módszerek alkalmazásával a rák kezelésére Magyarországon és Norvégiában Norvég Alap támogatással javul
Norvég Finanszírozási Mechanizmus által támogatott projekt Közös stratégia kifejlesztése molekuláris módszerek alkalmazásával a rák kezelésére Magyarországon és Norvégiában Norvég Alap támogatással javul
Populációgenetikai vizsgálatok eredményei hangulatzavarokban. Képalkotó vizsgálatok alkalmazása a neuropszichofarmakológiában
 Populációgenetikai vizsgálatok eredményei hangulatzavarokban Képalkotó vizsgálatok alkalmazása a neuropszichofarmakológiában Juhász Gabriella Semmelweis Egyetem, GYTK, Gyógyszerhatástani Intézet Neuroscience
Populációgenetikai vizsgálatok eredményei hangulatzavarokban Képalkotó vizsgálatok alkalmazása a neuropszichofarmakológiában Juhász Gabriella Semmelweis Egyetem, GYTK, Gyógyszerhatástani Intézet Neuroscience
Bevezetés a rendszerbiológiába
 Bevezetés a rendszerbiológiába Papp Balázs http://group.szbk.u-szeged.hu/sysbiol/ MTA Szegedi Biológiai Központja Biokémiai Intézet Alapprobléma Ma a biológiában rengeteg adat termelődik és áll rendelkezésre.
Bevezetés a rendszerbiológiába Papp Balázs http://group.szbk.u-szeged.hu/sysbiol/ MTA Szegedi Biológiai Központja Biokémiai Intézet Alapprobléma Ma a biológiában rengeteg adat termelődik és áll rendelkezésre.
Molekuláris biológiai módszerek alkalmazása a biológiai környezeti kármentesítésben
 Molekuláris biológiai módszerek alkalmazása a biológiai környezeti kármentesítésben Dr. Kovács Tamás, Kovács Árpád László Kármentesítés Aktuális Kérdései 2013 Budapest, 2013.03.21-22 Bioremediáció során
Molekuláris biológiai módszerek alkalmazása a biológiai környezeti kármentesítésben Dr. Kovács Tamás, Kovács Árpád László Kármentesítés Aktuális Kérdései 2013 Budapest, 2013.03.21-22 Bioremediáció során
Fogyatékossággal élő emberek életminősége és ellátási költségei különböző lakhatási formákban
 Fogyatékossággal élő emberek életminősége és ellátási költségei különböző lakhatási formákban Zárótanulmány a VP/2013/013/0057 azonosítószámú New dimension in social protection towards community based
Fogyatékossággal élő emberek életminősége és ellátási költségei különböző lakhatási formákban Zárótanulmány a VP/2013/013/0057 azonosítószámú New dimension in social protection towards community based
13. RNS szintézis és splicing
 13. RNS szintézis és splicing 1 Visszatekintés: Az RNS típusai és szerkezete Hírvivő RNS = mrns (messenger RNA = mrna) : fehérjeszintézis pre-mrns érett mrns (intronok kivágódnak = splicing) Transzfer
13. RNS szintézis és splicing 1 Visszatekintés: Az RNS típusai és szerkezete Hírvivő RNS = mrns (messenger RNA = mrna) : fehérjeszintézis pre-mrns érett mrns (intronok kivágódnak = splicing) Transzfer
NÖVÉNYGENETIKA. Az Agrármérnöki MSc szak tananyagfejlesztése TÁMOP /1/A
 NÖVÉNYGENETIKA Az Agrármérnöki MSc szak tananyagfejlesztése TÁMOP-4.1.2-08/1/A-2009-0010 A citológia és a genetika társtudománya Citogenetika A kromoszómák eredetét, szerkezetét, genetikai funkcióját,
NÖVÉNYGENETIKA Az Agrármérnöki MSc szak tananyagfejlesztése TÁMOP-4.1.2-08/1/A-2009-0010 A citológia és a genetika társtudománya Citogenetika A kromoszómák eredetét, szerkezetét, genetikai funkcióját,
VIII. Magyar Sejtanalitikai Konferencia Fény a kutatásban és a diagnosztikában
 VIII. Magyar Sejtanalitikai Konferencia Fény a kutatásban és a diagnosztikában Budapest, 2015. szeptember 3 5. Semmelweis Egyetem II. sz. Belgyógyászati Klinika, valamint I. sz. Patológiai és Kísérleti
VIII. Magyar Sejtanalitikai Konferencia Fény a kutatásban és a diagnosztikában Budapest, 2015. szeptember 3 5. Semmelweis Egyetem II. sz. Belgyógyászati Klinika, valamint I. sz. Patológiai és Kísérleti
Biomatematika 13. Varianciaanaĺızis (ANOVA)
 Szent István Egyetem Állatorvos-tudományi Kar Biomatematikai és Számítástechnikai Tanszék Biomatematika 13. Varianciaanaĺızis (ANOVA) Fodor János Copyright c Fodor.Janos@aotk.szie.hu Last Revision Date:
Szent István Egyetem Állatorvos-tudományi Kar Biomatematikai és Számítástechnikai Tanszék Biomatematika 13. Varianciaanaĺızis (ANOVA) Fodor János Copyright c Fodor.Janos@aotk.szie.hu Last Revision Date:
