CH 2 OX OH OX O XO OX O C CH 2 OH OH O HOOC
|
|
|
- Miklós Orbán
- 5 évvel ezelőtt
- Látták:
Átírás
1 1. Előadás A szerves kémiai tárgya, főbb történeti korszakainak jellemzése. A szénvegyületek csoportosítása, felosztás funkciós csoportok szerint. A kovalens kötés. Másodlagos kötések ( kötés stb).
2 1. A szerves kémia tárgya 1784 A szénvegyületek kémiája (A. L. Lavoisier, ) 1807 Szerves kémia J. J. Berzelius ( ) 1916 A kötést tartalmazó vegyületek és a metán. 2. A szerves kémia története 2.1. Felosztás Primitív kor ) Történeti kor ( ) Klasszikus kor ( ) Modern kor ( ) 2.2. Primitív kor (adatgyűjtés, metodika) Ókor alkoholos erjedés (arab) szeszes erjedés (bor-ecet) bőrcserzés bíborfestés (India, i.e. 2500) Középkor Alkímia (XI - XIV.sz.) aranycsinálás életelikszír (technika: retorta, fújtatók) O N N O homeopátia (Kína, i.e. 2500) - asztma, - vérnyomás
3 Philippus Aureolus Theophrastus Bombastus von ohenheim, Paracelsus, orvos, alkimista, író - Jatro (iatro) kémia gyógyszerkészítés - életfolyamatok kémiája (szemben áll az alkímiával) - Izolálás ( kivonatok ) pl. tannin (csersav), tölgyfakéreg, gubacs főzet indikáció: sebes bőr, gyomorfekély 2 OX O OX O XO OX X = penta-m-digalloil β D - glükóz O O O O O m-digalloil csoport O O O hidrolizis O 2 O O O O + OO O O D - glükóz O galluszsav O Kinai tölgy: 1 mol glükóz : 9-10 mol galluszsav Török tölgy: 1 mol glükóz : 5 mol galluszsav Szintézis: E. Fischer serzés: tannin plusz fehérje = csapadék
4 1550 kénéter (dietiléter) előállítása (Valerius ordus, ) 2 SO O 3 2 O flogiszton elmélet, G. E. Stahl ( ) 2.3. Történeti kor (izolálás, szintézis, izoméria, elmélet) Izolálások 1772 Metán Joseph Priestley, brit teológus, vegyész, Karbamid Borkősav, húgysav, benzoesav, oxálsav, tejsav, almasav, glicerin, citromsav.w. Scheele, svéd, gyógyszerész, Morfin F.W.Sertürner, francia, gyógyszerész (1817) principium somniferum alvásisten Somnus fia Morpheus Mák tejnedv ópium híg vizes oldat + N 3 csapadék + ecetsav oldat 1815 Koleszterin M.E. hevreul, francia vegyész hét zsírsav (pl. sztearinsav), glicerin
5 Klorofill, sztrichnin, brucin, kinin (kininfa), colchicin, koffein P. J. Pelletier, francia, vegyész, J. B. aventou, francia, gyógyszerész, Szintézisek 1781 szerves savak észterképzése, ásványi savakkal történő hidrolizise (.W. Scheele) 3 OO O 3 OO O 1786 Alkohol oxidácója ecetsavvá (A. L. Lavoisier) 3 2 O + O 2 3 OO 1824 Dicián (oxálsav nitril) hidolizise: sóskasav (oxálsav) (F. Wöhler, német, kémia tanár, ) N N + 2 O OO - OO 1834 Anilin szintézise (E. Mitscherlich, német, N. Zinyin, orosz) NO 2 N 2 redukció 1852 Szalicilsav szintézise (. Kolbe, német, ) (fűzfa (salix)-, nyárfakéreg) O O Na O Na O Na O o OO Na OO
6 Izoméria felfedezése 1815 optikai izoméria (polarimetria) Jean B. Biot, francia fizikus, izoméria, Justus Liebig, Friedrich Wöhler O - N : N - O ciánsav fulminsav N 4 O - N 2 N N 2 Fogalom: Ugyanazon elem atomjaiból épülnek fel, de eltérő szerkezetűek. (Berzelius, 1830) 1848 Optikai aktivitás molekuláris diszimmetria Borkősav izomerek szétválasztása optikailag aktív módosulatokra csipesszel Louis Pasteur, francia, vegyész, Elméletek ammonium cianát hevítés O karbamid 1784 Flogiszton J. Priestley, W. Scheele, A. L. Lavoisier 1828 Vis vitalis F. Wöhler K O - N + N 4 l N 4 O - szervetlen só N
7 Louis Pasteur ( )
8 1832 Gyökelmélet J. Liebig, F. Wöhler benzoil gyök (radikale, lat. radix = gyökér) l O N 2 O O O O ( 7 5 O), ( 7 5 O)l, ( 7 5 O)O, ( 7 5 O)N Szubsztituciós elmélet J. B. Dumas, (az MTA külső tagja) 3 OO 2 l OO l 3 OO 1853 Típuselmélet = Gyök + Szubsztitució F. A. Kekule von Stradonitz, típus : 2, l, 2 O, N 3, Klasszikus kor (izolálás, szintézis, izoméria, elmélet) Izolálások Szintézisek (szerkezetbizonyító szintézisek) 1865 Acetecetészter, 1871 Fenolftalein 1883 Antipirin, 1899 Aszpirin
9 Szerkezetbizonyítás kémiai reakciókkal lebontás 1861 kaucsuk izoprén 1866 naftalin (E. Erlenmayer) 1891 cukrok (E.Fischer) 1899 peptid aminosav felépítés 1886 koniin (Ladenburg) 1895 húgysav (E.Fischer) Elméletek Struktúra tan (Butlerov, ouper, Kekule) Az atomok határozott számú vegyértékeik útján kapcsolódnak molekulákká. A szénvegyületekben a szénatom négy vegyértékű és vegyértékeik egyformák. - Megadható a gyökök belső szerkezete, atomok kapcsolódása - Kémiai reakciók értelmezése (szerkezetvizsgálat) - Izoméria értelmezése.
10 Szintézisek tipizálása 1873 Acetecetészter szintézisek 1877 Friedel-rafts szintézisek 1880 Malonészter szintézisek 1899 Walden inverzió 1900 Grignard reakció (Nobel díj, 1912) 1874 Az optikai aktivitás szerkezeti magyarázata J.. van t off ( ), J. A. Le Bel ( ) Aszimmetrikus atom izoméria optikai aktivitás. Geometriai izoméria értelmezése.
11
12 2.5. Modern kor (izolálás, szintézis, módszer, elmélet) Módszerek kromatográfiák spektroszkópiák (UV, IR, NMR...) diffrakciós módszerek izotóptechnika Szerkezetbizonyító szintézisek 1929 emin. Fischer A-vitamin vitamin Szentgyörgyi A klorofil. Fischer R. B. Woodward nukleinsavak L. Levene A. R.Todd 1957 J. D. Watson M.. F. Wilkins F... rick inzulin F. Sanger Zahn 1973 B12 szintézis S. B. Woodward 1985 Fullerén. W. Kroto Elméletek szerves szervetlen , de fémorganikus: 1,5 millió
13 1916 Walter Kossel ( ) Gilbert N. Lewis ( ) - oktett-szabály - ionos és kovalens kötés megkülönböztetése 1919 Irving Langmuir ( ) - vegyérték oktett elmélete - elektronpárképződés kémia kötés 1927 Nevil V. Sidgwick ( ) The electronic theory of valence G. N. Lewis,. K. Ingold, L. Pauling - elektronegativitás/elektronaffinitás - kötések állandó polározottsága W. Pauli ( ) - periodusos-rendszer vs. elektronegativitás F (4,0) R. Robinson,. K. Ingold - mezoméria ( közbülső állapotok ) elmélete E I E II L. Pauling, G. W. Wheland Vegyértékkötés módszer ( valence bond ): molekula elektron-szerkezetét az alkotó atomokhoz tartozó vegyérték elektronokból hozza létre. F. ung, R. S. Mulliken, E. ückel Molekulapálya módszer ( molecular orbital ): a vegyértékelektronok több, a molekulát alkotó atom erőterében mozognak (delokalizáció). Kvantummechanika - kvantumdinamika
14 Linus arl Pauling ( ) Nobel díj 1954 (kémia): kémiai kötés természetének kutatása terén elért eredményeiért, és ezeknek.. a szerkezetmeghatározásban történő felhasználásáért Nobel díj 1962 (béke): a nukleáris fegyverek tesztelése ellen folytatott tevékenységéért
15 3. A szerves kémia Magyarországon XIX. Század Fabinyi Rudolf ( ) Vegytani Lapok XX. Század Széki Tibor ( ), Szeged 1935, Budapest 1948 Konek Frigyes ( ) Zechmeister László ( ), karotinoidok, tankönyv Zemplén Géza ( ), szénhidrátok, Műegyetem 1945 Tanszékek (Tudományegyetem, Műegyetem, Orvosi, Budapest, Szeged) Flavonoidok Bognár Rezső, KLTE Farkas Lóránd, BME Iskolák Szénhidrátok sűrős Zoltán, BME Deák Gyula, KOKI Kuszman János, GYOKI Karotinoidok holnoky László, PTE Elméleti kémia Müller Sándor, ELTE Lempert Károly, BME Messmer András, KKKI Kucsman Árpád, ELTE Peptidkémia Bruckner Győző, ELTE Bajusz Sándor, KOKI Kovács Kálmán, SZOTE Medzihradszky Kálmán, ELTE Szerkezetvizsgálat Kajtár Márton, ELTE Kálmán Alajos, KKKI
16 A KÍSÉRLETI EMIA ELEMEI I. Kötet : Általános chemia és elemi testek leírása. 1. könyv. Általános kémia 2. könyv. Az elemi testek leírása 1906 (?) II. Kötet : A törzsvegyületek és a carbonidok leírása. 3. könyv. A törzsvegyületek leírása 1908 Than Károly elhunyt 2005 Fábián Éva, Vegyészeti Múzeum, Várpalota 2007 Próder István levele 2013 Tömpe Péter, restaurálás, digitalizáció 2015 Megjelent az első szerves kémia tankönyv
17 Lapok a 300 oldalas kéziratból
18 4. A szénvegyületek csoportosítása 4.1. A szénatomok által alkotott váz szerint nyílt láncú (alifás) ciklusos heterociklusos izociklusos telített X X telítetlen X aliciklusos aromás X = N, O, S Paraffinok (alkán) Olefinek (alkén) telítetlen Acetilének (alkin)
19 4.2. Funkciós csoportok szerint alogéntartalmú vegyületek (halogénezett szénhidrogének) X Oxigéntartalmú vegyületek alkoholok O éterek O O aldehidek O ketonok karbonsavak karbonsav származékok Nitrogéntartalmú vegyületek aminok N 2 O OX N O O O nitro vegyületek N nitrozó vegyületek N O O Kéntartalmú vegyületek tiolok S tioéterek S Fémorganikus vegyületek > M > M < X
20 5. A kémiai kötés 5.1. Definició: Atomok, molekulák között vonzóerők léte esetén létrejövő tartós kapcsolat Kötéstípusok: Ionos W.Kossel (1916) > kj/mol poláros Kovalens G.N.Lewis (1916) apoláros egyszeres: kj/mol kettős: kj/mol Másodlagos o ion dipólus o dipólus dipólus o Van der Waals -kötés: 4-30 kj/mol dipol-dipol: kj/mol 5.3. Kötések elméleti értelmezése Bohr atom modell oktett elv (1916) Li..F N Rendszám (összes elektron) Vegyértékhéj K (lezárt) L ajtóerő: lezárt héj Módszer : a) elektron transzfer, b) elektron megosztás
21 a) Elektron transzfer pl. Li F Li - 1e Li 4-4e F F 4 + 1e + 4e b) Elektron megosztás pl. 4 4 Szimmetrikus A kötő elektronpár szimmetrikusan oszlik meg a két atom között. A A pl., N N o izolált molekula (gáz) o apoláros kötés o apoláros molekula Aszimmetrikus A kötő elektronpár közelebb húzódik a nagyobb elektron negativitású atomhoz. A B pl. B EN > A EN o folyadék, szilárd o poláros kötés o poláros molekula EN értékek 2,5 O 3,5 2,15 F 3,95 N 3,0 EN értékek EN = 2,5 2,15 = 0,35 F EN = 1,45 O EN = 1,0 N EN = 0,5
22 Kvantumelméleti megközelítés Kísérletekből adódó tapasztalatok: o Kötéstávolságok eltérőek (egyszeres, kettős, hármas..) o Kötésszög eltérő (pl. metán 109 o, víz O 104 o, 2 S 93 o ) o Töltéseloszlás aszimmetrikus o Sztereoizoméria, optikai aktivitás o Eltérő kémiai reaktivitás (egyszeres, kettős, hármas..) Példák: 1,54 Å, 109 o 1,34 Å 116,7 o ; 121,6 o 1,29 Å 180 o Elméleti megfontolások: 1924 L. De Broglie Az elektron részecske és hullám E. Schrödinger Az elektron energiája kifejezhető egy hullámfüggvény (Ψ) megoldásaként. Pauli elv: Egyazon atomban két vagy több elektron nem lehet egyidejűleg ugyanabban a kvantumállapotban. und szabály: Újabb kvantumpályára elektron nem kerül, amíg van betöltetlen, alacsonyabb energiájú pályán hely. Schrödinger egyenlet: a) differenciál egyenlet b) megoldásai hullámfüggvények (Ψ n, n = 1,...) c) a hullámfüggvényhez tartozó sajátérték az elektron energiája (E n, n = 1,...)
23 Atompályák
24 Molekulapálya (MO) módszer ibridizált atomi pályák (VB) módszer Lásd A szénvegyületek kötései fejezet
25 A kémiai kötés leírása (összegzés) ullámegyenlet 1. ullámfüggvény (Ψ n, n = 1, 2...) 2. Energia (E n, n = 1, 2...) Atomok Atompályák (AO) (Ψ, E) Atompályák lineáris kombinációja (LAO módszer) Molekulák Molekulapályák (MO) (Ψ m, E m) ibridizált atompályák (Linus Pauling, 1930 ) ibridizált atompályák kombinációja (VB módszer)
26 6. A szénvegyületek kötései - négyes, hármas, kettes koordinációs számú szénatommal. 7. Elektron effektusok. Konjugált kötés. 8. Szénvegyületek térbeli ábrázolása, projektív képletek.
27 6. A szénvegyületek kötései Szempont: A atom koordinációs száma Koordinációs szám: a kiválasztott szén atom körül elhelyezkedő atomok (ligandumok) száma, lehet 4,3 vagy 2 Konfiguráció: a térbeli elrendeződés egy bizonyos módja, az azonos atomhoz kapcsolódó ligandumok egymáshoz viszonyított térbeli elrendeződése. lehet: tetraéderes, piramisos, koplanáris, lineáris 6.1.Szénatom négyes koordinációs számmal 4, l 4 Jellemzés: - atom a középpontban van, - négy ligandum, - a négy ligandum a atomhoz közel, de egymástól távol van, - egyforma kötésszögek (109 o ), - tetraéderes konfiguráció. Bizonyíték: optikai izoméria
28 Levezetés: pálya hibridizáció
29
30 6.2. Szénatom hármas koordinációs számmal 2 2, 2 Jellemzés: - atom a középpontban van, - három ligandum, - a négy atom egy síkban van, - a három ligandum a atomhoz közel, de egymástól távol van, - kötésszög YX és XX 120 o, - planáris konfiguráció. O Bizonyíték: geometriai izoméria Levezetés: (a gerjesztett állapot) pálya hibridizáció
31
32 6.3. Szénatom kettes koordinációs számmal, Jellemzés: - atom a középpontban van, - két ligandum, - a három atom egyvonalban van, - a két ligandum a atomhoz közel, de egymástól távol van, - kötésszög 180 o, - lineáris konfiguráció. N Levezetés: (a gerjesztett állapot) pálya hibridizáció
33
34 6.4. Kiterjesztés: N,O tartalmú vegyületekre amin imin nitril oxi oxo
35 7. Elektroneffektusok: indukció és konjugáció Kötéstípusok σ-kötés (sp 3 ) X(s) pl. (sp 3 ) X(p) pl. F (sp 3 ) X(sp 3 ) pl. Tengelyirányú átfedés engerszimmetria 340 kj/mol π-kötés Oldalirányú átfedés (sp 2 ) [(sp 2 )] 3 (p) σ-kötés π-kötés Tükörszimmetria 265 kj/mol π
36 7. 2. Elektroneffektusok eredete és típusai Eredete: Elektronegativitásbeli (EN) különbségek. Elektron eloszlásbeli különbségek. Típusai: KÖTÉS (rövidítés) ELNEVEZÉS JELÖLÉS STATIKUS DINAMIKUS σ Induktív I s I D π Konjugációs v. tautomer M (mezomer) E (elektromer)
37 INDUKTÍV EFFEKTUS: STATIKUS (I S ) Eredete - Két különböző EN atom kovalens kötésben Mértéke - kötő elektronpár eltolódása. Dipólusmomentum (dipólusnyomaték) µ = e l [Debye] ha 1 Å távolságban van egy elektronnyi negatív illetve pozitív töltés, akkor µ = 4,8 D Mérése - Dielektromos állandó (ε) (paraffin: 1,9-2, 2, víz: 81, EtO: 24) Példák: 3 3 δ+ δ Az effektus előjele: µ=0 µ=0,4d µ =1,86 D (gázfázisú víz) δ+ δ δ δ+ X Y EN X > EN - I-effektus X: elektronvonzó EN Y < EN + I-effektus Y: elektronküldő
38 -atomhoz kapcsolódó induktív effektusok Konfiguráció EN = (sp) > (sp 2 ) >>> (sp 3 ) -I - effektus: propin propilén metil-benzol δ+ δ+ 2 > ; δ+ +I-effektus: < 2 < 3 Rendűség EN = - 3 > > ( 3 ) 2 > ( 3 ) 3 +I-effektus: 3 3 δ+ 3 3 X > X > 3 δ+ δ+ 3 2 X t Butil i Propil Etil Lánchossz EN = - 3 > > > δ+ δ+ δ+ +I-effektus: 3 ( 2 ) 3 X > 3 ( 2 ) 2 X > 3 2 X
39 alogénatomok -I-effektusa [ALKIL-ALOGENIDEK] EN = F > l > Br > I alogén milyensége: 3 F > 3 l > 3 Br > 3 I δ+ δ+ δ+ δ+ µ 1,83 1,86 1,82 1,48 -atom rendűsége (primer, szekunder, tercier): 3 δ+ 3 δ+ δ+ 3 2 Br < Br < 3 Br 3 3 µ 1,88 2,04 2,21 -lánc hosszúsága: δ+ δ+ δ+ 3 Br < 3 2 Br < Br µ 1,82 1,88 1,93 Br δ γ β α
40 Szubsztituált karbonsavak aciditása pk a 2 OO 4,76 I 2 OO 3,12 Br 2 OO 2,87 F 2 OO 2,68 - I-effektus: F > l > Br > I Szubsztituált karbonsavak aciditása pk a 3 2 l OO 2,86 3 l 2 OO 4,05 2 l 2 2 OO 4, OO 4,82 -I-effektus: X > X > X α β γ δ+ O O Értelmezés O O - + +
41 INDUKTÍV EFFEKTUS: DINAMIKUS (I D ) Eredete - Külső erőtér hatására a kovalens kötés (kötő elektronpár, σ kötés) polarizálódik. Külső erőtér - Ionok - Dipólus σ-kötések érzékenysége Tapasztalat: > N > O > F I > Br > l > F - Nagy statikus I effektus jelenléte esetén kicsi a dinamikus I effektus hatása. - Kis statikus I effektus jelenléte esetén a kötés érzékeny, nagy a dinamikus effektus hatása.
42 KONJUGÁIÓS EFFEKTUS : STATIKUS (MEZOMER) [M] Eredete - Két különböző EN atom között lokalizált π-elektronok, Példák: kötő elektronpár eltolódása. (EN O > EN ) O O 2 : + M O: - M A π-elektronok három v. több atom erőterében delokalizálódnak: A) a a π-kötések konjugált helyzetben vannak 2 2 1,3- butadién B) a a π-kötésben résztvevő atomhoz nem-kötő elektronpárt tartalmazó atom is kapcsolódik 2 l vinil-klorid 2 =: -M l: +M Előjel: Az atom, amely felé a π-elektronok elmozdulnak M effektust képes kiváltani; amelyről elmozdultak, + M effektusra képes.
43 KONJUGÁIÓS EFFEKTUS : DINAMIKUS (ELEKTROMER) [E] Eredete - Külső erőtér hatására két atom között lokalizált π-elektronok (kötés) polarizálódik. A külső hatás megszűntével eltűnik. Külső erőtér - Ionok - Dipólus Tapasztalat: Teljes töltésszétválasztást is létrejöhet. Példa: O 2 O formaldehid Electron-effektusok együttes megjelenése O O 1-butén 1-propanal µ = 0,3 D µ = 2,5 D O -I-effektus -I-effektus, -M-effektus
44 7.4. Konjugált kötés Definíció: Olyan kovalens kötések rendszere, amelyben két kettős/hármas kötést egy egyszeres kötés választ el egymástól. LINEÁRISAN KONJUGÁLT rendszer IKLIKUSAN KONJUGÁLT rendszer O N N N N N N N N Definíció: Olyan kovalens kötések rendszere, amelyben a kettős kötésben résztvevő -atomhoz nem-kötő elektront vagy elektronpárt tartalmazó atom kapcsolódik. O 2 l vinil-klorid fenolát anion
45 Lineárisan konjugált rendszerek a) Röntgen (X-ray) diffrakció b) Brómozás 1,37Å 1,37Å Br 2 1,48Å várható kötéshossz: (sp 3 ) (sp 3 ) 1,54Å (sp 2 ) (sp 2 ) 1,34Å 2 2 Br Br 3,4-dibróm-1-butén 2 2 Br 1,4-dibróm-2-butén Br c) UV spektrum Likopin (11 kettős kötés) λ max [nm] vörös E=h ν
46 ÉRTELMEZÉS: 1. Az egyszeres és kettős kötések kölcsönhatnak. 2. Nincsenek külön (izolált) egyszeres és kettős kötések, hanem a π-elektronok az egész molekulára kiterjedő, delokalizált molekulapályán mozognak. LEÍRÁS (példa: 1,3-butadién) 1. Oktett elv alapján (rezonancia szabályok, határszerkezetek). 2. MO elmélet alapján (atomi pályák kombinációja). SZERKEZETÁBRÁZOLÁS AZ OKTETT-ELV ALAPJÁN atárszerkezetek (I,II.) I E II III IV 2 2 V VI, VII, VIII
47 Rezonancia szabályok a) egységes szerkezet, oszcilláció nincs b) azonos számú π-elektron (π-kötés, magános elektronpár) c) azonos geometria, π-elektronok lokalizációja azonos (a valóságos) planáris σ-vázon d) elvileg lehetséges határszerkezetek felírása; - határszerkezetek súlyozása az izolált π-kötések száma szerint; - izovalens, heterovalens és poláros határszerkezetek III 2 2 V e) magas energiaértékű határszerkezetek elhanyagolása. Pl. V igen valószínűtlen. f) nem-egyforma energiaértékű határszerkezetek: a valóságos szerkezet a legkisebb energiájú határszerkezethez hasonlít g) egyforma energiaértékű határszerkezetek: a valóságos szerkezet mindkettőtől erősen eltér IV
48 SZERKEZETÁBRÁZOLÁS AZ MO ELMÉLET ALAPJÁN 1,3-butadién: 22 vegyértékelektron; 11 kötő elektronpár σ-váz: 18 vegyértékelektron; 9 kötő elektronpár π-rendszer: 4 vegyértékelektron; 2 kötő elektronpár A. 4 π elektron 4 atomi p-pályán (lokalizált) B. 4 π elektron 2 bicentrikus π-pályán. 4 π elektron 4 atomi p-pálya kombinációján (p 1 +p 2 ) (p 3 +p 4 ) Φ Φ E Φ Φ
49 iklikusan konjugált rendszerek a) Kötéstávolság (sp 3 ) (sp 3 ) 1,54Å b) Reaktivitás (összevetés) (sp 2 ) (sp 2 ) 1,34Å (benzol) 1,39Å Nincs különbség. (Nincs izoméria.) Reagens 2 = = = 2 1,3,5-hexatrién NO 2 NO 3 / 2 SO 4 Br c) UV spektrum Br 2 + FeBr 3 2 /kat. Br 2 = = 2 Br 1,6-dibróm-2,4-butadién hexán λ max [nm] 2 = = = ÉRTELMEZÉS: 1. Nincs izolált egyszeres és kettős kötés. 2. A π-elektronok delokalizálódnak a teljes kötésrendszeren.
50 AROMÁS VEGYÜLETEK (Aroma [ἄρωµα, görög] fűszer, kellemes illat) AROMÁS JELLEG FELTÉTELEI = aromás = nem aromás 1. A gyűrűt felépítő atomok egy síkban vannak, koplanáris szerkezet, sp 2 konfiguráció. 2. A gyűrűt felépítő atomoknak van egy, a síkra merőleges szabad p pályája. 3. A delokalizált molekulapályára kerülő p és/vagy nem-kötő elektronok száma 4n + 2, ahol n = 0,1,2... (ÜKEL - szabály)
51 Példák benzol naftalin bifenil piridin ciklopropén ciklopropenil ciklobutadién pirrol imidazol N N N N ciklo- ciklopentadienil adenin pentadién kation gyök anion cikloheptadién cikloheptadienil pirillium kation kation gyök anion O
52 SZERKEZETÁBRÁZOLÁS AZ OKTETT-ELV ALAPJÁN
53 SZERKEZETÁBRÁZOLÁS AZ MO ELMÉLET ALAPJÁN σ - váz: 6 db (sp 2 ) (sp 2 ) kötés: 12 elektron 6 db (sp 3 ) (s) kötés: 12 elektron π - váz: 6db (p) 6 elektron 30 elektron σ π 6 p-pálya lineáris kombinációja: 3 kötő, 3 lazító molekulapálya Jellemzés: a pályák folyamatos és folytonos átfedése, planáris gyűrű, kötés szögek: < 120º < 120º
54 8. Szerkezetábrázolás Szerkezeti képletek (vegyértékelmélet, 1870) N O Összevont szerkezeti képletek (1916) ( 3 ) N 2 O 2 O 2 O 2 2 N
55 Elektronképletek (oktett elmélet) O N O O l l l
56 Rudas gömbmodellek (Dreiding modell) Kötéshossz arányos rudak, atom: gömb, tetraéder
57 Stuart-Briegleb modellek Méret- és alakhű modellek (kötéshossz, kötésszög, hatórádiusz)
58 Sztereoképletek
59
60 Egy példa: n-bután, 4 10 Molekula (összeg) képlet: 4 10 Szerkezeti képlet: sík képlet egyszerűsített konstituciós képletek térbeli éleket leíró konstituciós képlet konformációs képlet
Követelmények a Szerves Kémia tárgyból tanárszakos és biológia BSc szakos (2016-ban vagy korábban felvett) hallgatóknak
 Követelmények a Szerves Kémia tárgyból tanárszakos és biológia BSc szakos (2016-ban vagy korábban felvett) hallgatóknak 1. A félév végén az előadás vizsgával zárul. Ez írásbeli és szóbeli részből áll.az
Követelmények a Szerves Kémia tárgyból tanárszakos és biológia BSc szakos (2016-ban vagy korábban felvett) hallgatóknak 1. A félév végén az előadás vizsgával zárul. Ez írásbeli és szóbeli részből áll.az
Követelmények a Szerves Kémia tárgyból I. éves biológia BSc szakos hallgatók részére
 Követelmények a Szerves Kémia tárgyból I. éves biológia BSc szakos hallgatók részére 1. A félév végén az előadás vizsgával zárul. Ez írásbeli és szóbeli részből áll.az irásbeli vizsga eredményes, ha az
Követelmények a Szerves Kémia tárgyból I. éves biológia BSc szakos hallgatók részére 1. A félév végén az előadás vizsgával zárul. Ez írásbeli és szóbeli részből áll.az irásbeli vizsga eredményes, ha az
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
A kovalens kötés elmélete. Kovalens kötésű molekulák geometriája. Molekula geometria. Vegyértékelektronpár taszítási elmélet (VSEPR)
 4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
Elektronegativitás. Elektronegativitás
 Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Bevezetés. Szénvegyületek kémiája Organogén elemek (C, H, O, N) Életerő (vis vitalis)
 Szerves kémia Fontos tudnivalók Tárgy neve: Kémia alapjai I. Neptun kód: SBANKE1050 Előadó: Borzsák István C121 szerda 11-12 e-mail: iborzsak@ttk.nyme.hu http://www.bdf.hu/ttk/fldi/iborzsak/dokumentumok/
Szerves kémia Fontos tudnivalók Tárgy neve: Kémia alapjai I. Neptun kód: SBANKE1050 Előadó: Borzsák István C121 szerda 11-12 e-mail: iborzsak@ttk.nyme.hu http://www.bdf.hu/ttk/fldi/iborzsak/dokumentumok/
3. A kémiai kötés. Kémiai kölcsönhatás
 3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
A kovalens kötés polaritása
 Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Kémiai kötés Lewis elmélet
 Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis-elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis-elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Javító vizsga követelményei kémia tantárgyból augusztus osztály
 Javító vizsga követelményei kémia tantárgyból 2019. augusztus 29. 10. osztály I. Szerves kémia-bevezetés 1. A szerves kémia kialakulása, tárgya (Tk. 64-65 old.) - Lavoisier: organogén elemek (C, H, O,
Javító vizsga követelményei kémia tantárgyból 2019. augusztus 29. 10. osztály I. Szerves kémia-bevezetés 1. A szerves kémia kialakulása, tárgya (Tk. 64-65 old.) - Lavoisier: organogén elemek (C, H, O,
Szerves Kémia. Farmakológus szakasszisztens képzés 2012/2013 ősz
 Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) kelep@elte.hu sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) kelep@elte.hu sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
A hidrogénmolekula. Energia
 A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík Energia
A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík Energia
Osztályozó vizsgatételek. Kémia - 9. évfolyam - I. félév
 Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Szénhidrogének III: Alkinok. 3. előadás
 Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Kötések kialakítása - oktett elmélet
 Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Kémiai kötések. Kémiai kötések. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
A hidrogénmolekula. Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve!
 Energia A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík
Energia A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík
Nitrogéntartalmú szerves vegyületek. 6. előadás
 Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Periódusos rendszer (Mengyelejev, 1869) nemesgáz csoport: zárt héj, extra stabil
 s-mezı (fémek) Periódusos rendszer (Mengyelejev, 1869) http://www.ptable.com/ nemesgáz csoport: zárt héj, extra stabil p-mezı (nemfém, félfém, fém) d-mezı (fémek) Rendezés elve: növekvı rendszám (elektronszám,
s-mezı (fémek) Periódusos rendszer (Mengyelejev, 1869) http://www.ptable.com/ nemesgáz csoport: zárt héj, extra stabil p-mezı (nemfém, félfém, fém) d-mezı (fémek) Rendezés elve: növekvı rendszám (elektronszám,
Általános és szervetlen kémia 3. hét Kémiai kötések. Kötések kialakítása - oktett elmélet. Lewis-képlet és Lewis szerkezet
 Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Tantárgycím: Szerves kémia
 Eötvös Loránd Tudományegyetem Természettudományi Kar Biológia Szak Kötelező tantárgy TANTÁRGY ADATLAP és tantárgykövetelmények 2005. Tantárgycím: Szerves kémia 2. Tantárgy kódja félév Követelmény Kredit
Eötvös Loránd Tudományegyetem Természettudományi Kar Biológia Szak Kötelező tantárgy TANTÁRGY ADATLAP és tantárgykövetelmények 2005. Tantárgycím: Szerves kémia 2. Tantárgy kódja félév Követelmény Kredit
A kémiai kötés. Kémiai kölcsönhatás
 A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer energia szintek atomokban
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer energia szintek atomokban
Szalai István. ELTE Kémiai Intézet 1/74
 Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74 Periodikus
Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74 Periodikus
Szénhidrogének II: Alkének. 2. előadás
 Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Általános és szervetlen kémia 3. hét. Kémiai kötések. Kötések kialakítása - oktett elmélet. Az elızı órán elsajátítottuk, hogy.
 Általános és szervetlen kémia 3. hét Az elızı órán elsajátítottuk, hogy milyen a kvantummechanikai atommodell hogyan épül fel a periódusos rendszer melyek a periodikus tulajdonságok Mai témakörök elsıdleges
Általános és szervetlen kémia 3. hét Az elızı órán elsajátítottuk, hogy milyen a kvantummechanikai atommodell hogyan épül fel a periódusos rendszer melyek a periodikus tulajdonságok Mai témakörök elsıdleges
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
Szabó Dénes Molekulák és reakciók három dimenzióban
 Szabó Dénes Molekulák és reakciók három dimenzióban Alkímia ma, 2012. április 19. Egy kis tudománytörténet -O azonos kémiai szerkezet -O Scheele (1769) -O különböző tulajdonságok -O Kestner (1822) borkősav
Szabó Dénes Molekulák és reakciók három dimenzióban Alkímia ma, 2012. április 19. Egy kis tudománytörténet -O azonos kémiai szerkezet -O Scheele (1769) -O különböző tulajdonságok -O Kestner (1822) borkősav
KARBONSAVAK. A) Nyílt láncú telített monokarbonsavak (zsírsavak) O OH. karboxilcsoport. Példák. pl. metánsav, etánsav, propánsav...
 KABNSAVAK karboxilcsoport Példák A) Nyílt láncú telített monokarbonsavak (zsírsavak) "alkánsav" pl. metánsav, etánsav, propánsav... (nem használjuk) omológ sor hangyasav 3 2 2 2 valeriánsav 3 ecetsav 3
KABNSAVAK karboxilcsoport Példák A) Nyílt láncú telített monokarbonsavak (zsírsavak) "alkánsav" pl. metánsav, etánsav, propánsav... (nem használjuk) omológ sor hangyasav 3 2 2 2 valeriánsav 3 ecetsav 3
HALOGÉNEZETT SZÉNHIDROGÉNEK
 ALOGÉNEZETT SZÉNIDOGÉNEK Elnevezés Nyíltláncú, telített általános név: halogénalkán alkilhalogenid l 2 l 2 2 l klórmetán klóretán 1klórpropán l metilklorid etilklorid propilklorid 2klórpropán izopropilklorid
ALOGÉNEZETT SZÉNIDOGÉNEK Elnevezés Nyíltláncú, telített általános név: halogénalkán alkilhalogenid l 2 l 2 2 l klórmetán klóretán 1klórpropán l metilklorid etilklorid propilklorid 2klórpropán izopropilklorid
AROMÁS SZÉNHIDROGÉNEK
 AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
ALKOHOLOK ÉS SZÁRMAZÉKAIK
 ALKLK ÉS SZÁRMAZÉKAIK Levezetés R R alkohol R R R éter Elnevezés Nyíltláncú, telített alkoholok általános név: alkanol alkil-alkohol 2 2 2 metanol etanol propán-1-ol metil-alkohol etil-alkohol propil-alkohol
ALKLK ÉS SZÁRMAZÉKAIK Levezetés R R alkohol R R R éter Elnevezés Nyíltláncú, telített alkoholok általános név: alkanol alkil-alkohol 2 2 2 metanol etanol propán-1-ol metil-alkohol etil-alkohol propil-alkohol
Fizikai kémia 2. Előzmények. A Lewis-féle kötéselmélet A VB- és az MO-elmélet, a H 2+ molekulaion
 06.07.5. Fizikai kémia. 4. A VB- és az -elmélet, a H + molekulaion Dr. Berkesi ttó ZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Előzmények Az atomok szerkezetének kvantummehanikai leírása 90-30-as
06.07.5. Fizikai kémia. 4. A VB- és az -elmélet, a H + molekulaion Dr. Berkesi ttó ZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Előzmények Az atomok szerkezetének kvantummehanikai leírása 90-30-as
Részletes tematika: I. Félév: 1. Hét (4 óra): 2. hét (4 óra): 3. hét (4 óra): 4. hét (4 óra):
 Részletes tematika: I. Félév: 1. Hét (4 óra): Szerves Vegyületek Szerkezete. Kötéselmélet Lewis kötéselmélet; atompálya, molekulapálya; molekulapálya elmélet; átlapolódás, orbitálok hibridizációja; molekulák
Részletes tematika: I. Félév: 1. Hét (4 óra): Szerves Vegyületek Szerkezete. Kötéselmélet Lewis kötéselmélet; atompálya, molekulapálya; molekulapálya elmélet; átlapolódás, orbitálok hibridizációja; molekulák
SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit
 SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit b) Tárgyalják összehasonlító módon a csoport első elemének
SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit b) Tárgyalják összehasonlító módon a csoport első elemének
Helyettesített karbonsavak
 elyettesített karbonsavak 1 elyettesített savak alogénezett savak idroxisavak xosavak Dikarbonsavak Aminosavak (és fehérjék, l. Természetes szerves vegyületek) 2 alogénezett savak R az R halogént tartalmaz
elyettesített karbonsavak 1 elyettesített savak alogénezett savak idroxisavak xosavak Dikarbonsavak Aminosavak (és fehérjék, l. Természetes szerves vegyületek) 2 alogénezett savak R az R halogént tartalmaz
FELADATMEGOLDÁS. Tesztfeladat: Válaszd ki a helyes megoldást!
 FELADATMEGOLDÁS Tesztfeladat: Válaszd ki a helyes megoldást! 1. Melyik sorozatban található jelölések fejeznek ki 4-4 g anyagot? a) 2 H 2 ; 0,25 C b) O; 4 H; 4 H 2 c) 0,25 O; 4 H; 2 H 2 ; 1/3 C d) 2 H;
FELADATMEGOLDÁS Tesztfeladat: Válaszd ki a helyes megoldást! 1. Melyik sorozatban található jelölések fejeznek ki 4-4 g anyagot? a) 2 H 2 ; 0,25 C b) O; 4 H; 4 H 2 c) 0,25 O; 4 H; 2 H 2 ; 1/3 C d) 2 H;
Kémiai alapismeretek 3. hét
 Kémiai alapismeretek 3. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2013. szeptember 17.-20. 1/15 2013/2014 I. félév, Horváth Attila c : Molekulákon
Kémiai alapismeretek 3. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2013. szeptember 17.-20. 1/15 2013/2014 I. félév, Horváth Attila c : Molekulákon
Farkas Ödön és Gáspári Zoltán Molekuláris informatika előadás és gyakorlat. Tematika
 Farkas Ödön és Gáspári Zoltán Molekuláris informatika előadás és gyakorlat Tematika 1., történet; Molekulák reprezentációja I. 2. Molekulák reprezentációja II. 3. Reakciók reprezentációja; Kémiai adatbázisok
Farkas Ödön és Gáspári Zoltán Molekuláris informatika előadás és gyakorlat Tematika 1., történet; Molekulák reprezentációja I. 2. Molekulák reprezentációja II. 3. Reakciók reprezentációja; Kémiai adatbázisok
CH 2 =CH-CH 2 -S-S-CH 2 -CH=CH 2
 10. Előadás zerves vegyületek kénatommal Példák: ZEVE VEGYÜLETEK KÉATMMAL CH 2 =CH-CH 2 ---CH 2 -CH=CH 2 diallil-diszulfid (fokhagyma olaj) H H H szacharin merkapto-purin tiofén C H2 H szulfonamid (Ultraseptyl)
10. Előadás zerves vegyületek kénatommal Példák: ZEVE VEGYÜLETEK KÉATMMAL CH 2 =CH-CH 2 ---CH 2 -CH=CH 2 diallil-diszulfid (fokhagyma olaj) H H H szacharin merkapto-purin tiofén C H2 H szulfonamid (Ultraseptyl)
20/10/2016 tema04_biolf_
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Egy egyszerű modell a kémiai kötések kialakítására:
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Egy egyszerű modell a kémiai kötések kialakítására:
Energiaminimum- elve
 Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Kémia a kétszintű érettségire
 Korrekciók a 2017-től érvényes módosított érettségi követelmények a Kémia a kétszintű érettségire című kiadványban Műszaki Könyvkiadó Villányi Attila, Műszaki Könyvkiadó, 2016 Műszaki Könyvkiadó Kft. 2519
Korrekciók a 2017-től érvényes módosított érettségi követelmények a Kémia a kétszintű érettségire című kiadványban Műszaki Könyvkiadó Villányi Attila, Műszaki Könyvkiadó, 2016 Műszaki Könyvkiadó Kft. 2519
Fémorganikus kémia 1
 Fémorganikus kémia 1 A fémorganikus kémia tárgya a szerves fémvegyületek előállítása, szerkezetvizsgálata és kémiai reakcióik tanulmányozása A fémorganikus kémia fejlődése 1760 Cadet bisz(dimetil-arzén(iii))-oxid
Fémorganikus kémia 1 A fémorganikus kémia tárgya a szerves fémvegyületek előállítása, szerkezetvizsgálata és kémiai reakcióik tanulmányozása A fémorganikus kémia fejlődése 1760 Cadet bisz(dimetil-arzén(iii))-oxid
Heterociklusos vegyületek
 Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések
 Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
A tételek: Elméleti témakörök. Általános kémia
 A tételek: Elméleti témakörök Általános kémia 1. Az atomok szerkezete az atom alkotórészei, az elemi részecskék és jellemzésük a rendszám és a tömegszám, az izotópok, példával az elektronszerkezet kiépülésének
A tételek: Elméleti témakörök Általános kémia 1. Az atomok szerkezete az atom alkotórészei, az elemi részecskék és jellemzésük a rendszám és a tömegszám, az izotópok, példával az elektronszerkezet kiépülésének
Alkánok összefoglalás
 Alkánok összefoglalás Nem vagyok különösebben tehetséges, csak szenvedélyesen kíváncsi. Albert Einstein Rausch Péter kémia-környezettan tanár Szénhidrogének Szénhidrogének Telített Telítetlen Nyílt láncú
Alkánok összefoglalás Nem vagyok különösebben tehetséges, csak szenvedélyesen kíváncsi. Albert Einstein Rausch Péter kémia-környezettan tanár Szénhidrogének Szénhidrogének Telített Telítetlen Nyílt láncú
Szerves kémia Fontosabb vegyülettípusok
 Fontosabb vegyülettípusok Szénhidrogének: alifás telített (metán, etán, propán, bután, ) alifás telítetlen (etén, etin, ) aromás (benzol, toluol, naftalin) Oxigéntartalmú vegyületek: hidroxivegyületek
Fontosabb vegyülettípusok Szénhidrogének: alifás telített (metán, etán, propán, bután, ) alifás telítetlen (etén, etin, ) aromás (benzol, toluol, naftalin) Oxigéntartalmú vegyületek: hidroxivegyületek
Kémiai kötések. Kémiai kötések kj / mol 0,8 40 kj / mol
 Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
szerotonin idegi mûködésben szerpet játszó vegyület
 3 2 2 3 2 3 2 3 2 2 3 3 1 amin 1 amin 2 amin 3 amin 2 3 3 2 3 1-aminobután butánamin n-butilamin 2-amino-2-metil-propán 2-metil-2-propánamin tercier-butilamin 1-metilamino-propán -metil-propánamin metil-propilamin
3 2 2 3 2 3 2 3 2 2 3 3 1 amin 1 amin 2 amin 3 amin 2 3 3 2 3 1-aminobután butánamin n-butilamin 2-amino-2-metil-propán 2-metil-2-propánamin tercier-butilamin 1-metilamino-propán -metil-propánamin metil-propilamin
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Az anyagszerkezet alapjai. Az atomok felépítése
 Az anyagszerkezet alapjai Az atomok felépítése Kérdések Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Az anyagszerkezet alapjai Az atomok felépítése Kérdések Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Tartalmi követelmények kémia tantárgyból az érettségin K Ö Z É P S Z I N T
 1. Általános kémia Atomok és a belőlük származtatható ionok Molekulák és összetett ionok Halmazok A kémiai reakciók A kémiai reakciók jelölése Termokémia Reakciókinetika Kémiai egyensúly Reakciótípusok
1. Általános kémia Atomok és a belőlük származtatható ionok Molekulák és összetett ionok Halmazok A kémiai reakciók A kémiai reakciók jelölése Termokémia Reakciókinetika Kémiai egyensúly Reakciótípusok
Összefoglaló előadás. Sav-bázis elmélet
 Összefoglaló előadás Sav-bázis elmélet SAV-BÁZIS TULAJDNSÁGKAT BEFLYÁSLÓ TÉNYEZŐK Elméletek: 1. Brönsted Lowry elmélet: sav - + donor; bázis - + akceptor; Konjugálódó (vagy korrespondáló) sav-bázis pár:
Összefoglaló előadás Sav-bázis elmélet SAV-BÁZIS TULAJDNSÁGKAT BEFLYÁSLÓ TÉNYEZŐK Elméletek: 1. Brönsted Lowry elmélet: sav - + donor; bázis - + akceptor; Konjugálódó (vagy korrespondáló) sav-bázis pár:
Toluol (Bruckner II/1 476) µ= 0.33 Debye
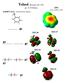 E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
TANMENETJAVASLAT. Maróthy Miklósné KÉMIA éveseknek. címû tankönyvéhez
 TANMENETJAVASLAT Maróthy Miklósné KÉMIA 14 16 éveseknek címû tankönyvéhez 9. osztály 10.osztály éves órakeret 55 óra 74 óra 55 óra 74 óra (1,5 óra/hét) (2 óra/hét) (1,5 óra/hét) (2 óra/hét) bevezetés 1
TANMENETJAVASLAT Maróthy Miklósné KÉMIA 14 16 éveseknek címû tankönyvéhez 9. osztály 10.osztály éves órakeret 55 óra 74 óra 55 óra 74 óra (1,5 óra/hét) (2 óra/hét) (1,5 óra/hét) (2 óra/hét) bevezetés 1
A periódusos rendszer, periodikus tulajdonságok
 A periódusos rendszer, periodikus tulajdonságok Szalai István ELTE Kémiai Intézet 1/45 Az előadás vázlata ˆ Ismétlés ˆ Történeti áttekintés ˆ Mengyelejev periódusos rendszere ˆ Atomsugár, ionsugár ˆ Ionizációs
A periódusos rendszer, periodikus tulajdonságok Szalai István ELTE Kémiai Intézet 1/45 Az előadás vázlata ˆ Ismétlés ˆ Történeti áttekintés ˆ Mengyelejev periódusos rendszere ˆ Atomsugár, ionsugár ˆ Ionizációs
tema04_
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai A kötések kialakulásának oka: energianyereség. A kémiai kötés típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai A kötések kialakulásának oka: energianyereség. A kémiai kötés típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett
A kémiai kötés magasabb szinten
 A kémiai köté magaabb zinten 5-1 Mit kell tudnia a kötéelméletnek? 5- Vegyérték köté elmélet 5-3 Atompályák hibridizációja 5-4 Többzörö kovalen kötéek 5-5 Molekulapálya elmélet 5-6 Delokalizált elektronok:
A kémiai köté magaabb zinten 5-1 Mit kell tudnia a kötéelméletnek? 5- Vegyérték köté elmélet 5-3 Atompályák hibridizációja 5-4 Többzörö kovalen kötéek 5-5 Molekulapálya elmélet 5-6 Delokalizált elektronok:
KÉMIA 9-12. évfolyam (Esti tagozat)
 KÉMIA 9-12. évfolyam (Esti tagozat) A kémiai alapműveltség az anyagi világ megismerésének és megértésének egyik fontos eszköze. A kémia tanulása olyan folyamat, amely tartalmain és tevékenységein keresztül
KÉMIA 9-12. évfolyam (Esti tagozat) A kémiai alapműveltség az anyagi világ megismerésének és megértésének egyik fontos eszköze. A kémia tanulása olyan folyamat, amely tartalmain és tevékenységein keresztül
SZERVES KÉMIAI REAKCIÓEGYENLETEK
 SZERVES KÉMIAI REAKCIÓEGYENLETEK Budapesti Reáltanoda Fontos! Sok reakcióegyenlet több témakörhöz is hozzátartozik. Szögletes zárójel jelzi a reakciót, ami más témakörnél található meg. Alkánok, cikloalkánok
SZERVES KÉMIAI REAKCIÓEGYENLETEK Budapesti Reáltanoda Fontos! Sok reakcióegyenlet több témakörhöz is hozzátartozik. Szögletes zárójel jelzi a reakciót, ami más témakörnél található meg. Alkánok, cikloalkánok
Az anyagszerkezet alapjai
 Kérdések Az anyagszerkezet alapjai Az atomok felépítése Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Kérdések Az anyagszerkezet alapjai Az atomok felépítése Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Az anyagszerkezet alapjai. Az atomok felépítése
 Az anyagszerkezet alapjai Az atomok felépítése Kérdések Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Az anyagszerkezet alapjai Az atomok felépítése Kérdések Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Budapest, szeptember 5. Dr. Tóth Tünde egyetemi docens
 SZERVES KÉMIA I. levelező B.Sc. képzés, kód: BMEVESZAL17 Tantárgy követelményei 2016/2017. tanév I. félév Az alaptárgy heti 2,5 óra (páratlan héten 2 óra, páros héten 3 óra) előadásból és ezzel integrált
SZERVES KÉMIA I. levelező B.Sc. képzés, kód: BMEVESZAL17 Tantárgy követelményei 2016/2017. tanév I. félév Az alaptárgy heti 2,5 óra (páratlan héten 2 óra, páros héten 3 óra) előadásból és ezzel integrált
Vegyületek - vegyületmolekulák
 Vegyületek - vegyületmolekulák 3.Az anyagok csoportosítása összetételük szerint Egyszerű összetett Azonos atomokból állnak különböző atomokból állnak Elemek vegyületek keverékek Fémek Félfémek Nemfémek
Vegyületek - vegyületmolekulák 3.Az anyagok csoportosítása összetételük szerint Egyszerű összetett Azonos atomokból állnak különböző atomokból állnak Elemek vegyületek keverékek Fémek Félfémek Nemfémek
Bevezetés. Tanítani haszontalan, kivéve, ha felesleges. Rausch Péter kémia-környezettan tanár. Richard Feynman
 Bevezetés Tanítani haszontalan, kivéve, ha felesleges. Richard Feynman Rausch Péter -környezettan tanár Általános Szerves Analitikai Szervetlen KÉMIA Elméleti Mag Fizikai A szerves kialakulása 1773-ban
Bevezetés Tanítani haszontalan, kivéve, ha felesleges. Richard Feynman Rausch Péter -környezettan tanár Általános Szerves Analitikai Szervetlen KÉMIA Elméleti Mag Fizikai A szerves kialakulása 1773-ban
1. KARBONILCSOPORTOT TARTALMAZÓ VEGYÜLETEK
 1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul
1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
A szervetlen vegyületek
 5. Vegyületek osztályozása, egyszerű szerves funkciós csoportok, fontosabb szervetlen és szerves vegyületek nagyon sokféle vegyület van, többféle csoportosítás lehet hasznos szervetlen vegyületek - szerves
5. Vegyületek osztályozása, egyszerű szerves funkciós csoportok, fontosabb szervetlen és szerves vegyületek nagyon sokféle vegyület van, többféle csoportosítás lehet hasznos szervetlen vegyületek - szerves
10. ÉVFOLYAM. Szerves kémia
 10. ÉVFOLYAM Szerves kémia 1. Bevezetés a szerves kémiába értsék meg, hogy nincs elvi különbség a szervetlen és a szerves vegyületek között, tudják, hogy a szén lánc- és gyűrűképző tulajdonságú, és értsék
10. ÉVFOLYAM Szerves kémia 1. Bevezetés a szerves kémiába értsék meg, hogy nincs elvi különbség a szervetlen és a szerves vegyületek között, tudják, hogy a szén lánc- és gyűrűképző tulajdonságú, és értsék
AMINOK. Aminok rendűsége és típusai. Levezetés. Elnevezés. Alkaloidok (fiziológiailag aktív vegyületek) A. k a. primer RNH 2. szekunder R 2 NH NH 3
 Levezetés AMIK 2 primer 2 2 3 2 3 3 2 3 2 3 3 2 3 2 2 3 3 1 amin 1 amin 2 amin 3 amin 1aminobután butánamin nbutilamin Aminok rendűsége és típusai 2amino2metilpropán 2metil2propánamin tercierbutilamin
Levezetés AMIK 2 primer 2 2 3 2 3 3 2 3 2 3 3 2 3 2 2 3 3 1 amin 1 amin 2 amin 3 amin 1aminobután butánamin nbutilamin Aminok rendűsége és típusai 2amino2metilpropán 2metil2propánamin tercierbutilamin
A cukrok szerkezetkémiája
 A cukrok szerkezetkémiája A cukrokról,szénhidrátokról általánosan o o o Kémiailag a cukrok a szénhidrátok,vagy szacharidok csoportjába tartozó vegyületek. A szacharid arab eredetű szó,jelentése: édes.
A cukrok szerkezetkémiája A cukrokról,szénhidrátokról általánosan o o o Kémiailag a cukrok a szénhidrátok,vagy szacharidok csoportjába tartozó vegyületek. A szacharid arab eredetű szó,jelentése: édes.
Helyettesített Szénhidrogének
 elyettesített Szénhidrogének 1 alogénezett szénhidrogének 2 3 Alifás halogénvegyületek Szerkezet Kötéstávolság ( ) omolitikus disszociációs energia (kcal/mol) Alkil-F 1,38 116 Alkil-l 1,77 81 Alkil-Br
elyettesített Szénhidrogének 1 alogénezett szénhidrogének 2 3 Alifás halogénvegyületek Szerkezet Kötéstávolság ( ) omolitikus disszociációs energia (kcal/mol) Alkil-F 1,38 116 Alkil-l 1,77 81 Alkil-Br
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai. Kémiai kötés kialakulásának oka: energianyereség.
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett elmélet (1916-19
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett elmélet (1916-19
SEGÉDANYAG az MS-3151 Kémia Érettségire felkészítő könyv használatához. Részletes kémia érettségi követelmények változása 2017.
 SEGÉDANYAG az MS-3151 Kémia 11-12. Érettségire felkészítő könyv használatához Részletes kémia érettségi követelmények változása 2017. január 1-től Az érettségi követelményrendszer változása alapvetően
SEGÉDANYAG az MS-3151 Kémia 11-12. Érettségire felkészítő könyv használatához Részletes kémia érettségi követelmények változása 2017. január 1-től Az érettségi követelményrendszer változása alapvetően
7. évfolyam kémia osztályozó- és pótvizsga követelményei Témakörök: 1. Anyagok tulajdonságai és változásai (fizikai és kémiai változás) 2.
 7. évfolyam kémia osztályozó- és pótvizsga követelményei 1. Anyagok tulajdonságai és változásai (fizikai és kémiai változás) 2. Hőtermelő és hőelnyelő folyamatok, halmazállapot-változások 3. A levegő,
7. évfolyam kémia osztályozó- és pótvizsga követelményei 1. Anyagok tulajdonságai és változásai (fizikai és kémiai változás) 2. Hőtermelő és hőelnyelő folyamatok, halmazállapot-változások 3. A levegő,
Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 4. hét
 Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 4. hét Szerves kémia ismétlése, a szerves kémiai ismeretek gyakorlása a biokémiához Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus
Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 4. hét Szerves kémia ismétlése, a szerves kémiai ismeretek gyakorlása a biokémiához Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus
A SZILÁRDTEST FOGALMA. Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. molekula klaszter szilárdtest > σ λ : rel.
 A SZILÁRDTEST FOGALMA Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. a) Méret: b) Szilárdság: molekula klaszter szilárdtest > ~ 100 Å ideálisan rugalmas test: λ = 1 E σ λ : rel. megnyúlás
A SZILÁRDTEST FOGALMA Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. a) Méret: b) Szilárdság: molekula klaszter szilárdtest > ~ 100 Å ideálisan rugalmas test: λ = 1 E σ λ : rel. megnyúlás
Periciklusos reakciók
 Periciklusos reakciók gyűrűs átmeneti állapoton keresztül, köztitermék képződése nélkül, egyetlen lépésben lejátszódó ( koncertáló ) reakciókat Woodward javaslatára periciklusos reakcióknak nevezzük. Ezeknek
Periciklusos reakciók gyűrűs átmeneti állapoton keresztül, köztitermék képződése nélkül, egyetlen lépésben lejátszódó ( koncertáló ) reakciókat Woodward javaslatára periciklusos reakcióknak nevezzük. Ezeknek
Tartalomjegyzék. Szénhidrogének... 1
 Tartalomjegyzék Szénhidrogének... 1 Alkánok (Parafinok)... 1 A gyökök megnevezése... 2 Az elágazó szénláncú alkánok megnevezése... 3 Az alkánok izomériája... 4 Előállítás... 4 1) Szerves magnéziumvegyületekből...
Tartalomjegyzék Szénhidrogének... 1 Alkánok (Parafinok)... 1 A gyökök megnevezése... 2 Az elágazó szénláncú alkánok megnevezése... 3 Az alkánok izomériája... 4 Előállítás... 4 1) Szerves magnéziumvegyületekből...
SZERVES KÉMIA: BEVEZETÉS SZTEREOKÉMIA. Debreceni Egyetem ÁOK Orvosi Vegytani Intézet
 SZERVES KÉMIA: BEVEZETÉS SZTEREOKÉMIA Debreceni Egyetem ÁOK Orvosi Vegytani Intézet www.medchem.unideb.hu A szén allotróp módusulatai a) gyémánt b) grafit c) amorf szén (nincs ábrázolva) A grafénő egyetlen
SZERVES KÉMIA: BEVEZETÉS SZTEREOKÉMIA Debreceni Egyetem ÁOK Orvosi Vegytani Intézet www.medchem.unideb.hu A szén allotróp módusulatai a) gyémánt b) grafit c) amorf szén (nincs ábrázolva) A grafénő egyetlen
O 2 R-H 2 C-OH R-H 2 C-O-CH 2 -R R-HC=O
 Funkciós csoportok, reakcióik II C 4 C 3 C 2 C 2 R- 2 C- R- 2 C--C 2 -R C 2 R-C= ALKLK, ÉTEREK Faszesz C 3 Toxikus 30ml vakság LD 50 értékek alkoholokra patkányokban LD 50 = A populáció 50%-ának elhullásához
Funkciós csoportok, reakcióik II C 4 C 3 C 2 C 2 R- 2 C- R- 2 C--C 2 -R C 2 R-C= ALKLK, ÉTEREK Faszesz C 3 Toxikus 30ml vakság LD 50 értékek alkoholokra patkányokban LD 50 = A populáció 50%-ának elhullásához
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
H 3 C CH 2 CH 2 CH 3
 3. Előadás Konstitució, konfiguráció, konformáció. Az izoméria fajtái. A sztereoizoméria. A kettős kötéshez kapcsolódó izoméria jelenségek. Az optikai izoméria. Az optikai aktivitás és mérése. 9. Konstitúció,
3. Előadás Konstitució, konfiguráció, konformáció. Az izoméria fajtái. A sztereoizoméria. A kettős kötéshez kapcsolódó izoméria jelenségek. Az optikai izoméria. Az optikai aktivitás és mérése. 9. Konstitúció,
Kémiai kötés: több atom reakcióba lépése során egy közös, stabil (telített) külső elektronhéj alakul ki.
 19. Kémiai kötések (Elsődleges és másodlagos kötések. Elektronegativitás, elektronaffinitás, ionizációs energia. Ionos, fémes és kovalens kötés. A kovalens kötések fajtái, működésük, osztályozásuk, hibridizáció.
19. Kémiai kötések (Elsődleges és másodlagos kötések. Elektronegativitás, elektronaffinitás, ionizációs energia. Ionos, fémes és kovalens kötés. A kovalens kötések fajtái, működésük, osztályozásuk, hibridizáció.
A szervetlen vegyületek
 5. Vegyületek osztályozása, egyszerű szerves funkciós csoportok, fontosabb szervetlen és szerves vegyületek nagyon sokféle vegyület van, többféle csoportosítás lehet hasznos szervetlen vegyületek - szerves
5. Vegyületek osztályozása, egyszerű szerves funkciós csoportok, fontosabb szervetlen és szerves vegyületek nagyon sokféle vegyület van, többféle csoportosítás lehet hasznos szervetlen vegyületek - szerves
Versenyző rajtszáma: 1. feladat
 1. feladat / 5 pont Jelölje meg az alábbi vegyület valamennyi királis szénatomját, és adja meg ezek konfigurációját a Cahn Ingold Prelog (CIP) konvenció szerint! 2. feladat / 6 pont 1887-ben egy orosz
1. feladat / 5 pont Jelölje meg az alábbi vegyület valamennyi királis szénatomját, és adja meg ezek konfigurációját a Cahn Ingold Prelog (CIP) konvenció szerint! 2. feladat / 6 pont 1887-ben egy orosz
A kémiatanári zárószigorlat tételsora
 1. A. tétel A kémiatanári zárószigorlat tételsora Kémiai alapfogalmak: Atom- és molekulatömeg, anyagmennyiség, elemek és vegyületek elnevezése, jelölése. Kémiai egyenlet, sztöchiometria. A víz jelentősége
1. A. tétel A kémiatanári zárószigorlat tételsora Kémiai alapfogalmak: Atom- és molekulatömeg, anyagmennyiség, elemek és vegyületek elnevezése, jelölése. Kémiai egyenlet, sztöchiometria. A víz jelentősége
4. változat. 2. Jelöld meg azt a részecskét, amely megőrzi az anyag összes kémiai tulajdonságait! A molekula; Б atom; В gyök; Г ion.
 4. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
4. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
ORVOSI KÉMIA. Az anyag szerkezete
 ORVOSI KÉMIA Az anyag szerkezete Nagy Veronika PTE ÁOK 2017/18. Egyes ábrákat a Chemistry c. (McMurry & Fay, 4 th ed.) könyvből vettünk át. Tanulási célok Az anyagot felépítő elemi részecskék (atomok,
ORVOSI KÉMIA Az anyag szerkezete Nagy Veronika PTE ÁOK 2017/18. Egyes ábrákat a Chemistry c. (McMurry & Fay, 4 th ed.) könyvből vettünk át. Tanulási célok Az anyagot felépítő elemi részecskék (atomok,
8. Előadás Karbonsavak. Karbonsav származékok.
 8. Előadás Karbonsavak. Karbonsav származékok. 24. Karbonsavak α H X H H X N karbonsav nitril X Név F, Br, l halogénsav H hidroxisav oxosav NH 2 aminosav X Név F, Br, l savhaloid R észter R anhidrid NH
8. Előadás Karbonsavak. Karbonsav származékok. 24. Karbonsavak α H X H H X N karbonsav nitril X Név F, Br, l halogénsav H hidroxisav oxosav NH 2 aminosav X Név F, Br, l savhaloid R észter R anhidrid NH
Kormeghatározás gyorsítóval
 Beadás határideje 2012. január 31. A megoldásokat a kémia tanárodnak add oda! 1. ESETTANULMÁNY 10. évfolyam Olvassa el figyelmesen az alábbi szöveget és válaszoljon a kérdésekre! Kormeghatározás gyorsítóval
Beadás határideje 2012. január 31. A megoldásokat a kémia tanárodnak add oda! 1. ESETTANULMÁNY 10. évfolyam Olvassa el figyelmesen az alábbi szöveget és válaszoljon a kérdésekre! Kormeghatározás gyorsítóval
